Содержание
- 2. Открытие металлов Магний и кальций были впервые получены английским химиком и физиком Г. Дэви в 1808
- 3. Положение в периодической таблице. Строение атома В периодической системе находятся в главной подгруппе II группы. Являются
- 4. Соединения щелочноземельных металлов Оксиды щелочноземельных металлов легко реагируют с оксидами неметаллов с образованием соответствующих солей.
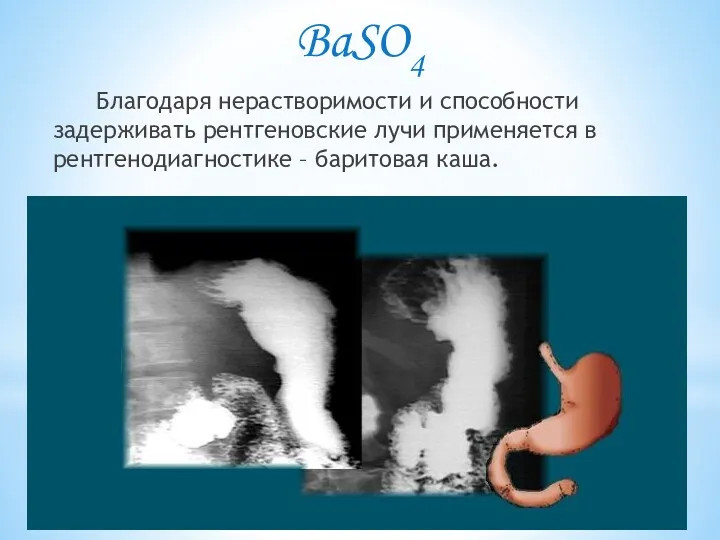
- 5. BaSO4 Благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике – баритовая каша.
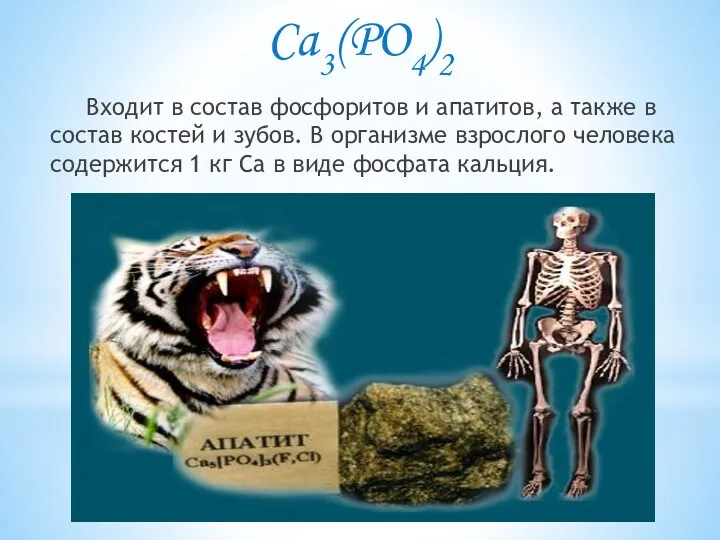
- 6. Ca3(PO4)2 Входит в состав фосфоритов и апатитов, а также в состав костей и зубов. В организме
- 7. CaCO3 Карбонат кальция – одно из самых распространённых на Земле соединений. Его содержат горные породы –
- 8. CaSO4∙ 2H2O Встречается в природе в виде минерала гипса, представляющего собой кристаллогидрат. Используется в строительстве, в
- 9. MgCO3 Широко применяется в производстве стекла, цемента, кирпича, а также в металлургии для перевода пустой породы
- 10. Са(ОН)2 Гидроксид кальция или гашёная известь с песком и водой называется известковым раствором и широко используется
- 11. Физические свойства Кальций - твердый и пластичный Щелочные металлы легкие, мягкие и легкоплавкие, серебристы, стронций имеет
- 12. Химические свойства 1. Металлы взаимодействуют почти со всеми неметаллами: 2Ме0 + О20 =2Ме+2О-2 (оксид) Ме0 +
- 13. Химические свойства 2. Бериллий с водой не реагирует, магний реагирует медленно, остальные металлы реагируют с водой,
- 14. Нахождение в природе Как активные металлы, они встречаются в природе только в виде соединений Кальциевые горные
- 16. Скачать презентацию











 Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Альдегиды и кетоны. 10 класс
Альдегиды и кетоны. 10 класс Углеводы, монозы, биозы. Лекция 15
Углеводы, монозы, биозы. Лекция 15 Безазотистые вторичные метаболиты минорных групп в фармации. Биохимия, функциональное значение в царстве растений
Безазотистые вторичные метаболиты минорных групп в фармации. Биохимия, функциональное значение в царстве растений ae2db93272ef42dba476a56bbc56b895
ae2db93272ef42dba476a56bbc56b895 S-элементтердің жалпы сипаттамасы
S-элементтердің жалпы сипаттамасы Степени окисления атомов и формулы веществ
Степени окисления атомов и формулы веществ Хімічний лабіринт
Хімічний лабіринт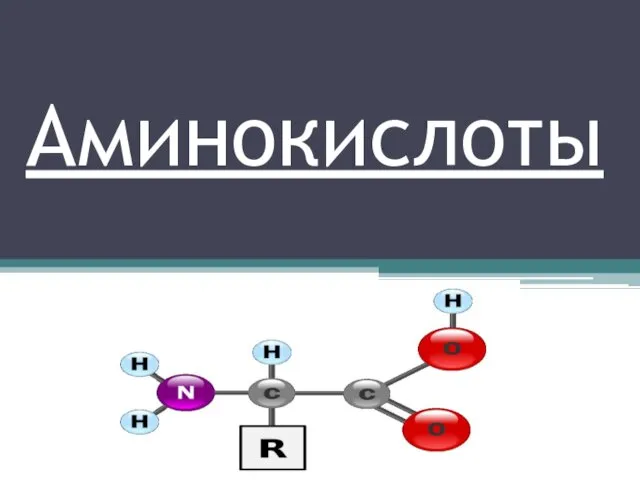 Аминокислоты. Классификация аминокислот
Аминокислоты. Классификация аминокислот Жесткость воды и способы её устранения
Жесткость воды и способы её устранения Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Главная подгруппа V группы..Азот
Главная подгруппа V группы..Азот Поделочные камни
Поделочные камни Экспериментальные методы физико-химических исследований. Лекция 7
Экспериментальные методы физико-химических исследований. Лекция 7 Кислород. 8 класс
Кислород. 8 класс Чисті речовини і суміші
Чисті речовини і суміші Электролиз
Электролиз Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз
Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Методы титрования. Перманганатометрия. (Лекция 24)
Методы титрования. Перманганатометрия. (Лекция 24) Химические свойства металлов
Химические свойства металлов Гидролиз солей
Гидролиз солей Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії
Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії Каменный уголь
Каменный уголь Электродные системы
Электродные системы Методы разделения белковых смесей. Электрофорез
Методы разделения белковых смесей. Электрофорез Анализ 3% раствора водорода пероксида
Анализ 3% раствора водорода пероксида Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования