Содержание
- 2. Основные понятия и законы химии Лекция 1
- 3. Химия – это наука, изучающая процессы превращения веществ, сопровождающиеся изменением состава и структуры, а также взаимные
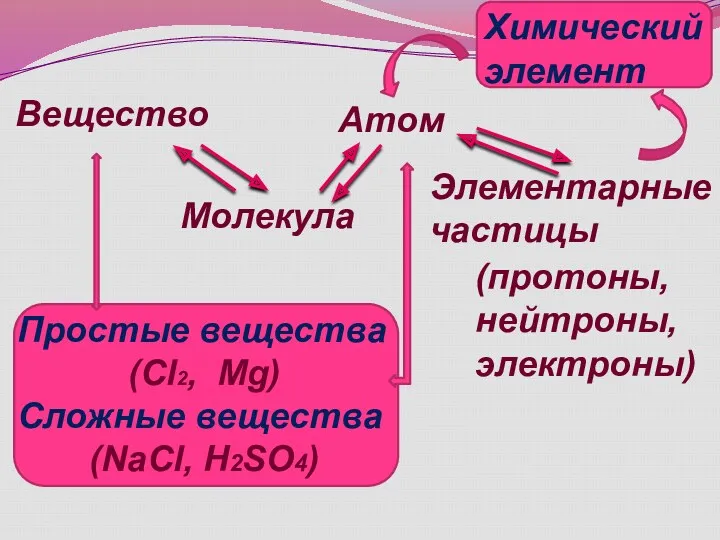
- 5. Вещество Молекула Атом Элементарные частицы Химический элемент (протоны, нейтроны, электроны) Простые вещества (Cl2, Mg) Сложные вещества
- 6. Молекула – наименьшая частица вещества, обладающая его химическими свойствами. Атом – наименьшая частица химического элемента, обладающая
- 9. Моль – это единица измерения количества вещества, содержащая столько молекул, атомов или других структурных единиц, сколько
- 11. Na2O + H2O = 2NaOH CaO + H2O = Ca(OH)2 Химические реакции MgO + 2HCl =
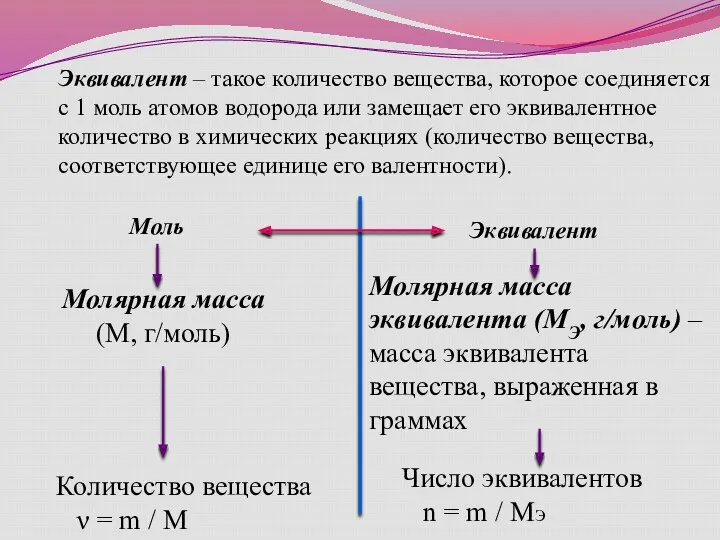
- 12. Эквивалент – такое количество вещества, которое соединяется с 1 моль атомов водорода или замещает его эквивалентное
- 13. МЭ = f⋅M (f – фактор эквивалентности). Вычисление фактора эквивалентности: Для простых веществ и элементов в
- 14. 3. Для оксидов и солей f = 1 / n⋅В (n – число атомов металла в
- 17. Число эквивалентов: n = m / МЭ (для любого вещества); n = V / VЭ (для
- 19. Скачать презентацию














 Железо как химический элемент
Железо как химический элемент Менделеевские уроки. День науки
Менделеевские уроки. День науки Окислительно- восстановительные реакции
Окислительно- восстановительные реакции Роль хімії у житті суспільства
Роль хімії у житті суспільства Классы неорганических веществ
Классы неорганических веществ Инструменты и приспособления для химической завивки волос
Инструменты и приспособления для химической завивки волос Альдегіди
Альдегіди Процессы нитрозирования и основные реакции диазосоединений
Процессы нитрозирования и основные реакции диазосоединений Цикли трикарбонових кислот
Цикли трикарбонових кислот Химические реакторы. Лекция №10
Химические реакторы. Лекция №10 Карбоновые кислоты. (10 класс)
Карбоновые кислоты. (10 класс) Изучение раздела Углеводороды в курсе органической химии в старшей школе
Изучение раздела Углеводороды в курсе органической химии в старшей школе Химические связи в органических соединениях
Химические связи в органических соединениях Арены - ароматические соединения
Арены - ароматические соединения Токсичні характеристики найбільш розповсюджених небезпечних хімічних речовин і симптоми ураження
Токсичні характеристики найбільш розповсюджених небезпечних хімічних речовин і симптоми ураження Химическая связь в кристаллах
Химическая связь в кристаллах Тамақ өнімдерінің құрылымын және физико-химиялық қасиеттерін өзгертетін тағамдық қоспалар
Тамақ өнімдерінің құрылымын және физико-химиялық қасиеттерін өзгертетін тағамдық қоспалар Углеводы. Общая формула углеводов Сn(H2O)m
Углеводы. Общая формула углеводов Сn(H2O)m Характеристика щелочных металлов
Характеристика щелочных металлов Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Минералы и горные породы
Минералы и горные породы Заттардың формулалары және химиялық реакция теңдеулері
Заттардың формулалары және химиялық реакция теңдеулері Оксиды. Химические свойства. Способы получения
Оксиды. Химические свойства. Способы получения Титриметрический метод анализа
Титриметрический метод анализа Коллигативные свойства растворов
Коллигативные свойства растворов Сополимеры в стоматологии
Сополимеры в стоматологии Основы термодинамики
Основы термодинамики Химический элемент уран
Химический элемент уран