Содержание
- 2. История развития катализа 1480 год. Превращение спирта под действием купоросного масла (серная кислота) с образованием эфира.
- 3. Определение катализа К началу ХIХ века накопились данные о существовании обширной группы аномальных реакций с внестехиометрическим
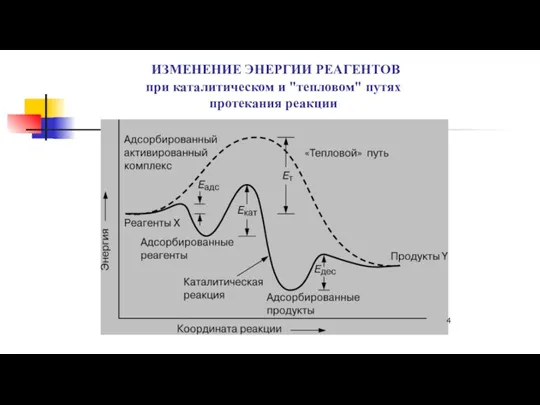
- 4. ИЗМЕНЕНИЕ ЭНЕРГИИ РЕАГЕНТОВ при каталитическом и "тепловом" путях протекания реакции
- 5. Выводы из энергетической диаграммы Катализатор предлагает альтернативный путь для реакции, который, очевидно, более сложен, но энергетически
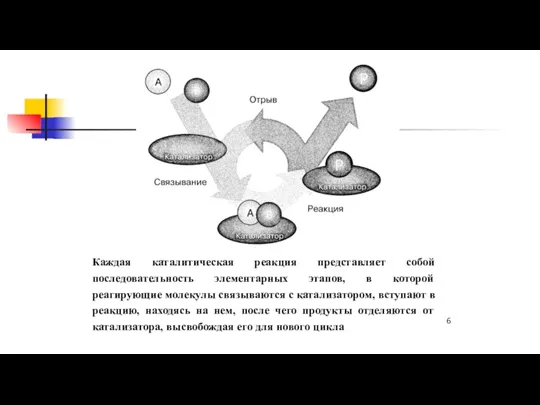
- 6. Каждая каталитическая реакция представляет собой последовательность элементарных этапов, в которой реагирующие молекулы связываются с катализатором, вступают
- 7. Стадии каталитической реакции координация (адсорбция) исходных реагентов на активном центре активация субстратов и образование ими химического
- 8. Водород и оксид углерода при комнатной температуре не взаимодействуют между собой. В присутствии медьсодержащего катализатора практически
- 9. Типы каталитических систем гомогенная, когда реакционная смесь и катализатор находятся или в жидком или в газообразном
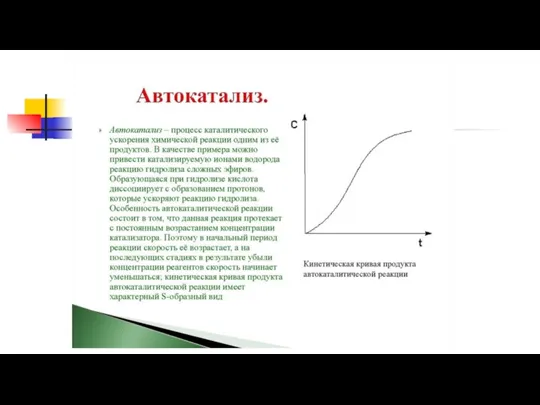
- 11. Процесс, в котором осуществляется гомогенная или ферментативная каталитическая реакция, – однофазный процесс, и к нему применимы
- 12. Определение катализатора Катализатор — это вещество (индивидуальное химические соединение или их смесь), присутствие которого в смеси
- 13. ГЕТЕРОГЕННО-КАТАЛИТИЧЕСКИЙ ХИМИЧЕСКИЙ ПРОЦЕСС В гетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах. Например, катализатор
- 14. Теория мономолекулярной адсорбции (И. Ленгмюр) основывается на следующих положениях. Адсорбция является локализованной и вызывается силами, близкими
- 15. Закон действующих поверхностей Каталитическая реакция протекает за счет превращения молекулы на адсорбционном (активном) центре. В реакции
- 16. Изотерма адсорбции Ленгмюра (для ассоциативной адсорбции) уравнение Ленгмюра: где am - максимальная адсорбция b - адсорбционный
- 18. Скачать презентацию












 Соединения химических элементов. Урок-игра. 8 класс
Соединения химических элементов. Урок-игра. 8 класс Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Химическая связь
Химическая связь Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6
Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6 большая стирка
большая стирка Алкадиены. Гомологический ряд, номенклатура и изомерия
Алкадиены. Гомологический ряд, номенклатура и изомерия Химическая связь
Химическая связь Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату Ароматические соединения - арены
Ароматические соединения - арены Водородная связь
Водородная связь Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей Атомный и ионный радиусы. Принципы шаровых упаковок
Атомный и ионный радиусы. Принципы шаровых упаковок Азот и его соединения
Азот и его соединения Технология оптического стекла
Технология оптического стекла Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Электрохимические процессы
Электрохимические процессы Простые вещества
Простые вещества Кислород
Кислород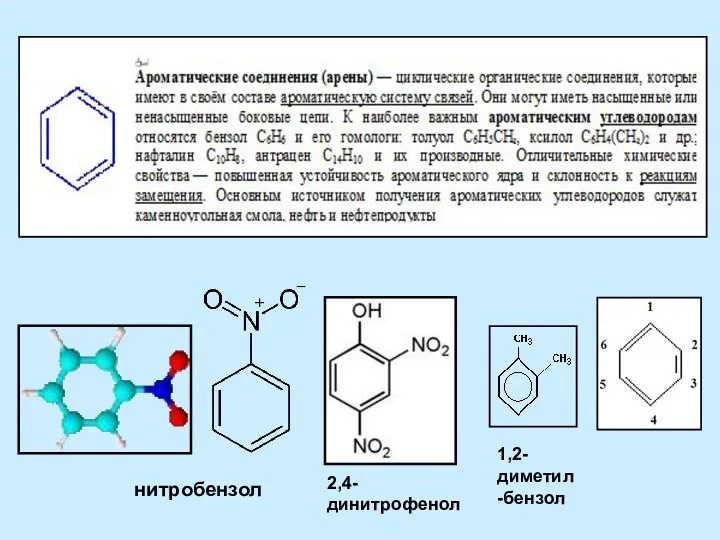 Ароматические соединения (арены)
Ароматические соединения (арены) Алкалоидтар
Алкалоидтар Лекция 2. Строение атома и Периодический закон Д.И. Менделеева
Лекция 2. Строение атома и Периодический закон Д.И. Менделеева Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Общая характеристика твердого, жидкого и газообразного видов топлива
Общая характеристика твердого, жидкого и газообразного видов топлива Химия в строительстве
Химия в строительстве Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Углерод
Углерод