Содержание
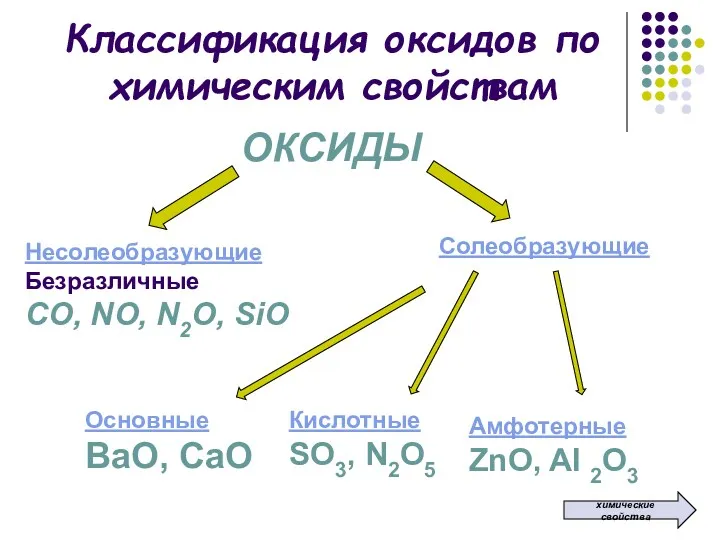
- 2. Классификация оксидов по химическим свойствам ОКСИДЫ Несолеобразующие Безразличные СО, NO, N2O, SiO Солеобразующие Основные ВаО, СаО
- 3. Несолеобразующие оксиды – это оксиды, которые не взаимодействуют ни с кислотами, ни с основаниями и не
- 4. Солеобразующие оксиды – это оксиды, которые взаимодействуют с кислотами или со щелочами с образованием солей и
- 5. Основные оксиды – это оксиды, которым в качестве гидроксидов соответствуют основания Образованы металлами в степени окисления
- 6. Кислотные оксиды – это оксиды, которым в качестве гидроксидов соответствуют кислоты Образованы неметаллами и металлами в
- 7. Амфотерные оксиды – это оксиды, которым соответствуют гидроксиды, проявляющие свойства как оснований, так и кислот Образованы
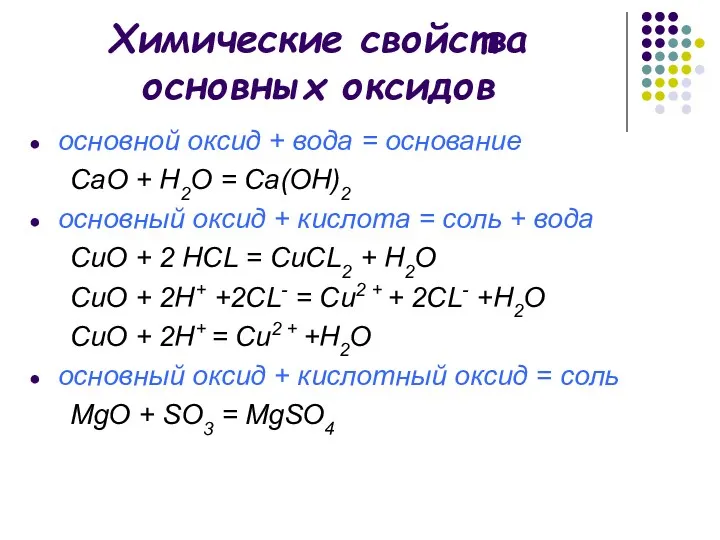
- 8. Химические свойства основных оксидов основной оксид + вода = основание СаO + H2O = Са(OН)2 основный
- 9. Химические свойства кислотных оксидов кислотный оксид + вода = кислота Р2O5 + 3H2O = 2H3РO4 кислотный
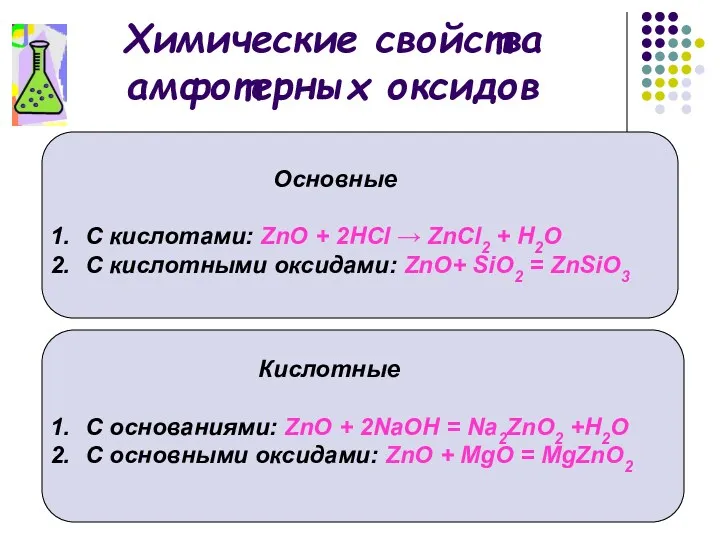
- 10. Химические свойства амфотерных оксидов Основные С кислотами: ZnO + 2НСl → ZnСl2 + Н2О С кислотными
- 12. Скачать презентацию






 Газовые законы для идеальных и реальных газов. Лекция 1
Газовые законы для идеальных и реальных газов. Лекция 1 Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов
Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов Ископаемые углеводороды
Ископаемые углеводороды Методы прямого секвенирования белков (пептидов)
Методы прямого секвенирования белков (пептидов) Неметаллы. Обобщающий урок. 9 класс
Неметаллы. Обобщающий урок. 9 класс Синтез нуклеотидов
Синтез нуклеотидов Методы пробоотбора воздуха. Лекция 2
Методы пробоотбора воздуха. Лекция 2 Химическая стойкость тугоплавких металлов в различных реагентах
Химическая стойкость тугоплавких металлов в различных реагентах Соединения углерода
Соединения углерода The chemistri of life and the micro universe
The chemistri of life and the micro universe Определение химического элемента на основании расчетов по химическим реакциям
Определение химического элемента на основании расчетов по химическим реакциям Классификация органических соединений. Урок химии в 10 классе
Классификация органических соединений. Урок химии в 10 классе Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма)
Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма) Химическое равновесие. Азот и Фосфор. 9 класс
Химическое равновесие. Азот и Фосфор. 9 класс Миграция химических элементов (геохимическая миграция)
Миграция химических элементов (геохимическая миграция) Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей
Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей Кислородсодержащие соединения. Ароматические соединения
Кислородсодержащие соединения. Ароматические соединения Серная кислота
Серная кислота Трансмиссионные масла
Трансмиссионные масла Хімічні властивості кислот
Хімічні властивості кислот Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон
Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон Комплексные соединения
Комплексные соединения Кислоты в свете теории электролитической диссоциации (ТЭД), 8 класс
Кислоты в свете теории электролитической диссоциации (ТЭД), 8 класс Аналитическая химия. Предмет и задачи
Аналитическая химия. Предмет и задачи Теория электрической диссоциации
Теория электрической диссоциации NaOH. Гидроксид натрия
NaOH. Гидроксид натрия Углеводы Cn(H2O)m
Углеводы Cn(H2O)m Ансамбль пор в реальном твердом теле
Ансамбль пор в реальном твердом теле