Содержание
- 4. Лекция 1 Важнейшие понятия химии. Агрегатные состояния веществ. Газовые законы для идеальных и реальных газов
- 5. Химия – это система знания о веществах и системах, изучающая строение веществ и их превращения, сопровождающиеся
- 6. Классификация систем (по типу взаимодействия с окружающей средой) 1. Изолированные - нет обмена с окружающей средой
- 7. Характеристика систем: Равновесные - это системы, в которых важнейшие параметры не меняются во времени. Это равновесие
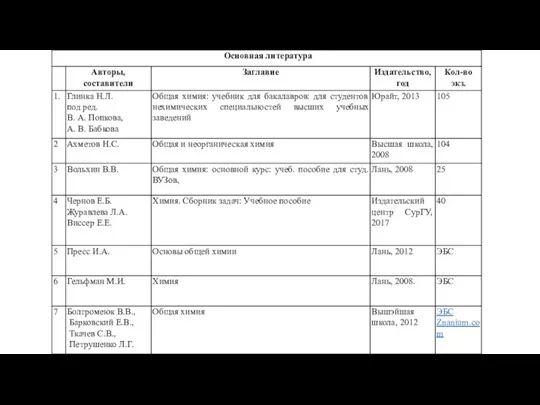
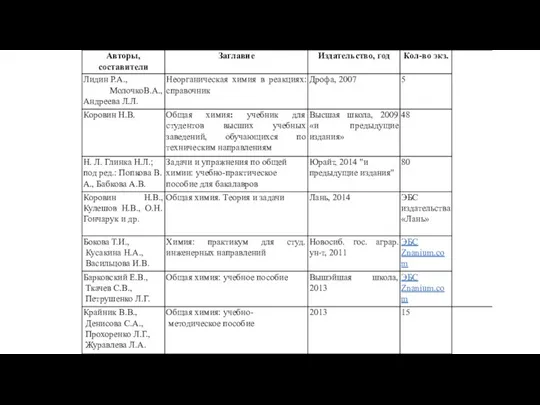
- 8. Фаза – это совокупность частей системы тождественных по составу, химическим и физическим свойствам и отделенных от
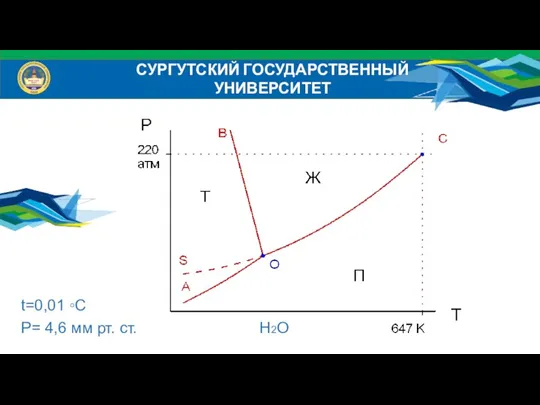
- 9. t=0,01 ◦C Р= 4,6 мм рт. ст. H2O СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 10. ГАЗЫ Газы могут существовать индивидуально и как смеси, которые смешиваются в неограниченных пропорциях. Газы характеризуются определенными
- 11. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Типы взаимодействия молекул газа: 1. Взаимодействие полярных молекул: 2. Взаимодействие полярной и неполярной
- 12. Идеальные газы – это газы, в которых нет взаимодействия между хаотически движущимися молекулами. Идеальные газы используют
- 13. Норма́льные усло́вия (н.у.) —это стандартные физические условия, с которыми обычно соотносят свойства веществ (при нормальных условиях,
- 14. 1. Закон объемных отношений: при постоянной температуре и давлении объемы вступающих в реакцию газов относятся друг
- 15. 2. Закон Бойля–Мариотта (1692 г.): для данной массы газа при постоянной температуре (изотермический процесс, ) объем
- 16. В 1792 г. Жак Шарль и Жозеф Луи Гей-Люссак установили зависимость, в соответствии с которой объем
- 17. 3. Закон Шарля (1787 г.): Для данной массы газа при постоянном объеме (V = const) давление
- 18. Для 1 моль газа уравнение (4) преобразуется в выражение: (5) для n молей: (6) Данное выражение
- 19. 5. Закон Авогадро (1811 г.): в равных объемах различных газов при одинаковых условиях (давлении и температуре)
- 20. 6. Закон парциальных давлений Д. Дальтона: общее давление системы равно сумме парциальных давлений компонентов: (8) где
- 21. 7. Закон Рауля: относительное понижение давления насыщенного пара над раствором пропорционально мольной доле вещества: (10) где
- 22. Идеальный газ с точки зрения молекулярно-кинетической теории – это простейшая модель реального газа. В молекулярно-кинетической теории
- 23. Допущения молекулярно-кинетической теории газов: Молекулы газа – это материальные точки с определенной массой, размеры которых малы
- 24. Среднеквадратичную скорость движения молекул определяют как: Среднюю кинетическую энергию можно рассчитать: Тогда Решая это уравнение совместно
- 25. Следовательно где n – количество вещества: Получаем, где константа Больцмана СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 27. Скачать презентацию





















 Классификация минералов по химическому принципу. Занятие 9
Классификация минералов по химическому принципу. Занятие 9 Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру
Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева Химия и продукты питания
Химия и продукты питания Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Золото
Золото Этанол. Одноатомный спирт
Этанол. Одноатомный спирт Важнейшие нефтепродукты. Области их применения
Важнейшие нефтепродукты. Области их применения 29 Кинетика идеальных проточных ректоров (2)
29 Кинетика идеальных проточных ректоров (2) Полиамиды. Классификация по методу получения
Полиамиды. Классификация по методу получения Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли
Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли Занимательные опыты
Занимательные опыты Роль металлов в нашей жизни
Роль металлов в нашей жизни Керамические материалы
Керамические материалы Нитрофенилалкиламины
Нитрофенилалкиламины Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Сильные и слабые электролиты. Кислотность среды. 9 класс
Сильные и слабые электролиты. Кислотность среды. 9 класс Растворы. Часть 2
Растворы. Часть 2 Методы осаждения. Аналитическая химия
Методы осаждения. Аналитическая химия Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Центрифугирование
Центрифугирование Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів
Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів Применение методов кислотно-основного титрования в неводных средах в современном фармакопейном анализе
Применение методов кислотно-основного титрования в неводных средах в современном фармакопейном анализе Общая характеристика элементов главной подгруппы второй группы
Общая характеристика элементов главной подгруппы второй группы fosfor_i_ego_soedineniya
fosfor_i_ego_soedineniya Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Извлечение из растворов экстракцией органическими растворителями
Извлечение из растворов экстракцией органическими растворителями