Содержание
- 2. Положение в таблице Менделеева Углерод Carbogenium - 6ой элемент в таблице Менделеева. Он располагается в главной
- 3. Нахождение в природе В настоящее время известно более миллиона соединений углерода с другими элементами. Их изучение
- 4. Нахождение в природе Углерод занимает 17-е место по распространенности в земной коре – 0,048%. Но несмотря
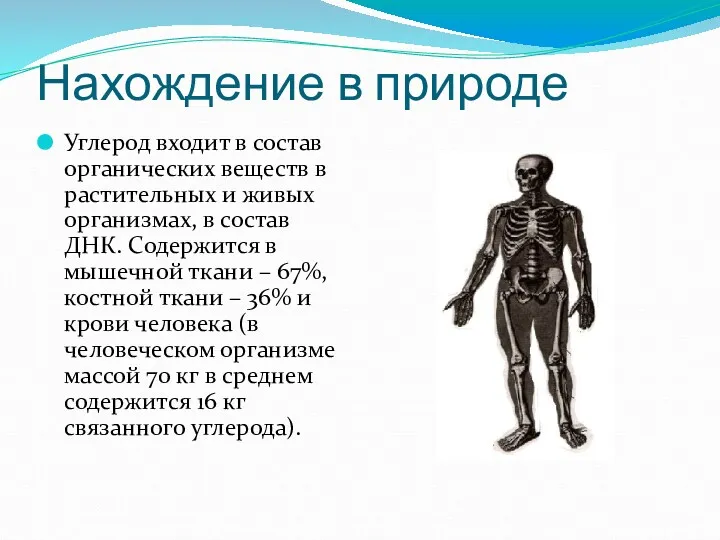
- 5. Нахождение в природе Углерод входит в состав органических веществ в растительных и живых организмах, в состав
- 6. Свободный углерод В свободном виде углерод встречается в нескольких аллотропных модификациях – алмаз, графит, карбин, крайне
- 7. Алмаз
- 8. Графит
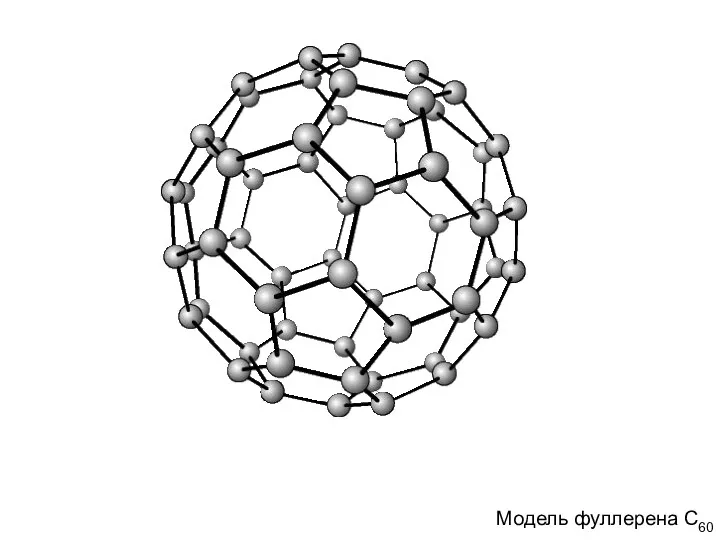
- 9. Модель фуллерена С60 Модель фуллерена С60
- 10. Все это - чистый углерод
- 11. Алмаз Алмаз – бесцветное, прозрачное, сильно преломляющее свет вещество. Алмаз тверже всех найденных в природе веществ,
- 12. Алмаз Плотность алмаза – 3,5 г/см3, tплав=3730С, tкип=4830оС. Алмаз можно получить из графита при p >
- 13. Алмаз Непрерывная трехмерная сетка ковалентных связей, которая характеризуется большой прочностью, определяет многие свойства алмаза, так то
- 14. Графит Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет серо-черный цвет и металлический блеск,
- 15. Графит Атомы углерода в графите расположены отдельными слоями, образованными из плоских шестиугольников. Каждый атом углерода на
- 16. Графит Графит характеризуется меньшей плотностью и твердостью, а также графит может расщепляться на тонкие чешуйки. Чешуйки
- 17. Карбин Карбин был получен в начале 60-х годов В.В. Коршаком, А.М. Сладковым, В.И. Касаточкиным, Ю.П. Кудрявцевым.
- 18. Карбин Он имеет вид черного мелкокристаллического порошка, однако может существовать в виде белого вещества с промежуточной
- 19. Карбин За счет существования различных типов связи и разных способов укладки цепей из углеродных атомов в
- 20. Другие формы углерода Известны и другие формы углерода, такие как уголь, кокс и сажа. Но все
- 21. Фуллерены Фуллерены – класс химических соединений, молекулы которых состоят только из углерода, число атомов которого четно,
- 22. Фуллерены Происхождение термина "фуллерен" связано с именем американского архитектора Ричарда Букминстера Фуллера, конструировавшего полусферические архитектурные конструкции,
- 23. Фуллерены В противоположность первым двум, графиту и алмазу, структура которых представляет собой периодическую решетку атомов, третья
- 24. Нанотрубки Наряду со сфероидальными углеродными структурами, могут образовываться также и протяженные цилиндрические структуры, так называемые нанотрубки,
- 25. Нанотрубки На рисунке представлена идеализированная модель однослойной нанотрубки. Такая трубка заканчивается полусферическими вершинами, содержащими наряду с
- 26. Наночастицы В процессе образования фуллеренов из графита образуются также наночастицы. Это замкнутые структуры, подобные фуллеренам, но
- 27. Графен Графе́н— двумерная аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом, находящихся в
- 28. Графен Основной из существующих в настоящее время способов получения графена в условиях научных лабораторий основан на
- 30. Скачать презентацию

























 Основные положения теории растворов электролитов, используемых в аналитической химии
Основные положения теории растворов электролитов, используемых в аналитической химии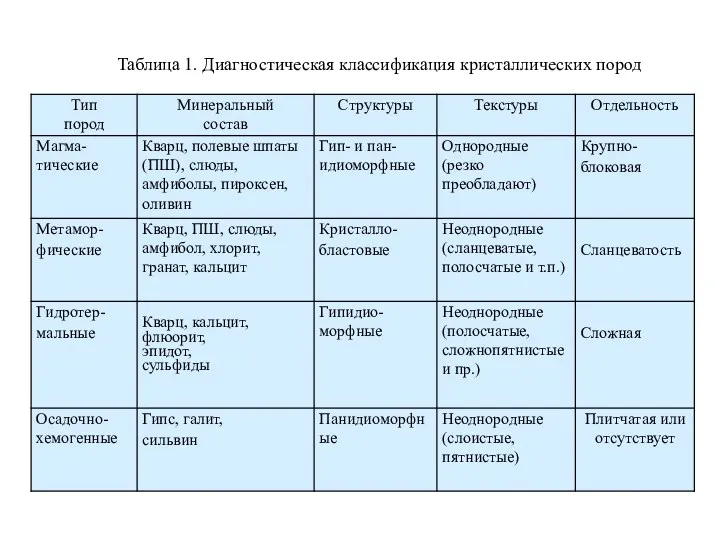 Диагностика метаморфических и гидротермальных горных пород
Диагностика метаморфических и гидротермальных горных пород Чистые вещества и смеси
Чистые вещества и смеси Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения
Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения Серная кислота H2SO4. 9 классы
Серная кислота H2SO4. 9 классы Электронные конфигурации атомов. Периодический Закон. Периодическая система Д.И. Менделеева. Химическая связь
Электронные конфигурации атомов. Периодический Закон. Периодическая система Д.И. Менделеева. Химическая связь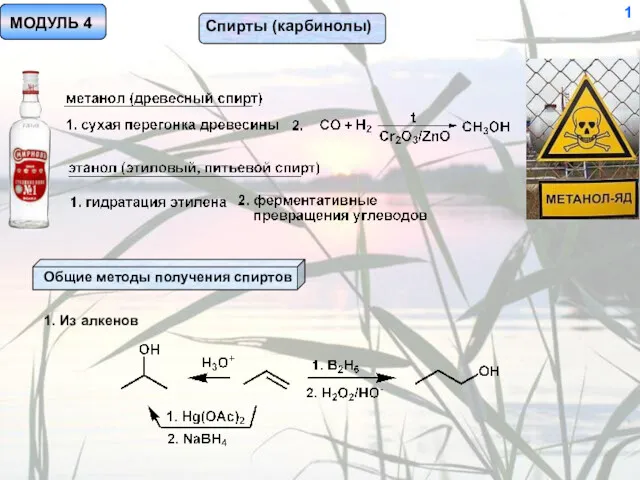 Спирты (карбинолы)
Спирты (карбинолы) Лекция 2 Периодический закон
Лекция 2 Периодический закон Комплексные соединения
Комплексные соединения Драгоценные камни
Драгоценные камни Кремний и его соединения. К уроку химии в 9 классе
Кремний и его соединения. К уроку химии в 9 классе Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода
Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода Ферменты в биотехнологии
Ферменты в биотехнологии Complex compounds
Complex compounds Основы электрохимии. Электрохимические процессы
Основы электрохимии. Электрохимические процессы Первоначальные сведения о строении вещества
Первоначальные сведения о строении вещества Химические тест-методы анализа экологических проб. Лекция 6
Химические тест-методы анализа экологических проб. Лекция 6 Моделирование структуры биомакромолекул
Моделирование структуры биомакромолекул Новинки СН старт: июль 2016 Профессиональная химия PRO service
Новинки СН старт: июль 2016 Профессиональная химия PRO service Титанның химиялық элементі
Титанның химиялық элементі Щелочноземельные металлы. Химические свойства
Щелочноземельные металлы. Химические свойства Альдегиды и кетоны
Альдегиды и кетоны Углепластики
Углепластики Введение в ЭТМ и основы строения и свойств материалов. (1)
Введение в ЭТМ и основы строения и свойств материалов. (1) Органічні розчинники. Їх застосування
Органічні розчинники. Їх застосування Азот и фосфор
Азот и фосфор Внесение минеральных удобрений
Внесение минеральных удобрений Капиллярная конденсация
Капиллярная конденсация