Содержание
- 2. ОСНОВЫ ЭЛЕКТРОХИМИИ Электрохимические процессы
- 3. Электрохимия - это наука, которая изучает процессы, либо протекающие с возникновением электрического тока, либо вызванные электрическим
- 4. Электрохимические процессы – это частный случай окислительно-восстановительных р-ций. ОВР можно осуществлять двумя способами: при прямом контакте
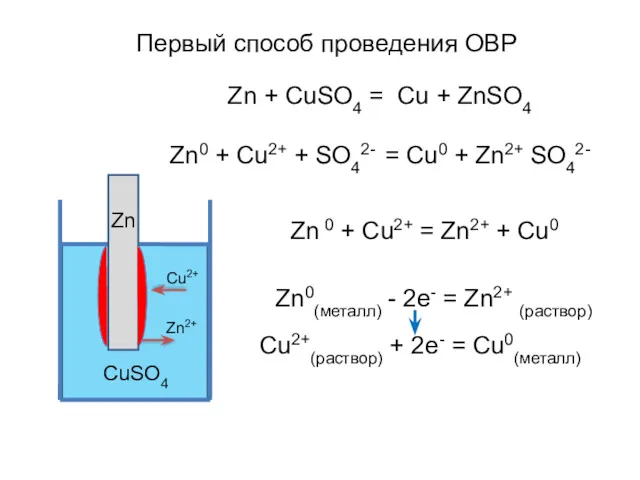
- 5. Zn + CuSO4 = Cu + ZnSO4 Zn0 + Cu2+ + SO42- = Cu0 + Zn2+
- 6. Гальванический элемент Якоби- Даниэля Zn Cu Zn + CuSO4 = ZnSO4 + Cu электродные процессы: Краткая
- 7. Устройства, в к-рых энергия химической р-ции непосредственного преобразуется в электри-ческую энергию, называются химическими источниками электрической энергии
- 8. Электродвижущая сила (ЭДС) ∆G при р = const и Т = const ∆G = ∆H –
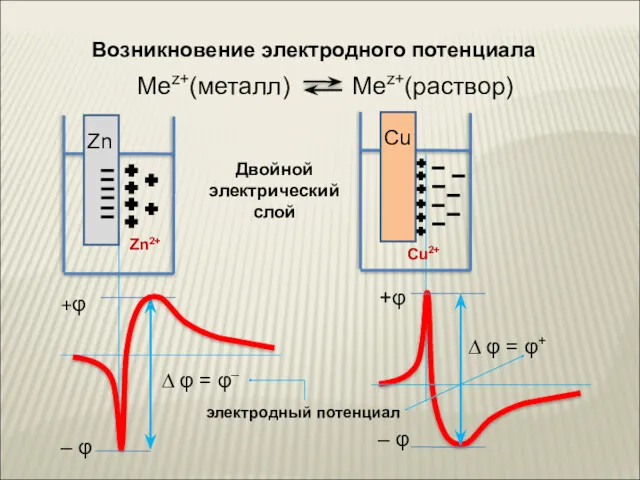
- 9. Возникновение электродного потенциала
- 10. При изучении потенциалов различных электродных процессов установлено, что их величины зависят от трех факторов: от природы
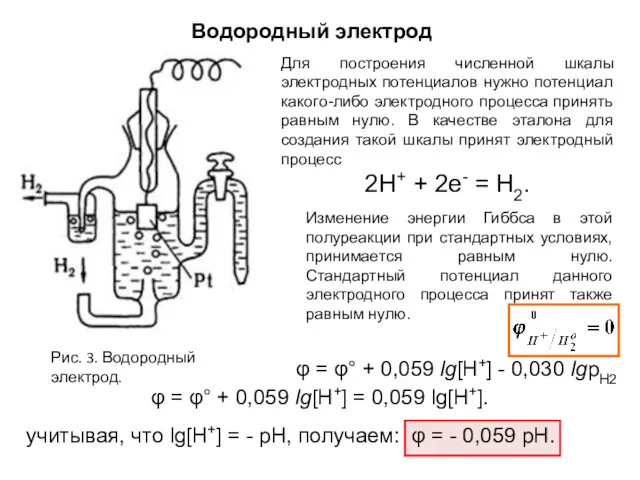
- 11. Водородный электрод Рис. 3. Водородный электрод. Для построения численной шкалы электродных потенциалов нужно потенциал какого-либо электродного
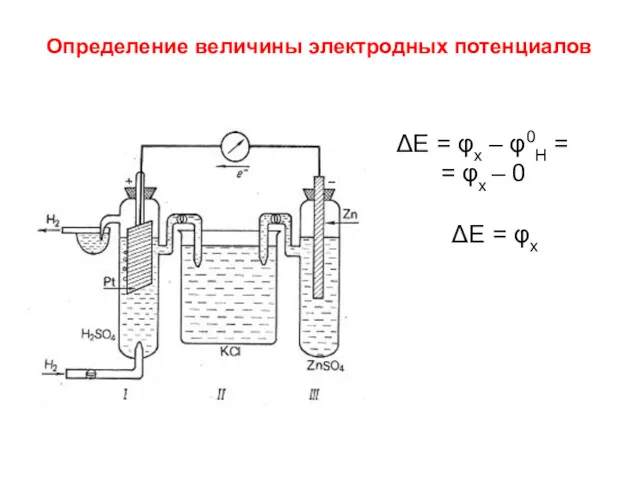
- 12. ΔE = φx – φ0H = = φx – 0 ΔE = φx Определение величины электродных
- 13. Концентрационные элементы Pt, H2 | H2SO4 || H2SO4 | H2, Pt C1 C2 φ2 = -
- 14. Задача 1. Определить знаки электродов в гальван. эл-те Co|CoCI2||AICI3|AI, указать анод и катод, объяснить механизм возникновения
- 15. С.Б. Бурухин, О.А. Ананьева «Введение в электрохимию»
- 16. Физические типы кристаллических решеток В зависимости от природы частиц, находящихся в узлах кристаллической решетки, и от
- 17. Типы кристаллов Ионные кристаллы В узлах кристаллической решетки располагаются ионы разных знаков. Силы взаимодействия между ними
- 18. Типы кристаллов Атомные кристаллы В узлах кристаллической решетки размещаются нейтральные атомы. Связь, объединяющая в кристалле (а
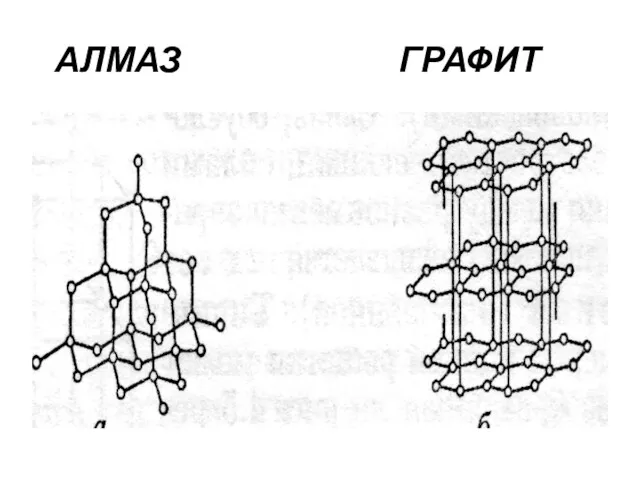
- 19. Типы кристаллов Характерные примеры атомных кристаллов – алмаз и графит. Абсолютно идентичные по химической природе (элемент
- 20. АЛМАЗ ГРАФИТ
- 21. Типы кристаллов Металлические кристаллы Во всех узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно,
- 22. Типы кристаллов Молекулярные кристаллы В узлах кристаллической решетки помещаются определенным образом ориентированные молекулы. Силы связи между
- 24. Скачать презентацию
















 Превращение веществ. Роль химии в жизни человека
Превращение веществ. Роль химии в жизни человека Природные каменные материалы. (Лекция 3)
Природные каменные материалы. (Лекция 3) Химия өнеркәсібі
Химия өнеркәсібі Алкандар. (қаныққан көмірсутектер. Парафиндер.)
Алкандар. (қаныққан көмірсутектер. Парафиндер.) Электролитическая диссоциация
Электролитическая диссоциация Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Сутектік көрсеткіш ph. Тұздар гидролизі
Сутектік көрсеткіш ph. Тұздар гидролизі Основания. Формула сильной кислоты
Основания. Формула сильной кислоты Минералы
Минералы Природные источники углеводородов
Природные источники углеводородов Молярный объем газов
Молярный объем газов Визитка химического элемента. Водород
Визитка химического элемента. Водород Аминокислоты. Белки
Аминокислоты. Белки Неметаллы. Особенности строения атомов неметаллов
Неметаллы. Особенности строения атомов неметаллов Многоатомные спирты
Многоатомные спирты Типы химических реакций в органической химии
Типы химических реакций в органической химии Коррозия и методы борьбы с ней
Коррозия и методы борьбы с ней Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Физические, химические свойства предельных и непредельных карбоновых кислот, получение Неметаллические и композиционные материалы
Неметаллические и композиционные материалы Кислород. Распространение кислорода в природе (8 класс)
Кислород. Распространение кислорода в природе (8 класс) Вклад ученых-химиков в победу в Великой Отечественной войне
Вклад ученых-химиков в победу в Великой Отечественной войне Нанотехнологии и Наноматериалы
Нанотехнологии и Наноматериалы Коррозия металлов и способы защиты от неё. (11 класс)
Коррозия металлов и способы защиты от неё. (11 класс) Химический процесс. Практические занятия
Химический процесс. Практические занятия Стехиометрия и классификация твердых веществ
Стехиометрия и классификация твердых веществ Общая характеристика твердого, жидкого и газообразного видов топлива
Общая характеристика твердого, жидкого и газообразного видов топлива Тайна мыльного пузыря
Тайна мыльного пузыря Алюминий и его соединения
Алюминий и его соединения