Содержание
- 2. 1. Развитие представлений о строении атома
- 3. Корпускулярная (атомистическая) концепция Базировалась на идее дискретности (делимости) материи на части до определенного предела – до
- 4. Атом – неделимая частица химического элемента
- 5. Доказательства сложности строения атома (XIX век) Открытие ренгеновских лучей (1895г., К. Ренген) Открытие катодных лучей –
- 6. Модели строения атомов
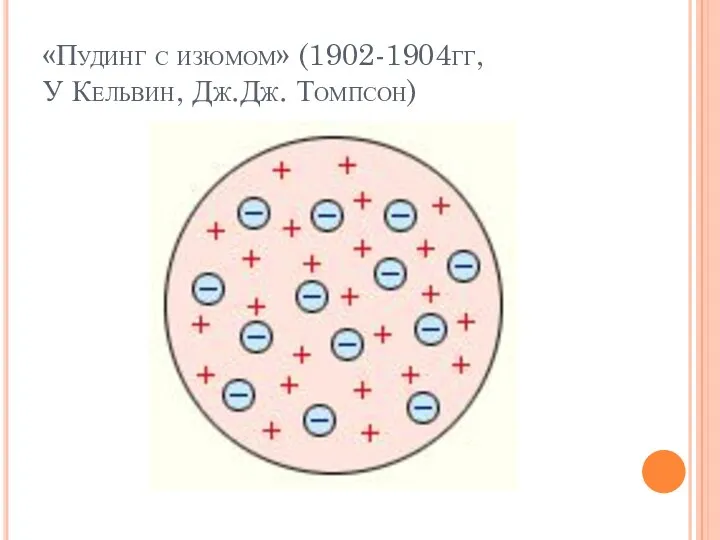
- 7. «Пудинг с изюмом» (1902-1904гг, У Кельвин, Дж.Дж. Томпсон)
- 8. Планетарная модель атома (1907г., Э. Резерфорд)
- 9. Модель атома Н. Бора – квантовая модель (1913г) 1постулат: в атоме существуют стационарные состояния, когда электроны
- 10. Модель атома Н. Бора 2 постулат: при переходе электронов с одной орбиты на другую атом испускает
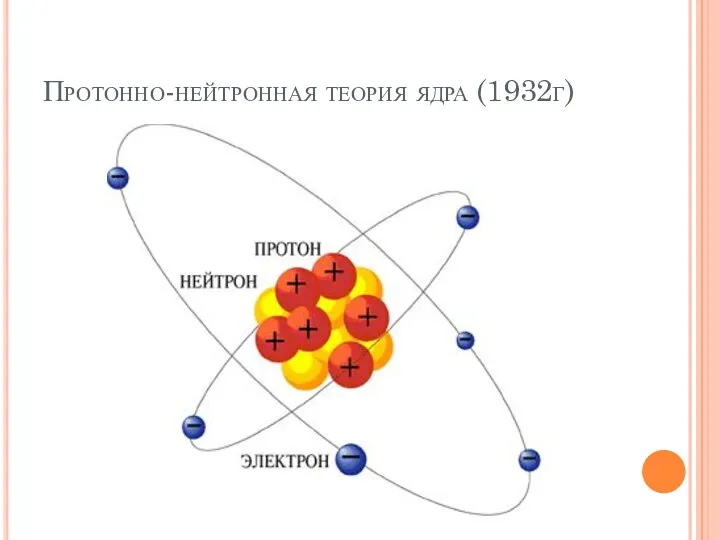
- 11. Протонно-нейтронная теория ядра (1932г)
- 12. Волновая модель строения атома
- 13. В 1927 году Д. Дэвиссон и Л.Джермер впервые обнаружили явление дифракции электронов на кристалле никеля
- 14. Дифракция электронов исчезает, если подействовать внешним источником света (размеры микрочастиц намного меньше длины волны видимого света)
- 15. В. Гейзенберг сформулировал принцип неопределенности: невозможно с одинаковой точностью определить и положение, и импульс микрочастицы
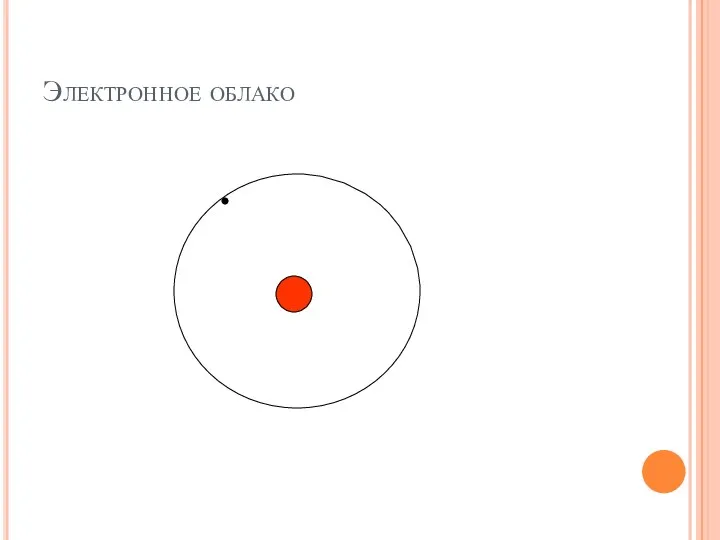
- 16. Электронное облако
- 17. Вероятность нахождения электрона в околоядерном пространстве неодинакова Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение
- 18. 2. Общие принципы построения моделей атомов
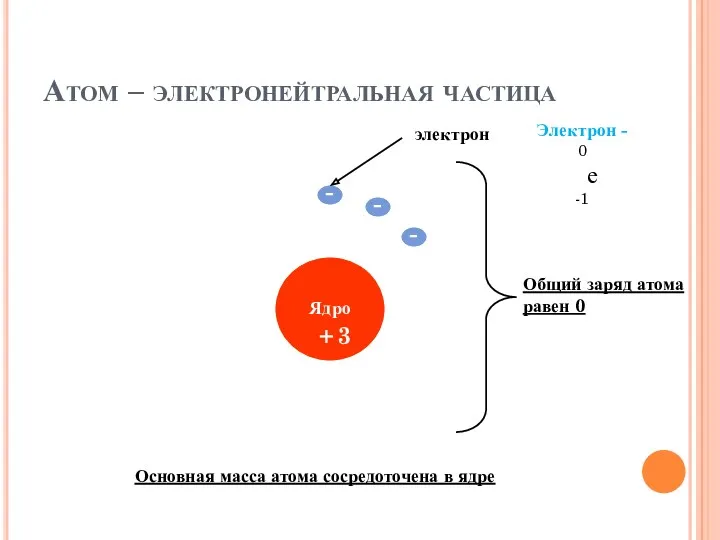
- 19. Атом – электронейтральная частица электрон + Общий заряд атома равен 0 - 3 - - Основная
- 20. - Сравнение размеров ядра и электрона
- 21. Экспериментально определено, что заряд ядра атома (и число электронов) равны порядковому номеру элемента в периодической системе
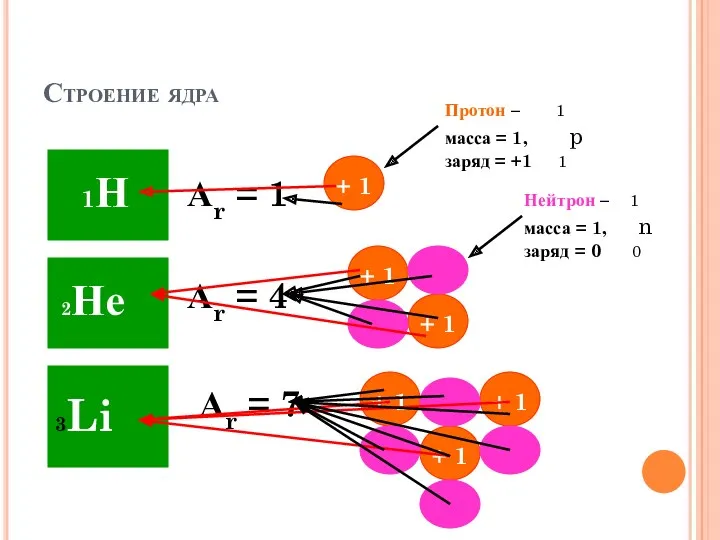
- 22. Строение ядра Аr = 1 Аr = 4 Аr = 7 Протон – 1 масса =
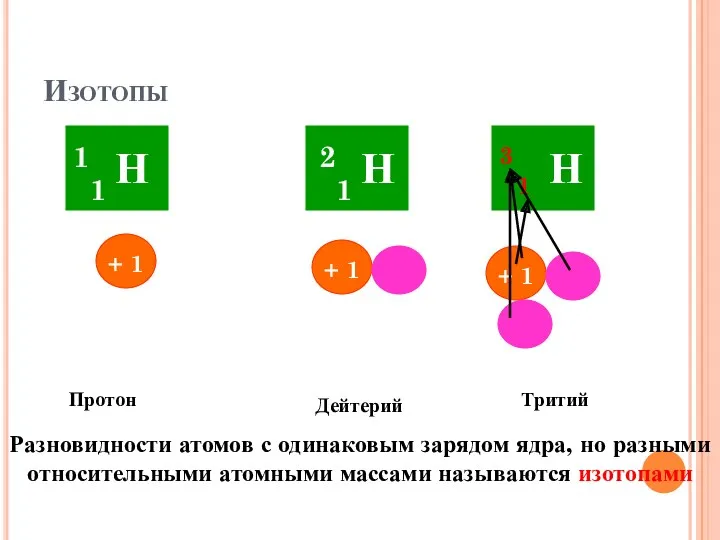
- 23. Изотопы Протон Дейтерий Тритий 1 3 Разновидности атомов с одинаковым зарядом ядра, но разными относительными атомными
- 24. изотопы Химические свойства изотопов большинства химических элементов одинаковы Изотопы водорода сильно различаются по свойствам из-за резкого
- 25. Открытие изотопов позволило объяснить «неправильности» в периодической системе элементов (ПСЭ) 40 39 Аr К 18 19
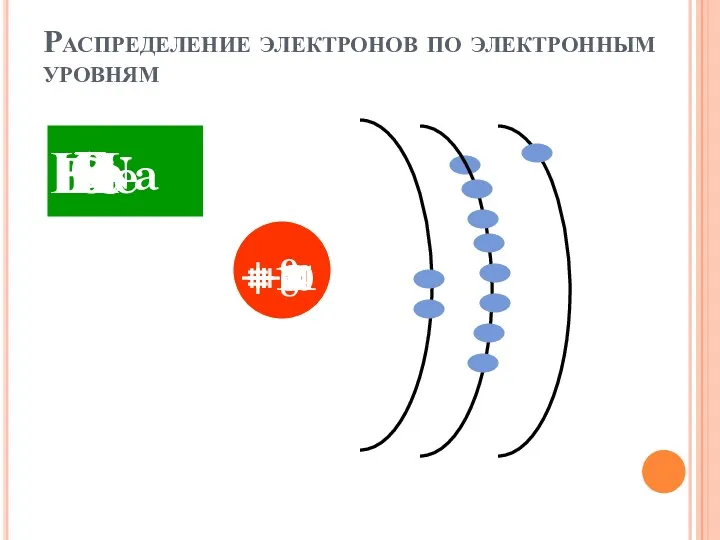
- 26. Распределение электронов по электронным уровням Н + 1 Не + 2 Li + 3 + 4
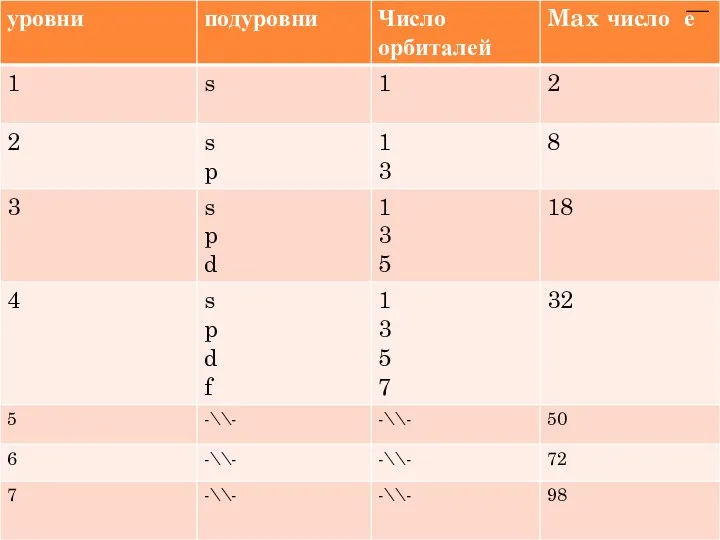
- 27. Электроны, близкие по энергии, находятся на одном энергетическом уровне Число уровней соответствует номеру периода Чем выше
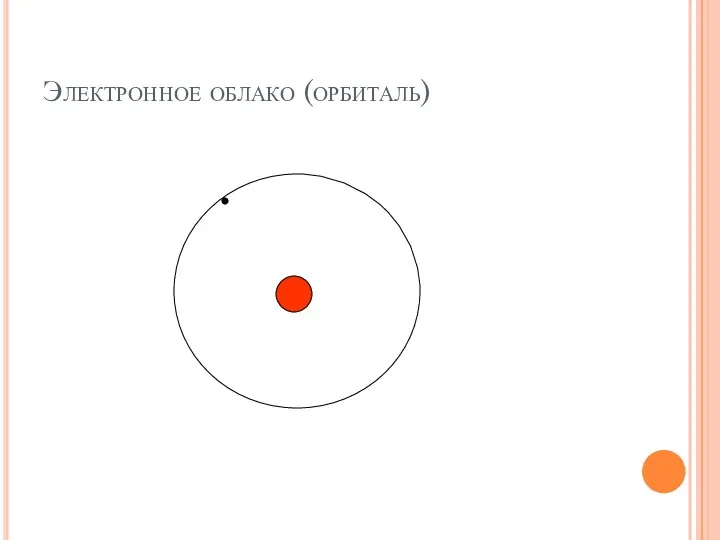
- 28. Электронное облако (орбиталь)
- 29. Орбиталь может быть вакантной (свободной) На орбитале может быть 1 неспаренный электрон Максимальное количество электронов на
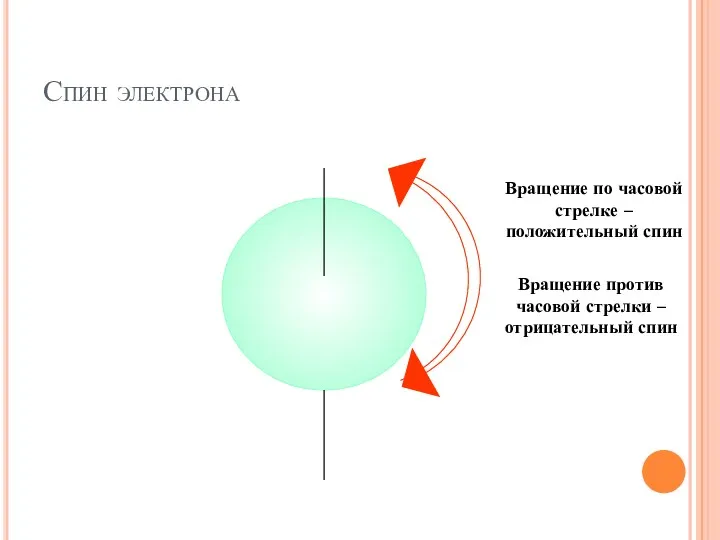
- 30. Спин электрона Вращение по часовой стрелке – положительный спин Вращение против часовой стрелки – отрицательный спин
- 31. Число электронов на уровне можно найти по формуле: N=2n2 , где n – номер уровня
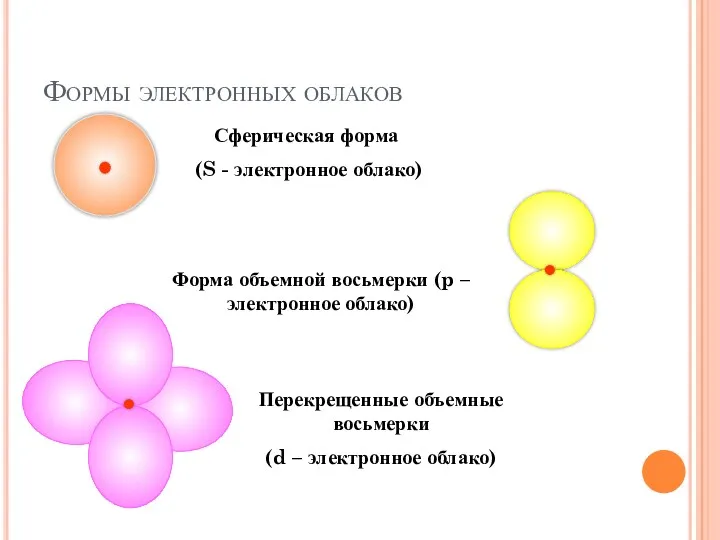
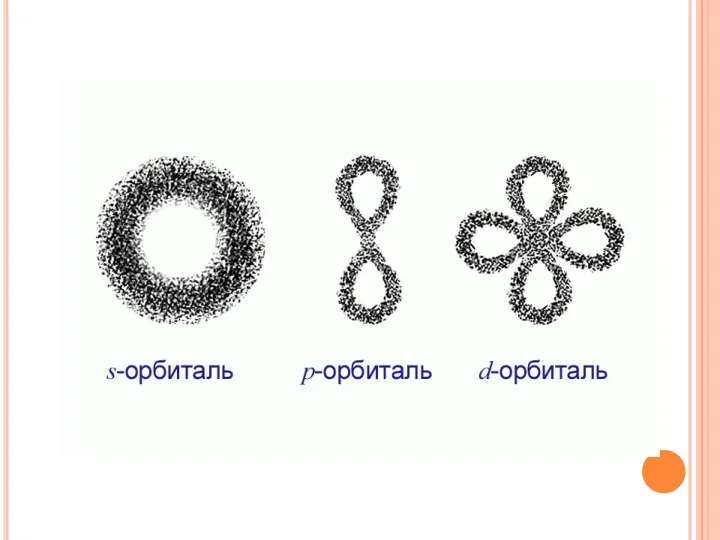
- 32. Формы электронных облаков Сферическая форма (S - электронное облако) Форма объемной восьмерки (p – электронное облако)
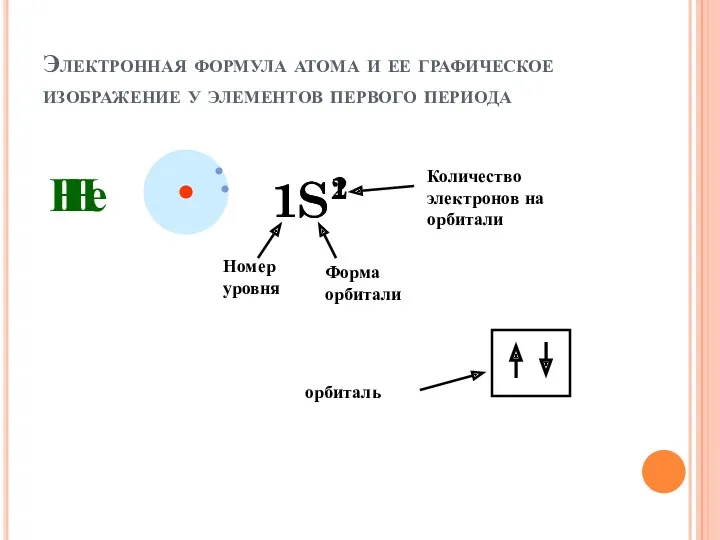
- 34. Электронная формула атома и ее графическое изображение у элементов первого периода Н 1S1 Номер уровня Форма
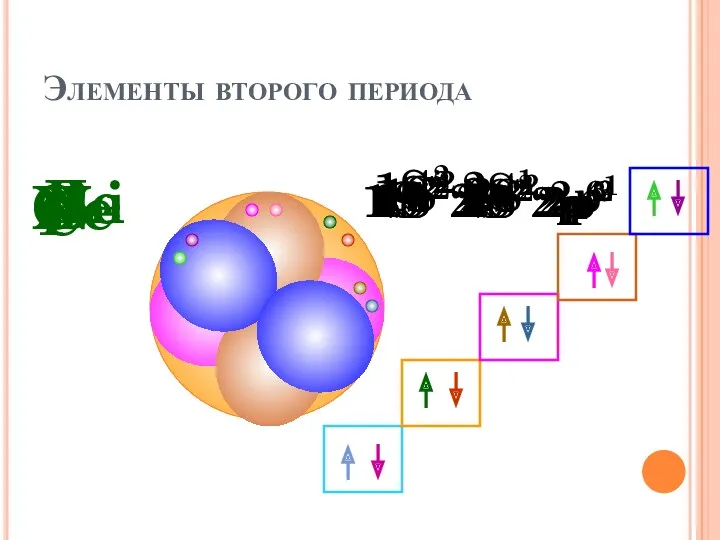
- 35. Элементы второго периода Li 1S2 2S1 Be 1S2 2S2 B 1S2 2S2 2p1 C 1S2 2S2
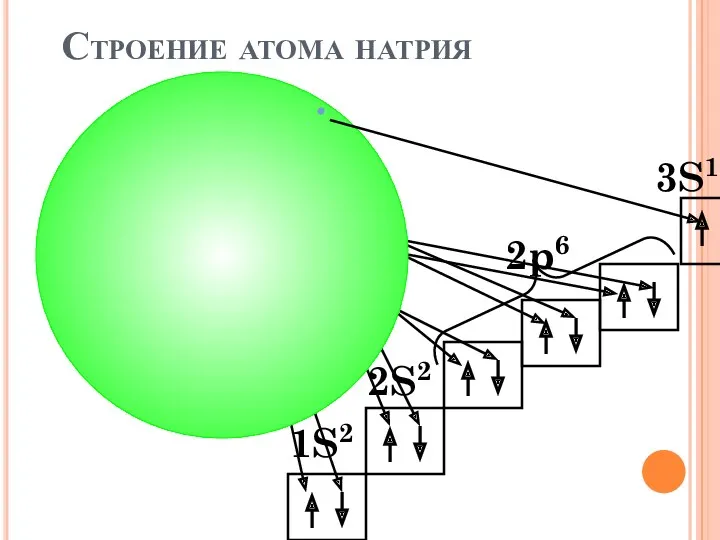
- 36. Na Строение атома натрия 2S2 2p6 3S1 1S2
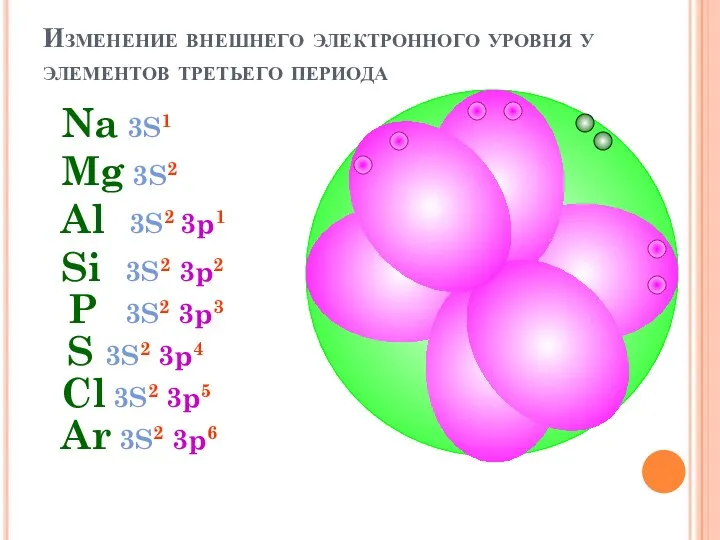
- 37. Изменение внешнего электронного уровня у элементов третьего периода Mg 3S2 Na 3S1 Al 3S2 3p1 Si
- 39. s- элементы – у которых заполняется на внешнем уровне s-орбиталь (1 и 2 группы главных подгрупп,
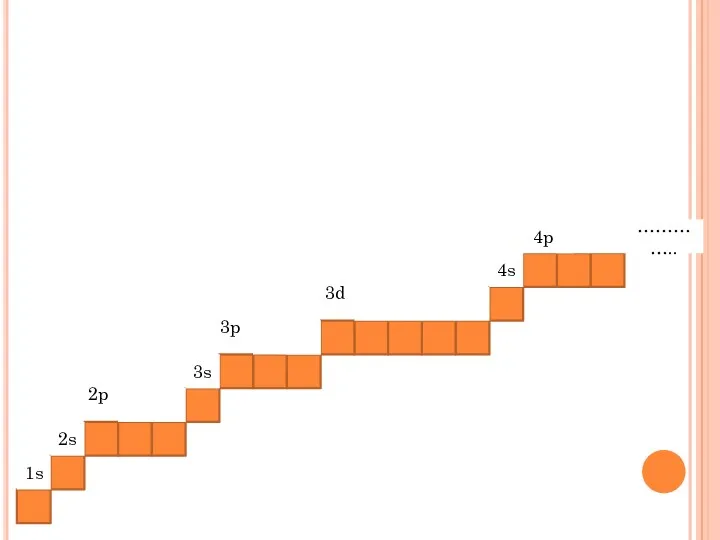
- 40. ………….. 2p 3s 1s 2s 3p 3d 4s 4p
- 41. Количество электронов на внешнем уровне для элементов главных подгрупп совпадает с номером группы
- 43. Скачать презентацию























 Геохимия литосферы
Геохимия литосферы Диффузия вокруг нас
Диффузия вокруг нас Материаловедение. Диаграммы состояния
Материаловедение. Диаграммы состояния Hydrochloric acid HCl
Hydrochloric acid HCl Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Волшебные кристалы
Волшебные кристалы Строение атома
Строение атома Көмірсу. Көмірсулардың қасиеттері. Көмірсудың метаболизмі
Көмірсу. Көмірсулардың қасиеттері. Көмірсудың метаболизмі Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции
Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции Металлы, их положение в ПСХЭ, физические и химические свойства
Металлы, их положение в ПСХЭ, физические и химические свойства Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ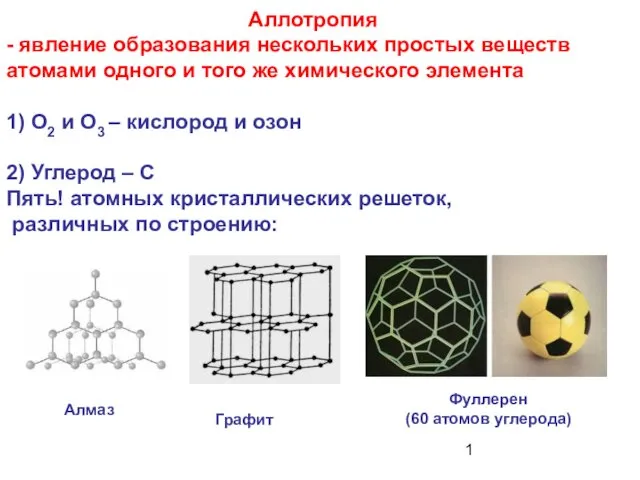 Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента
Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента Дистилляция в химической промышленности
Дистилляция в химической промышленности Растительные индикаторы
Растительные индикаторы Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ
Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ Гетерофункциональные соединения
Гетерофункциональные соединения Фосфор и его соединения
Фосфор и его соединения Альдегиды и кетоны
Альдегиды и кетоны Поверхневі явища в дисперсних системах. Поверхнева енергія
Поверхневі явища в дисперсних системах. Поверхнева енергія Золь-гель технология. Прорыв XXI века
Золь-гель технология. Прорыв XXI века Непредельные углеводороды
Непредельные углеводороды Альтернативная бытовая химия
Альтернативная бытовая химия Простые вещества — металлы и неметаллы
Простые вещества — металлы и неметаллы Металлы и Неметаллы
Металлы и Неметаллы Коллигативные свойства растворов
Коллигативные свойства растворов Лабораторная №5. Карбоновые кислоты
Лабораторная №5. Карбоновые кислоты Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья
Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии
Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии