Содержание
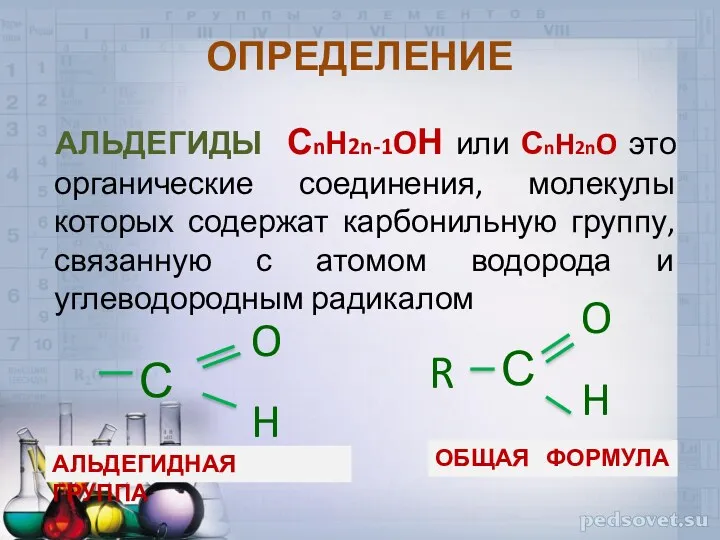
- 2. ОПРЕДЕЛЕНИЕ АЛЬДЕГИДЫ СnH2n-1OН или СnH2nO это органические соединения, молекулы которых содержат карбонильную группу, связанную с атомом
- 3. ОПРЕДЕЛЕНИЕ КЕТОНЫ – органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами С
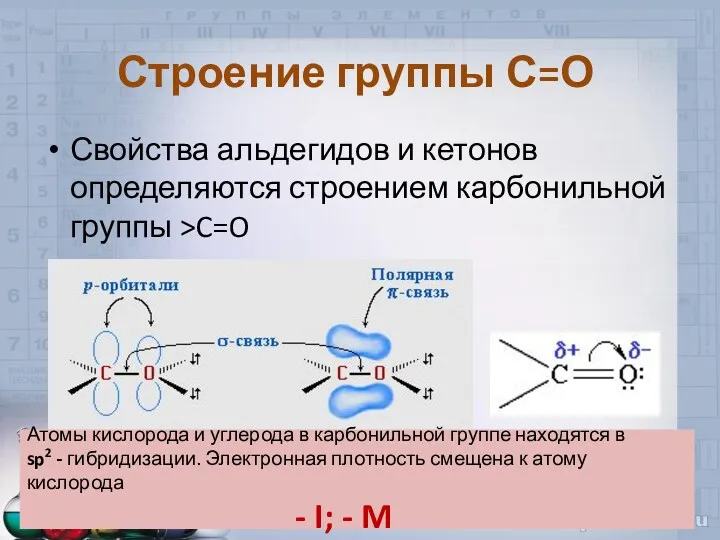
- 4. Строение группы С=О Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O Атомы кислорода и углерода
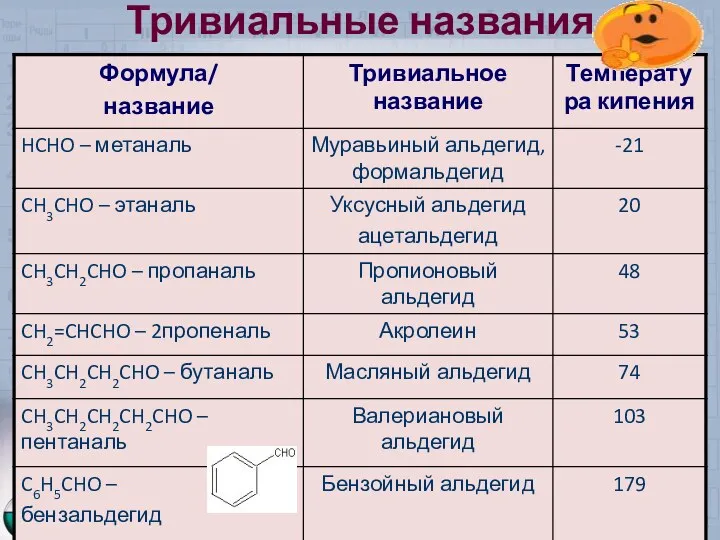
- 5. Тривиальные названия
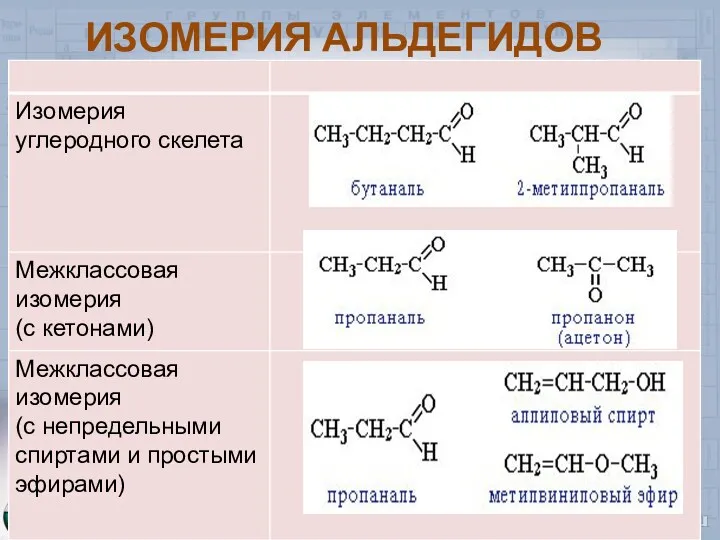
- 6. ИЗОМЕРИЯ АЛЬДЕГИДОВ
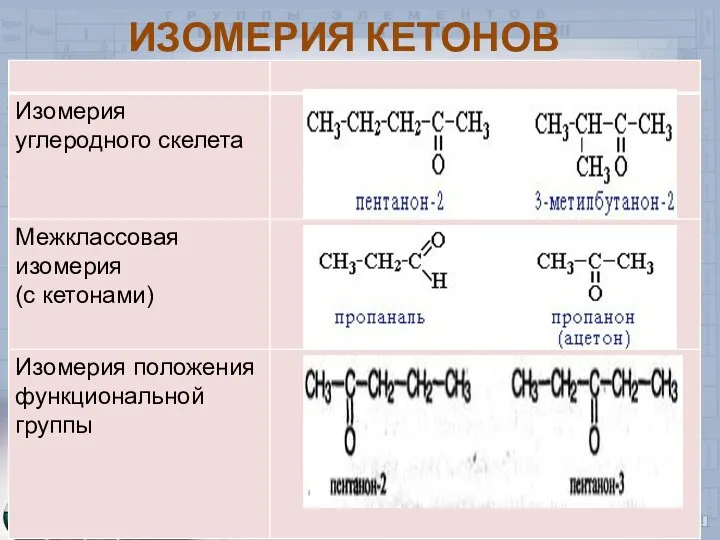
- 7. ИЗОМЕРИЯ КЕТОНОВ
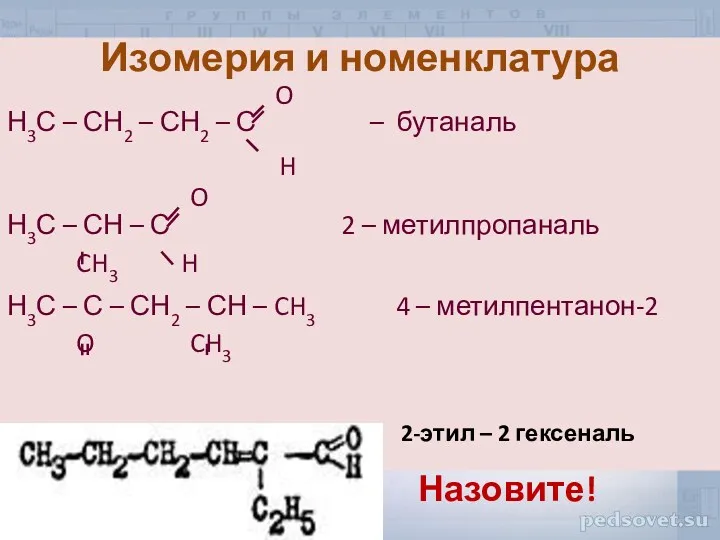
- 8. Изомерия и номенклатура O Н3С – СН2 – СН2 – С – бутаналь H O Н3С
- 9. С1 – газ с резким запахом С2 – С3 – жидкости с резким запахом С4 –
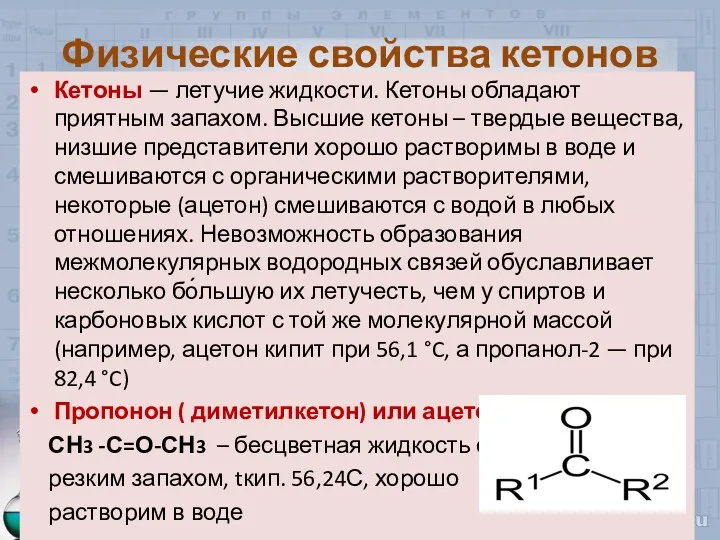
- 10. Физические свойства кетонов Кетоны — летучие жидкости. Кетоны обладают приятным запахом. Высшие кетоны – твердые вещества,
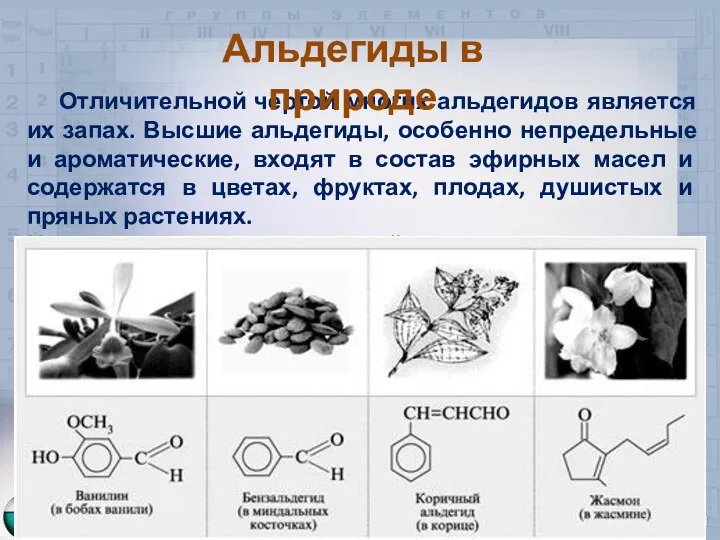
- 11. Отличительной чертой многих альдегидов является их запах. Высшие альдегиды, особенно непредельные и ароматические, входят в состав
- 12. Булочки ванильные, корицы аромат, Амаретто, шоколад Альдегидов вкус таят. В землянике и кокосе, И в жасмине,
- 13. В плодах ванили содержится ароматический альдегид, который придает им характерный запах. Ванилин применяется в парфюмерии, кондитерской
- 14. Запах цитрусовых обусловлен данным диеновым альдегидом. Его применяют в качестве отдушки средств бытовой химии, косметических и
- 15. Коричный альдегид Коричный альдегид содержится в масле корицы, его получают перегонкой коры дерева корицы . Применяется
- 16. Бензальдегид Бензальдегид – жидкость с запахом горького миндаля. Встречается в косточках и семечках (абрикос, персик) Альдегиды
- 17. Фенилэтаналь Фенилэтаналь по сравнению с бензальдегидом лучше соответствует рецептору цветочного запаха. Фенилэтаналь пахнет гиацинтом. Альдегиды в
- 18. n-Гидроксифенилбутанон-2 Этот кетон обуславливает в основном запах спелых ягод малины. Его включают в состав синтетических душистых
- 19. ХИМИЧЕСКИЕ СВОЙСТВА РЕАКЦИЯ ВОССТАНОВЛЕНИЯ О t,Pt СН3 С + Н2 → СН3 СН2 ОН этаналь Н
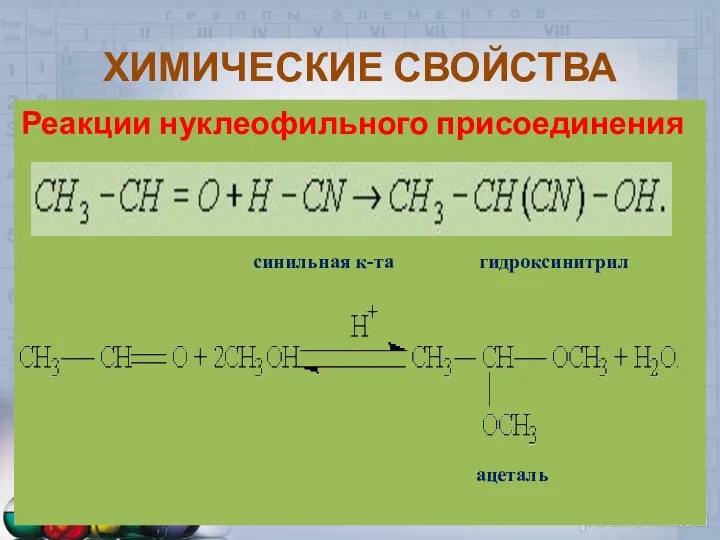
- 20. ХИМИЧЕСКИЕ СВОЙСТВА Реакции нуклеофильного присоединения синильная к-та гидроксинитрил ацеталь
- 21. ХИМИЧЕСКИЕ СВОЙСТВА Присоединение гидросульфитов Гидросульфитные производные альдегидов и кетонов при нагревании с кислотами разлагаются с образованием
- 22. Альдегиды довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: КМnO4, K2Cr2O7, [Ag(NH3)2OH], Cu(OH)2. Все
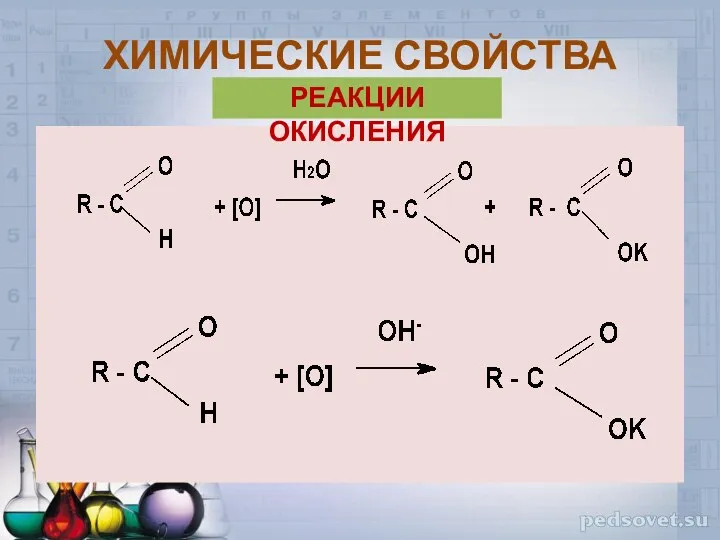
- 23. ХИМИЧЕСКИЕ СВОЙСТВА РЕАКЦИИ ОКИСЛЕНИЯ
- 24. Допишите ОВР CH3COH + KMnO4 → CH3COH + K2Cr2O7 + H2SO4 → CH3COH + KMnO4 +
- 25. Муравьиный альдегид окисляется до CO2 или карбонатов: НСОН + К2Сr2O7 + H2SO4→CO2 + Cr2(SO4)3 + K2SO4
- 26. Допишите ОВР HCOH + KMnO4(изб) + H2SO4 → HCOH + [Ag(NH3)2OH] → HCOH + Cu(OH)2 →
- 27. Кетоны окисляются в более жёстких условиях с разрывом связи С-С около карбонильной группы и образованием смеси
- 28. ХИМИЧЕСКИЕ СВОЙСТВА РЕАКЦИИ ОКИСЛЕНИЯ Реакция серебряного зеркала- качественная реакция О О СН3 С + 2[Ag(NH3)2]OH →
- 29. Реакция с гидроксидом меди качественная реакция О О СН3 С + 2Cu(OH)2 → СН3 С +
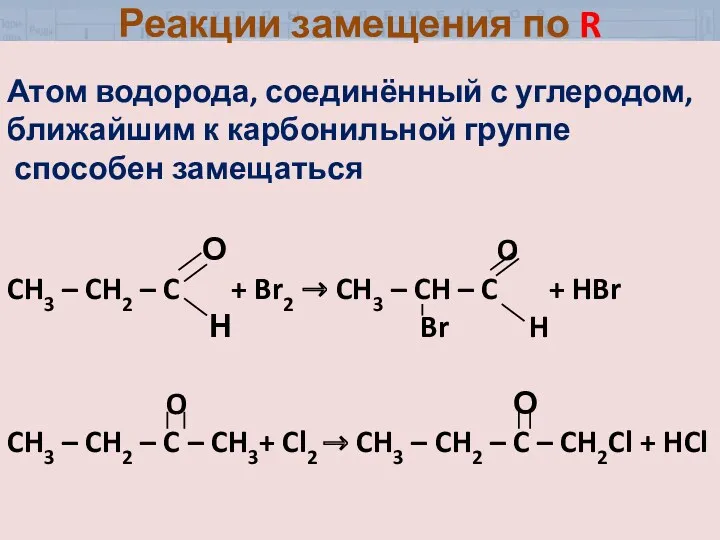
- 30. Атом водорода, соединённый с углеродом, ближайшим к карбонильной группе способен замещаться О O CH3 – CH2
- 31. Реакции замещения по R На свету атом брома может замещать любой из атомов водорода
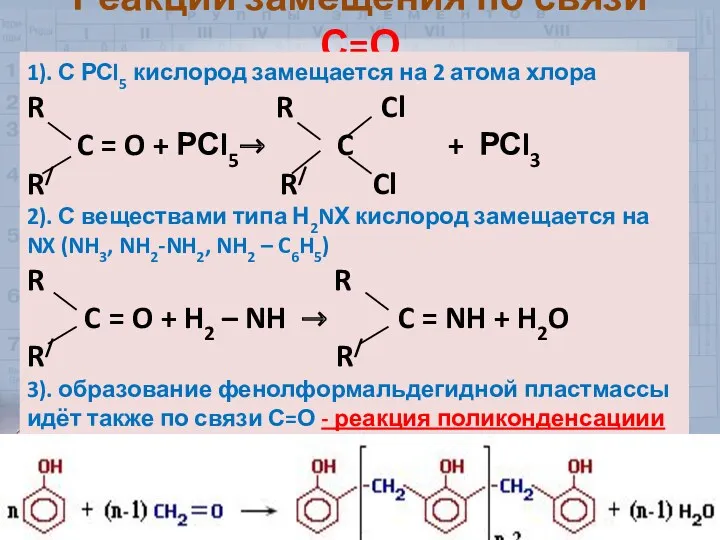
- 32. Реакции замещения по связи С=О 1). С РСl5 кислород замещается на 2 атома хлора R R
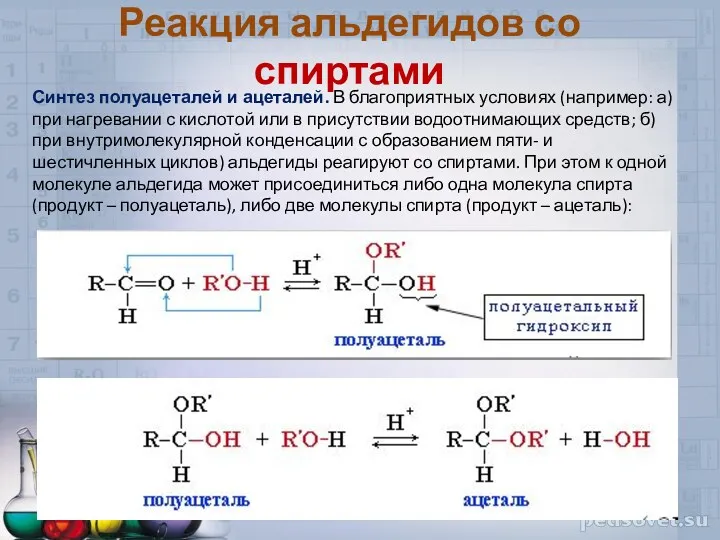
- 33. Реакция альдегидов со спиртами Синтез полуацеталей и ацеталей. В благоприятных условиях (например: а) при нагревании с
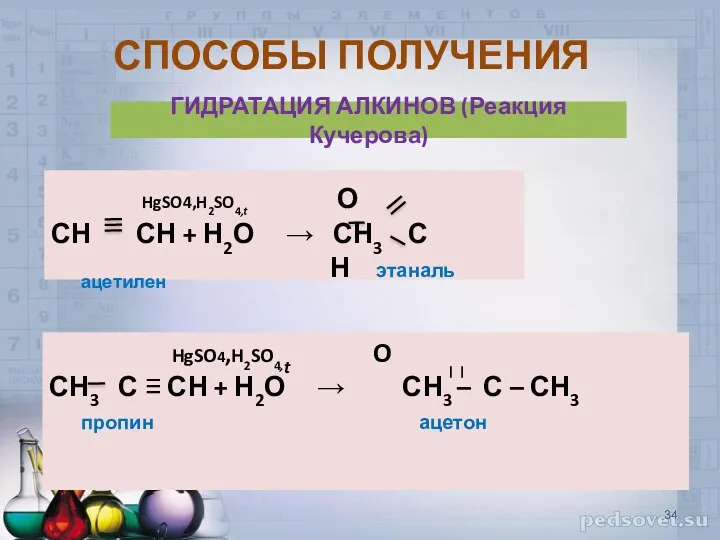
- 34. СПОСОБЫ ПОЛУЧЕНИЯ ГИДРАТАЦИЯ АЛКИНОВ (Реакция Кучерова) HgSO4,H2SO4,t О СН СН + Н2О → СН3 С ацетилен
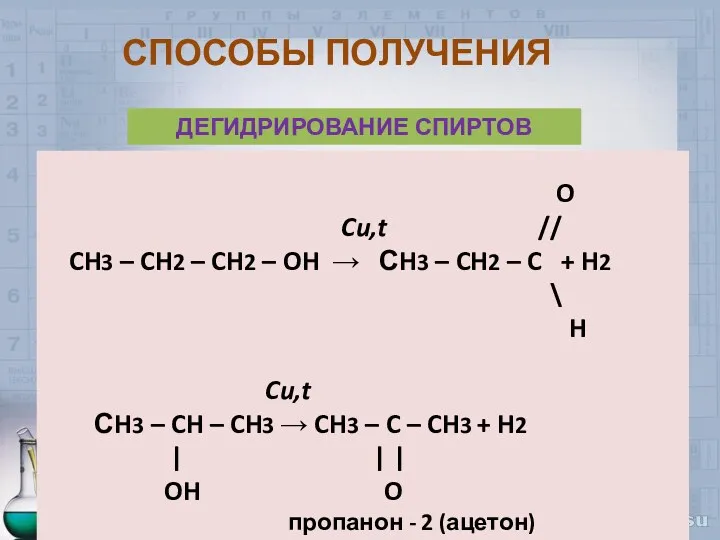
- 35. СПОСОБЫ ПОЛУЧЕНИЯ ДЕГИДРИРОВАНИЕ СПИРТОВ O Cu,t // CH3 – CH2 – CH2 – OH → СH3
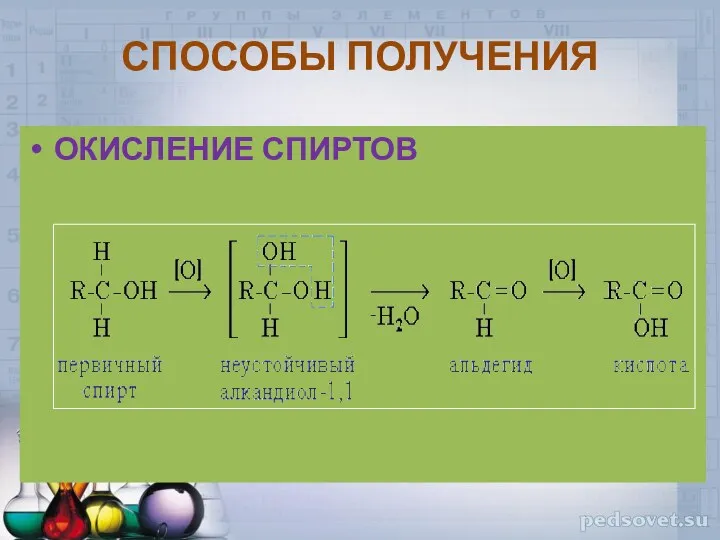
- 36. СПОСОБЫ ПОЛУЧЕНИЯ ОКИСЛЕНИЕ СПИРТОВ
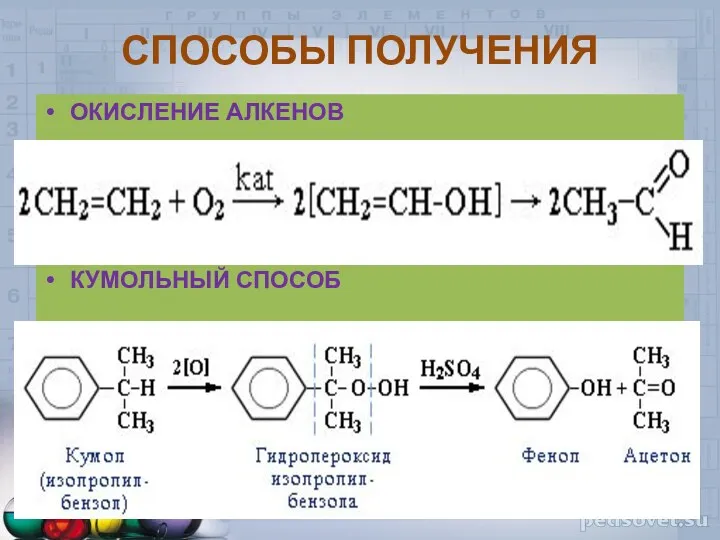
- 37. СПОСОБЫ ПОЛУЧЕНИЯ ОКИСЛЕНИЕ АЛКЕНОВ КУМОЛЬНЫЙ СПОСОБ
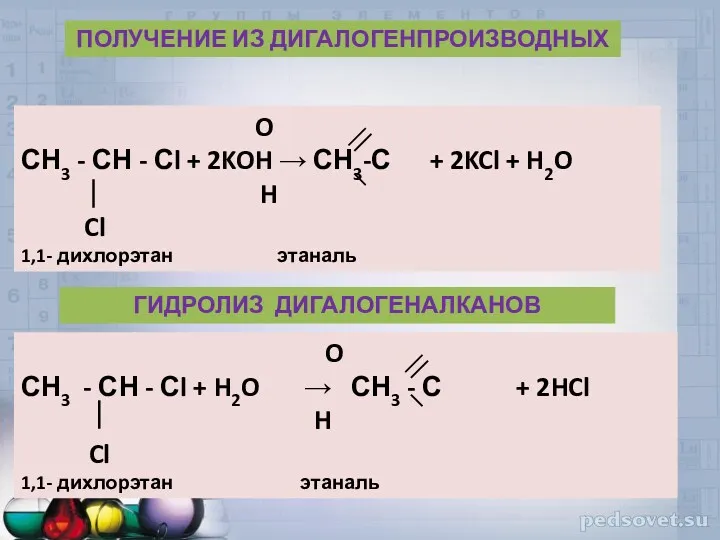
- 38. O СН3 - СН - Сl + 2KOH → СН3-С + 2KCl + H2O H Cl
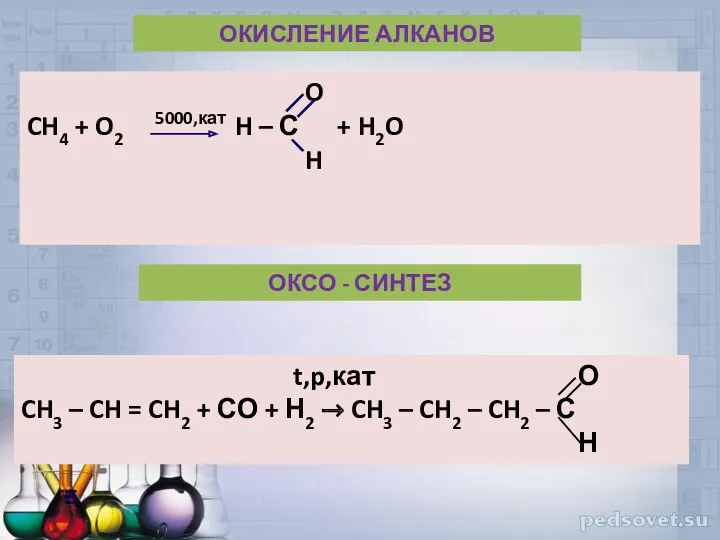
- 39. O CH4 + O2 5000,кат H – С + H2O H ОКИСЛЕНИЕ АЛКАНОВ ОКСО - СИНТЕЗ
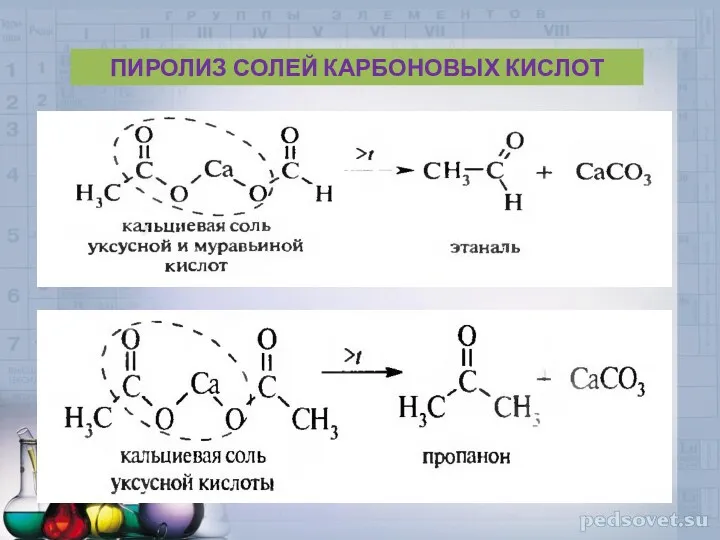
- 40. ПИРОЛИЗ СОЛЕЙ КАРБОНОВЫХ КИСЛОТ
- 41. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ ПАРФЮМЕРИЯ Альдегид анисовый, обепин – жидкость с приятным запахом мимозы Альдегид дециловый, деканаль –
- 42. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ ПОЛИМЕРНЫЕ МАТЕРИАЛЫ Фенолформальдегидные смолы
- 43. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ ПРОИЗВОДСТВО ВЕЩЕСТВ Уксусная кислота Этилацетат Формалин
- 44. Контрольные вопросы Найдите формулу альдегида: 2. Исключите лишнее вещество в ряду: 3. Какая функциональная группа называется
- 45. 6. Укажите формулу 2,3-диметилпентаналя: 7. Общая формула гомологического ряда предельных альдегидов: а) CnH2nO б) CnH2n+2O в)
- 46. 9. Гидратацией какого алкина можно получить альдегид? Напишите уравнение реакции, укажите условия её проведения. а) этина
- 48. Скачать презентацию














![Допишите ОВР HCOH + KMnO4(изб) + H2SO4 → HCOH + [Ag(NH3)2OH] → HCOH + Cu(OH)2 →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/588709/slide-25.jpg)










 Фенолы+
Фенолы+ Классификация химических реакций
Классификация химических реакций Механизмы органических реакций
Механизмы органических реакций Химия в повседневной жизни человека
Химия в повседневной жизни человека Водород
Водород Нуклеозиды. Нуклеиновые кислоты
Нуклеозиды. Нуклеиновые кислоты Классы неорганических веществ. Классификация неорганических веществ
Классы неорганических веществ. Классификация неорганических веществ Поширення металів у природі
Поширення металів у природі Кислоты. Химические свойства кислот
Кислоты. Химические свойства кислот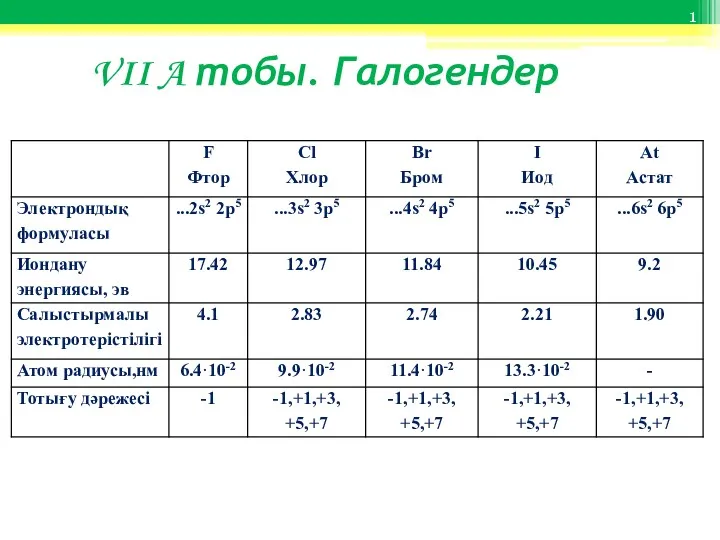 VII A тобы. Галогендер
VII A тобы. Галогендер Агрегатные состояния вещества
Агрегатные состояния вещества Технология производства бутилкаучука
Технология производства бутилкаучука Природные источники углеводородов, их переработка, применение и экологические проблемы. 10 класс
Природные источники углеводородов, их переработка, применение и экологические проблемы. 10 класс Разделение углеводородных газов
Разделение углеводородных газов Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов Будова електронних оболонок атомів
Будова електронних оболонок атомів Свойства химических элементов и закономерность их изменения
Свойства химических элементов и закономерность их изменения Значение органической химии в жизни человека
Значение органической химии в жизни человека Органічні сполуки (9 клас)
Органічні сполуки (9 клас) Майлардың анықтамасы
Майлардың анықтамасы Харчові добавки
Харчові добавки Реакции ионного обмена
Реакции ионного обмена Хімічні властивості оксидів
Хімічні властивості оксидів Колоїдний захист
Колоїдний захист Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Алкены (олефины, этиленовые углеводороды)
Алкены (олефины, этиленовые углеводороды) Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды