Содержание
- 2. Тема Металлы, их классификация. Их положение в ПСХЭ. Физические и химические свойства металлов.
- 3. 1.Положение металлов в ПСХЭ Д. И. Менделеева
- 4. 1.Положение металлов в ПСХЭ Д. И. Менделеева К элементам - металлам относятся: s - элементы I
- 5. 2.Строение атомов металлов и веществ металлов Из положения в таблице Д.И. Менделеева следует: Атомы металлов на
- 6. 2. У атомов металлов большие размеры атомных радиусов. Поэтому металлы легко отдают внешние электроны. Металлы в
- 7. Металлическая связь – это связь в металлах и сплавах между атом-ионами металлов, расположенными в узлах кристаллической
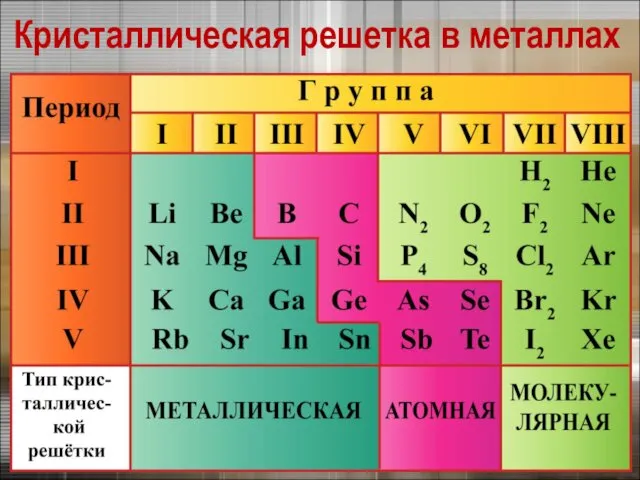
- 8. Кристаллическая решетка в металлах
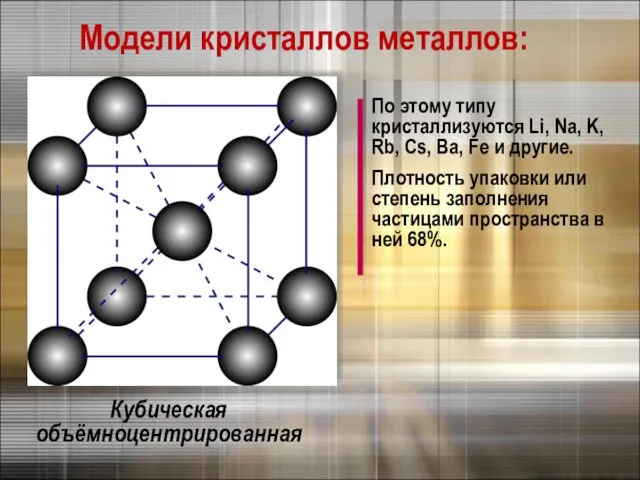
- 9. Модели кристаллов металлов: Кубическая объёмноцентрированная По этому типу кристаллизуются Li, Na, K, Rb, Cs, Ba, Fe
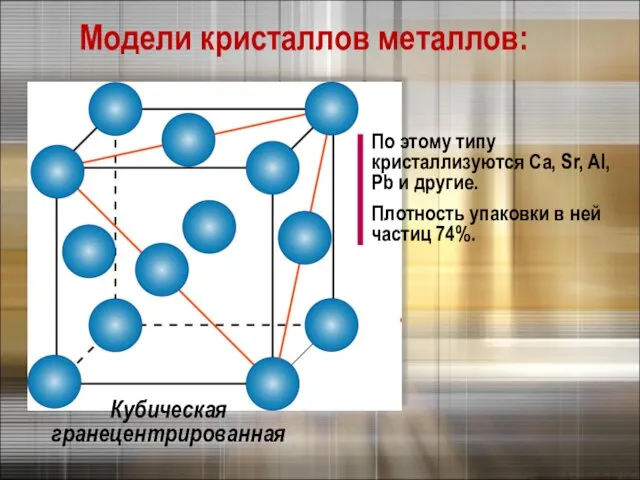
- 10. Кубическая гранецентрированная По этому типу кристаллизуются Са, Sr, Al, Pb и другие. Плотность упаковки в ней
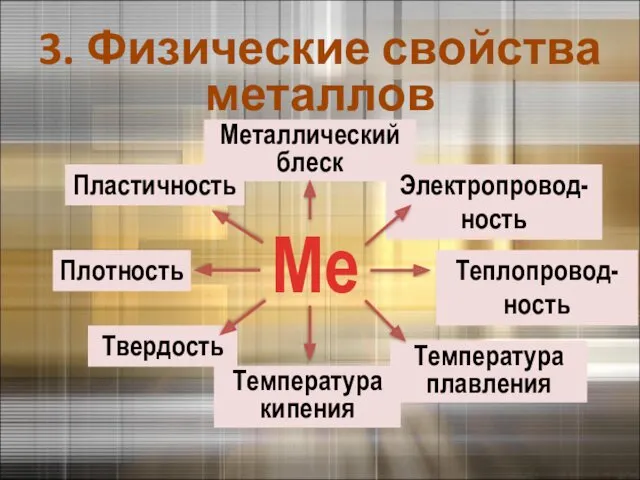
- 11. Температура плавления Ме Металлический блеск Теплопровод-ность Электропровод-ность Температура кипения Твердость Плотность Пластичность 3. Физические свойства металлов
- 12. 3. Физические свойства металлов 1. Металлический блеск Самые блестящие металлы – Hg, Ag, Pd. В порошке
- 13. металлический блеск Электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло. Поэтому все
- 14. Металлический блеск Зеркало состоит из гладкого стекла, на которое наносят очень тонкий слой металла. Часто зеркала
- 16. 3. Физические свойства металлов Высокая электропроводность и теплопроводность уменьшается в ряду металлов: Аg Сu Аu Аl
- 18. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической
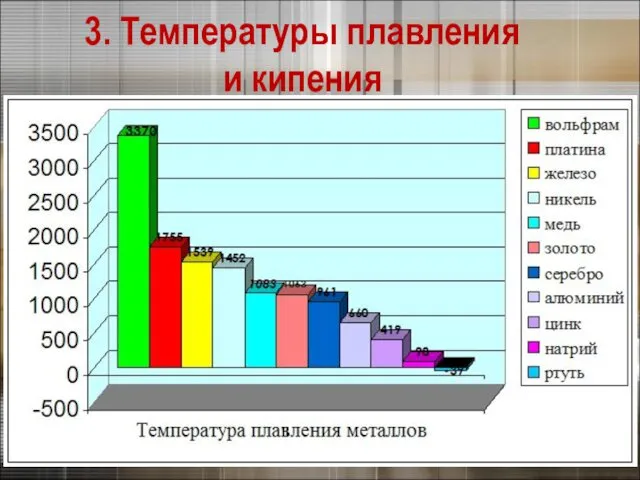
- 19. 3. Физические свойства металлов 3. Температуры плавления и кипения Калий Вольфрам Ртуть
- 20. 3. Температуры плавления и кипения
- 21. 3. Физические свойства металлов 3. Температуры плавления и кипения Самый легкоплавкий металл – ртуть (т.пл. =
- 22. Нить накаливания
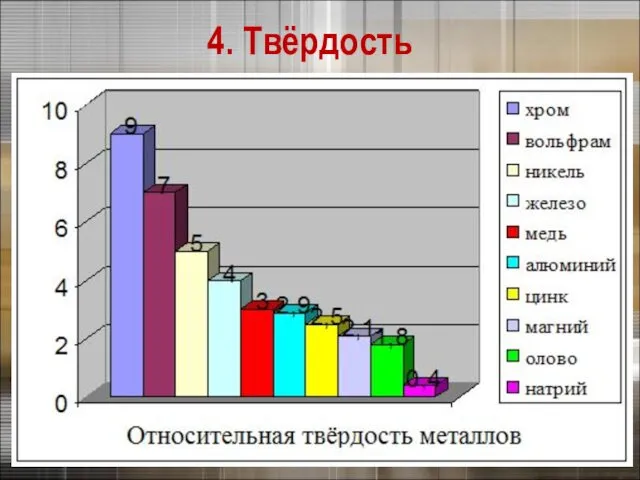
- 23. 3. Физические свойства металлов 4. Твёрдость Щелочные металлы режутся ножом
- 24. 4. Твёрдость
- 25. Хром – самый твёрдый металл
- 26. 4. Твёрдость Самый твердый – хром (режет стекло). Самые мягкие – щелочные металлы – калий, натрий,
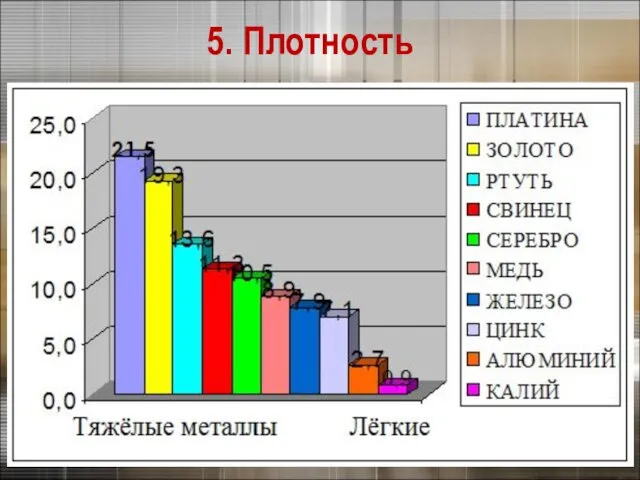
- 27. Плотность тем меньше, чем меньше атомная масса металла и чем больше радиус его атома 5. Плотность
- 28. 5. Плотность
- 29. Самый легкий – литий (ρ =0,53 г/см3), всплывает в керосине. Самый тяжелый – осмий (ρ =22,6
- 30. Литий – самый лёгкий металл
- 31. Осмий – самый тяжёлый металл Осмий – самый дорогой металл (изотоп 187)
- 32. 6. Пластичность Способность изменять свою форму при ударе, прокатываться в тонкие листы, вытягиваться в проволоку: золото,
- 33. Физические свойства металлов Пластичность. Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов
- 34. 6. Пластичность Всем известна алюминиевая фольга. Алюминиевая фольга - это тонкий слой алюминия, в котором отлично
- 35. Сусальное золото
- 36. 7. Способность намагничиваться - железо, кобальт, никель. Находит применение при изготовлении магнитов.
- 37. 8. Агрегатное состояние Все металлы твердые, исключение ртуть - единственный жидкий металл.
- 38. Выводы : Все металлы имеют металлическую кристаллическую решетку. В металлах осуществляется металлическая связь. Основные физические свойства
- 39. Классификация металлов По плотности. Металлы делятся на: легкие - (плотность меньше 5г/см³). К ним относят литий,
- 40. Классификация металлов По температуре плавления Легкоплавкие металлы (температура плавления меньше 1000ºС). Самый легкоплавкий из металлов –
- 41. Классификация металлов По отношению к магнитным полям: Ферромагнитные – способные намагничиваться при действии слабых магнитных полей
- 42. Классификация металлов По строению внешнего валентного слоя S – металлы – s-элементы, кроме H и He.
- 43. Классификация металлов В технике металлы принято делить на: Черные металлы : Имеют темно-серый цвет, большую плотность,
- 44. Все остальные металлы объединены в группу цветных. Они имеют характерную окраску: красную, желтую, белую; обладают большой
- 45. Au, Ag, Pt, Pd, Rh, Ir, Os, Ru относят к драгоценным металлам
- 46. Химические свойства металлов. 1. Металлы – восстановители. 2Mg0+O20=2Mg+2O-2 восст-ль ок-ль
- 47. Химические свойства металлов. 2. Металлы и неметаллы 2Al0 + 3 Br20 = 2Al+3Br -3 бромид алюминия
- 48. 3. Металлы и вода. 2Na+2H2O=2NaOH+Н2↑ Закончите уравнения химических реакций: Li+H2O → … + … К+H2O →
- 50. 4. Металлы и кислоты. Zn + HCl →…+…
- 51. 5. Взаимодействие металлов с солями CuSO4 + Zn = Zn SO4 + Cu CuSO4 + Fe
- 52. Способы получения металлов а) Пирометаллургия – это получение металлов из их соединений при высоких температурах с
- 53. б) Гидрометаллургия – это получение металлов, которое состоит из двух процессов: сначала природное соединение металла (оксид)
- 54. в) Электрометаллургия – это получение металлов при электролизе растворов или расплавов их соединений. Роль восстановителя при
- 55. Применение металлов Конструкционные материалы. Металлы и их сплавы - один их главных конструкционных материалов современной цивилизации.
- 56. Применение металлов Электротехнические материалы. Металлы используются как в качестве хороших проводников электричества (медь, алюминий), так и
- 57. Применение металлов Инструментальные материалы. Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части).
- 59. Скачать презентацию

















































 Сучасні каталізатори у процесах нафтопереробки та нафтохімії
Сучасні каталізатори у процесах нафтопереробки та нафтохімії Природные источники углеводородов
Природные источники углеводородов Гидроксид магния
Гидроксид магния Классы неорганических веществ. Соли
Классы неорганических веществ. Соли Экскурсия по химическому факультету
Экскурсия по химическому факультету Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Второй закон термодинамики. Биоэнергетика
Второй закон термодинамики. Биоэнергетика Окислительно-восстановительные реакции. Генетическая взаимосвязь неорганических веществ
Окислительно-восстановительные реакции. Генетическая взаимосвязь неорганических веществ Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Природные источники углеводородов, их переработка, применение и экологические проблемы
Природные источники углеводородов, их переработка, применение и экологические проблемы Химическая промышленность России входит в авангардную тройку
Химическая промышленность России входит в авангардную тройку Химия өнеркәсібі
Химия өнеркәсібі Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Введение в органическую химию
Введение в органическую химию Биосенсорные системы
Биосенсорные системы Соли. Определение солей
Соли. Определение солей Металлы в живой приподе
Металлы в живой приподе Химия и здоровье человека
Химия и здоровье человека Соединения серы
Соединения серы Вищі карбонові кислоти. Мила. Синтетичні миючі засоби
Вищі карбонові кислоти. Мила. Синтетичні миючі засоби Борорганические соединения и их применение
Борорганические соединения и их применение Гидроксид лития ( LiOH)
Гидроксид лития ( LiOH) Массообменные процессы
Массообменные процессы Химические вещества, как строительные и поделочные материалы
Химические вещества, как строительные и поделочные материалы Алкадиены CnH2n
Алкадиены CnH2n Тепловой эффект химической реакции
Тепловой эффект химической реакции Азотная кислота и нитраты
Азотная кислота и нитраты Углекислый газ
Углекислый газ