Содержание
- 2. Ведущие проверяемые элементы содержания: реакции окислительно-восстановительные,окислитель, восстановитель, электронный баланс Проверяемые умения (виды деятельности): определять степень окисления
- 3. Задание 36 Используя метод электронного баланса, составьте уравнение реакции Na2SO3 + … + KOH → K2MnO4
- 4. При оценивании задания 36 следует в первую очередь обращать внимание на усвоение и сформированность следующих знаний
- 5. Составление электронного баланса K2Cr2O7 + KBr + H2SO4 → Cr2(SO4)3 + Br2 + … 2Cr+6 +
- 6. Задание выполнено полностью правильно. Оценка: 3 балла. Пример 1 KIO3 + KI + … → I2
- 7. Пример 2 Ответ содержит лишние записи, однако оснований для снижения оценки нет. Оценка: 3 балла.
- 8. Неверно записаны продукты реакции (NaCrO4, СО), остальные элементы ответа ошибок не содержат. Пример 3 Оценка: 2
- 9. Неверно определен продукт восстановления перманганата калия (MnO2, а не MnSO4). Остальные элементы ответа ошибок не содержат.
- 10. Неверно определен один из продуктов реакции, не учтен характер среды. Остальные элементы ответа ошибок не содержат.
- 11. Пример 6 Неверно определен один из продуктов реакции, не учтен характер среды. Остальные элементы ответа ошибок
- 12. Неверно составлен электронный баланс; указание окислителя и восстановителя дано не совсем грамотно, но это не может
- 13. Неверно составлен электронный баланс; неверно указаны окислитель и восстановитель. Пример 8 Оценка: 1 балл
- 14. Неверно составлен электронный баланс. Пример 9 Оценка: 2 балла
- 15. Удвоены коэффициенты в уравнении реакции. Однако оснований для снижения оценки нет: учащийся продемонстрировал усвоение проверяемых элементов
- 16. В качестве окислителя учащимся выбран N2O5, а не NaNO3, как предусмотрено авторами задания. Смысл ответа не
- 17. Задание 37 Генетическая взаимосвязь неорганических веществ
- 18. Задание 37 Генетическая взаимосвязь неорганических веществ Ведущие проверяемые элементы содержания: Характерные химические свойства неорганических веществ различных
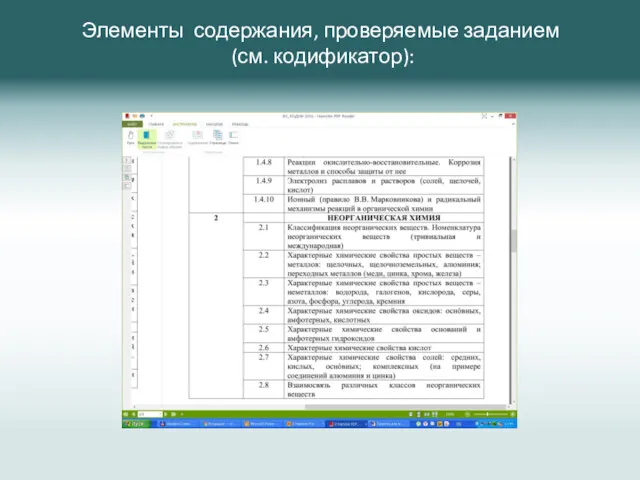
- 19. Элементы содержания, проверяемые заданием (см. кодификатор):
- 20. Необходимо проявить умение составлять уравнения реакций, соответствующих всем типам взаимодействия неорганических веществ: кислотно-основное взаимодействие; реакции ионного
- 21. Карбид алюминия полностью растворили в бромоводородной кислоте. К полученному раствору добавили раствор сульфита калия, при этом
- 22. Цинк полностью растворили в концентрированном растворе гидроксида калия. Образовавшийся прозрачный раствор выпарили, а затем прокалили. Твёрдый
- 23. При взаимодействии растворов сульфата меди(II) и хлорида бария образовался осадок. Осадок отделили и провели электролиз оставшегося
- 25. Скачать презентацию





















 Водород. Нахождение в природе. Физические и химические свойства. Применение
Водород. Нахождение в природе. Физические и химические свойства. Применение Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів
Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів Кам’яне вугілля, продукти його переробки
Кам’яне вугілля, продукти його переробки Сложные эфиры. Жиры
Сложные эфиры. Жиры Основы химической термодинамики. Термохимические расчеты
Основы химической термодинамики. Термохимические расчеты Сабын
Сабын Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05)
Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05) Кремний и его соединения. Простое вещество - кристаллический кремний Si
Кремний и его соединения. Простое вещество - кристаллический кремний Si Нефть
Нефть Анализ начальных участков изотерм адсорбции
Анализ начальных участков изотерм адсорбции Органическая химия. Лекция 13
Органическая химия. Лекция 13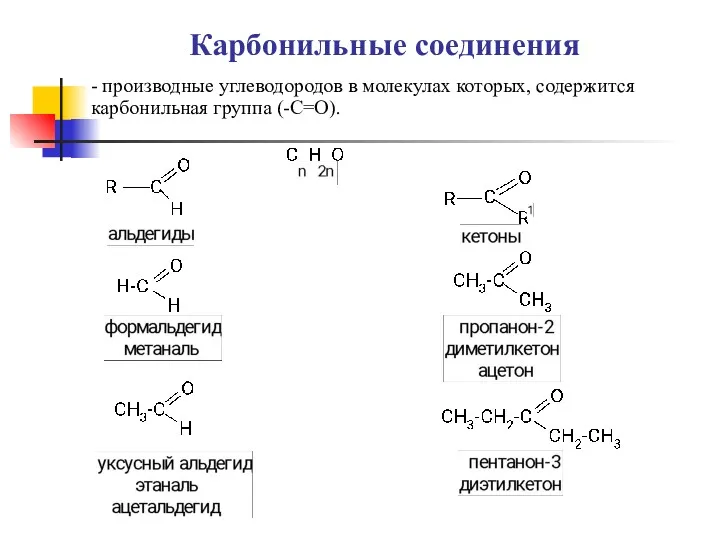 Карбоновые кислоты, альдегиды
Карбоновые кислоты, альдегиды Основные синтетические полимеры
Основные синтетические полимеры Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Углерод и его свойства
Углерод и его свойства Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Йодометрия
Йодометрия Лекция №11 ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ
Лекция №11 ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Углерод, как химический элемент и простое вещество
Углерод, как химический элемент и простое вещество Химические свойства металлов
Химические свойства металлов Таза зат және қоспа. Қоспаларды бөлу әдістері. Қосылыс Рure substances and mixtures . Мethods for separating mixtures. Compound
Таза зат және қоспа. Қоспаларды бөлу әдістері. Қосылыс Рure substances and mixtures . Мethods for separating mixtures. Compound Інгібіювання та регуляція ензимів
Інгібіювання та регуляція ензимів Основные законы химии. (Лекция 1)
Основные законы химии. (Лекция 1) Минералы. Свойства минералов
Минералы. Свойства минералов Свойства минералов
Свойства минералов Реактор получения элементарной серы
Реактор получения элементарной серы Кристалл. Основные законы кристаллографии
Кристалл. Основные законы кристаллографии