Содержание
- 2. Роль растворов в природе. ¾ земного шара занимает вода 97% воды приходится на океаны и моря
- 3. Гомогенные смеси веществ переменного состава называются растворами. Компонент раствора, концентрация которого выше других компонентов, является растворителем.
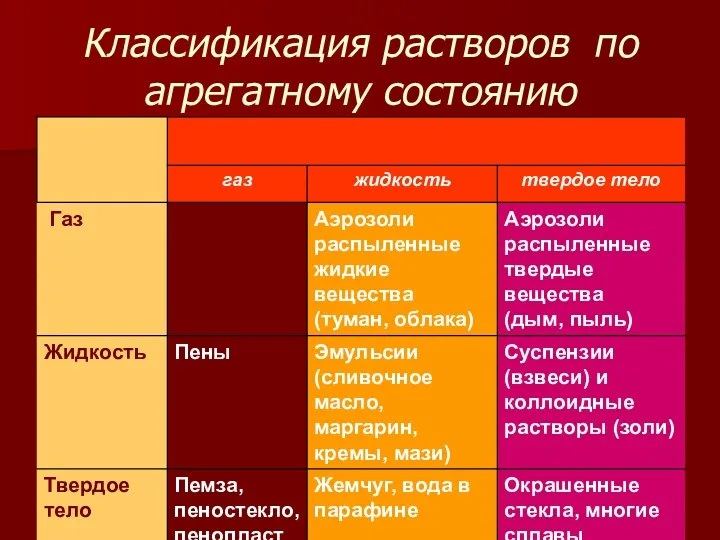
- 4. Классификация растворов по агрегатному состоянию
- 5. ИСТИННЫЕ РАСТВОРЫ Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ
- 6. Растворимость для различных веществ колеблется в значительных пределах и зависит от их природы, взаимодействия частиц растворенного
- 7. КОНЦЕНТРАЦИИ РАСТВОРОВ К безразмерным концентрациям (долям) относятся следующие концентрации: Массовая доля растворенного вещества W(B) выражается в
- 8. 2. Объемная доля растворенного вещества σ(B) выражается в долях единицы или объемных процентах: (доли) или %
- 9. 3. Мольная доля растворенного вещества χ(B) выражается соотношением: Сумма мольных долей компонентов раствора равна единице.
- 10. К размерным концентрациям относятся следующие концентрации: 1. Молярная концентрация Молярная концентрация или молярность (См ) показывает
- 11. Задача 1. Определить M и ω раствора, содержащего 18 г H3PO4 в 300 г H2O (ρ
- 12. М (Н3РО4) = 3 + 31 + 64 = 98 г/моль 5) Молярность:
- 13. Растворимость Растворимость твердых веществ в жидкости Растворимость – количество растворимого вещества в граммах способное растворится при
- 14. Если энергия, которую надо затратить на разрушение кристаллической решетки твердого тела, больше энергии сольватации, то процесс
- 15. При повышении температуры растворимость большинства твердых веществ увеличивается, например:
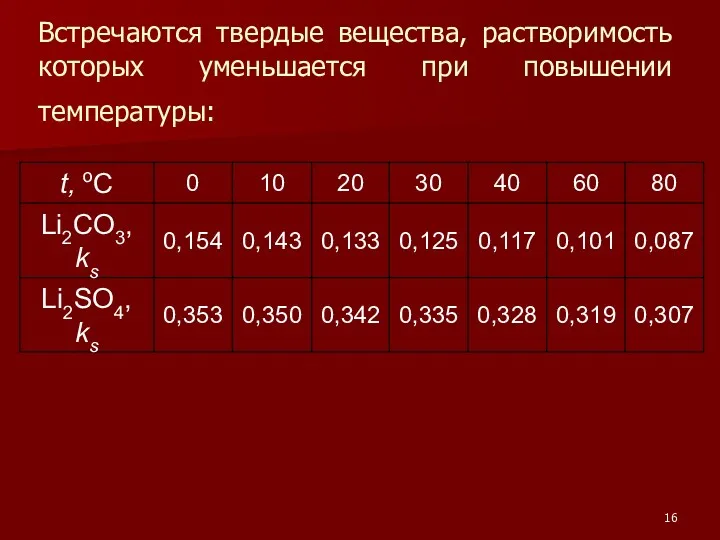
- 16. Встречаются твердые вещества, растворимость которых уменьшается при повышении температуры:
- 17. Т.к. объем системы при растворении меняется незначительно, то давление на этот процесс не оказывает существенного влияния.
- 19. Задачи на растворимость Задача 1. Массовая доля соли в насыщенном при 20oC растворе хлорида калия равна
- 20. Задача 2. Определите массовую долю насыщенного раствора соли, если коэффициент растворимости этой соли равен 45 г
- 21. Задачи на выпадение осадков из растворов Если вещество удаляется из раствора, то масса воды остается неизменной.
- 22. Задача 3. Какая масса хлорида калия выпадает в осадок из 900 г раствора, насыщенного при 80
- 23. 3. Найдем массу соли в растворе при 20 oC , приходящуюся на эту массу воды: в
- 24. Задача 4. Из 200 мл 62,96 %-ного раствора нитрата калия (ρ = 1,35 г/мл) при охлаждении
- 25. 1. Найдем массу исходного раствора : m р-ра (1) = 200 · 1,35 = 270 г
- 26. Задания для самостоятельной работы: Установите соответствие между составом раствора и его концентрацией:
- 28. Скачать презентацию























 Углерод. Элемент IV группы
Углерод. Элемент IV группы Электронный помощник по химии 8 класс
Электронный помощник по химии 8 класс Химия переходных элементов IV – V группы
Химия переходных элементов IV – V группы Общая характеристика неметаллов
Общая характеристика неметаллов Ископаемые углеводороды
Ископаемые углеводороды Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Гидролиз солей
Гидролиз солей Неорганическая химия
Неорганическая химия Химический анализ веществ
Химический анализ веществ Альдегиды и кетоны
Альдегиды и кетоны Углеводы. 10 класс
Углеводы. 10 класс Углеводороды. Применение природных источников углеводородов и продуктов их переработки
Углеводороды. Применение природных источников углеводородов и продуктов их переработки Состав, строение и свойства натурального каучука
Состав, строение и свойства натурального каучука Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары
Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов Кислые породы умеренно-щелочного ряда
Кислые породы умеренно-щелочного ряда Классификация химических реакций
Классификация химических реакций Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Первые шаги в минералогию: от новичка до знатока
Первые шаги в минералогию: от новичка до знатока Инертные газы
Инертные газы Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги
Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги Диссоциация кислот, оснований, солей
Диссоциация кислот, оснований, солей 20231110_zakon_avogadro
20231110_zakon_avogadro Спирттер мен фенолдар
Спирттер мен фенолдар Аминокислоты и белки
Аминокислоты и белки Карбон
Карбон Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем
Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем Азотная кислота
Азотная кислота