Содержание
- 2. СЛОВО «АТОМ» ПРИДУМАЛ БОЛЕЕ 2500 ЛЕТ НАЗАД ДРЕВНЕГРЕЧЕСКИЙ ФИЛОСОФ ДЕМОКРИТ АТОМ – ЭТО МЕЛЬЧАЙШАЯ ХИМИЧЕСКИ НЕДЕЛИМАЯ
- 3. Развитие представлений о строении атома Открытие рентгеновских лучей (1895 г., К. Рентген) Открытие катодных лучей (1897
- 4. Модель атома У.Томсона Уильям Томсон представляет атом как некую положительно заряженную субстанцию, в которую вкраплены электроны,
- 5. Модель атома Дж.Томсона Джозеф Джон Томсон представил свою модель строения атома в 1904 году. Он представляет
- 6. Модель атома Ленарда Ленард предложил свою модель строения атома в 1904 году. Он считает, что атом
- 7. Модель атома Нагаока Хантаро Нагаока предложил свою модель строения атома в 1904 году. Он считал, что
- 8. Опыт Резерфорда Ганс Вильгельм Гейгер Эрнест Марсден Эрнест Резерфорд
- 9. Квантовая модель Бора Постулаты Бора Электроны находятся на определенных стационарных орбитах, двигаясь по которым они не
- 10. Современная квантовая модель Н. Бор - создатель первой квантовой теории атома и активный участник разработки основ
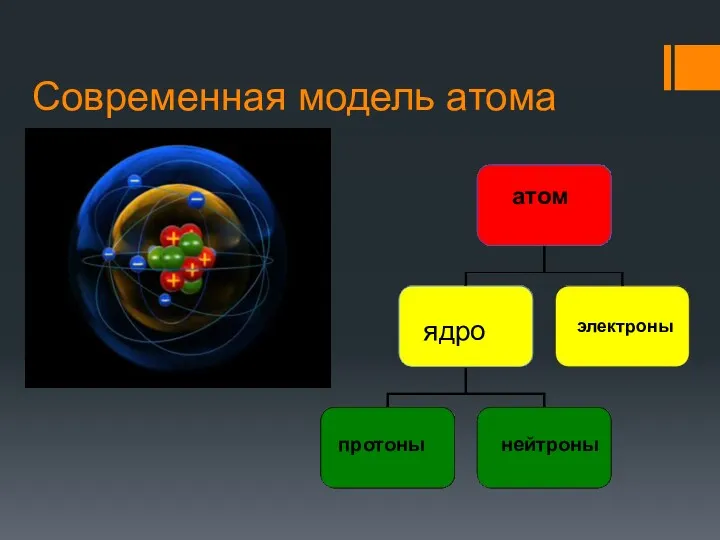
- 11. Современная модель атома ядро атом электроны нейтроны протоны
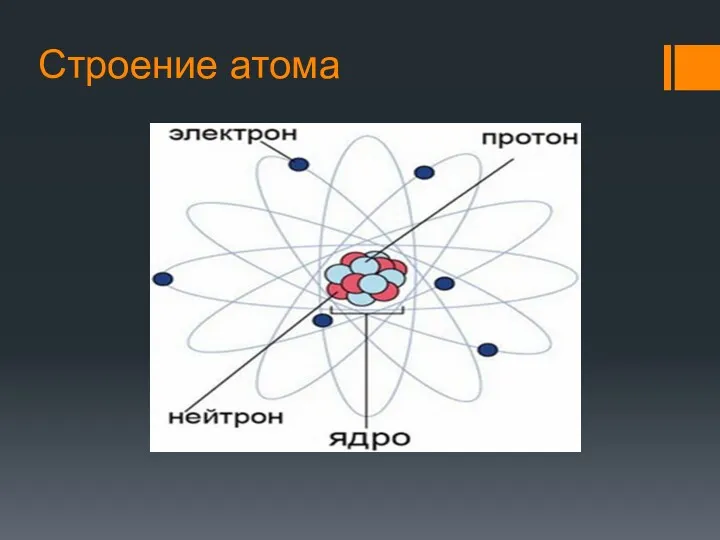
- 12. Строение атома
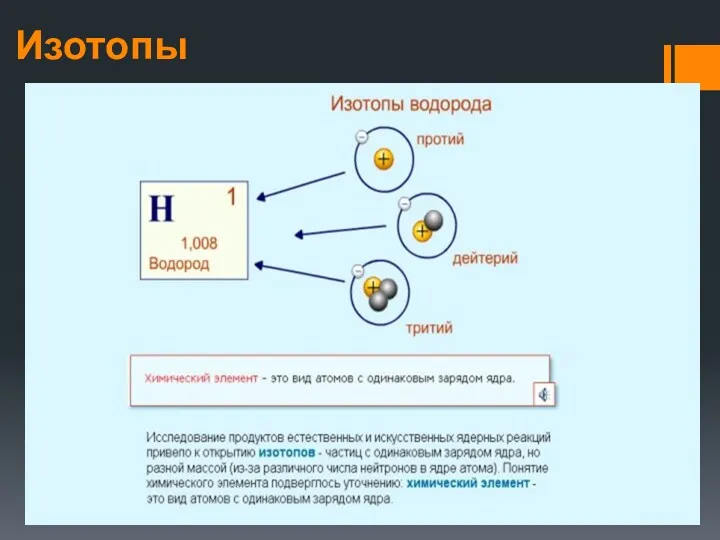
- 15. Изотопы
- 17. Электронная оболочка атома – совокупность всех электронов в атоме (число электронов в атоме равно числу протонов,
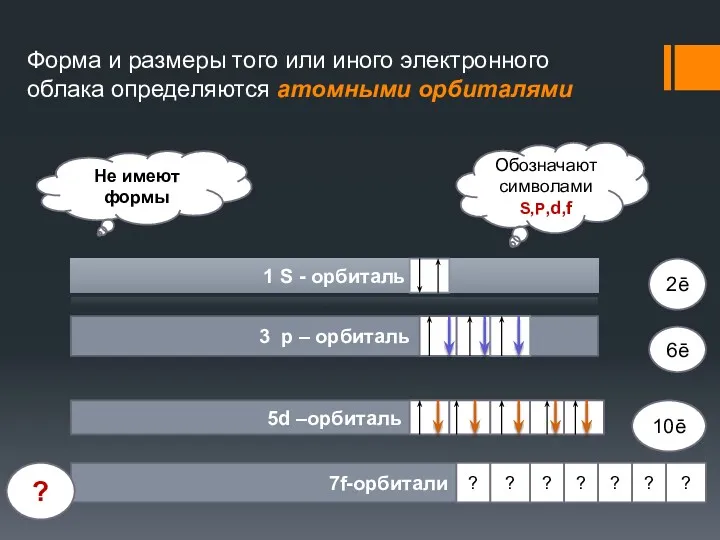
- 18. Формы электронных орбиталей S- облака (сферической формы) Р – облака (гантелеобразной формы) d – облака f
- 19. Форма и размеры того или иного электронного облака определяются атомными орбиталями Не имеют формы Обозначают символами
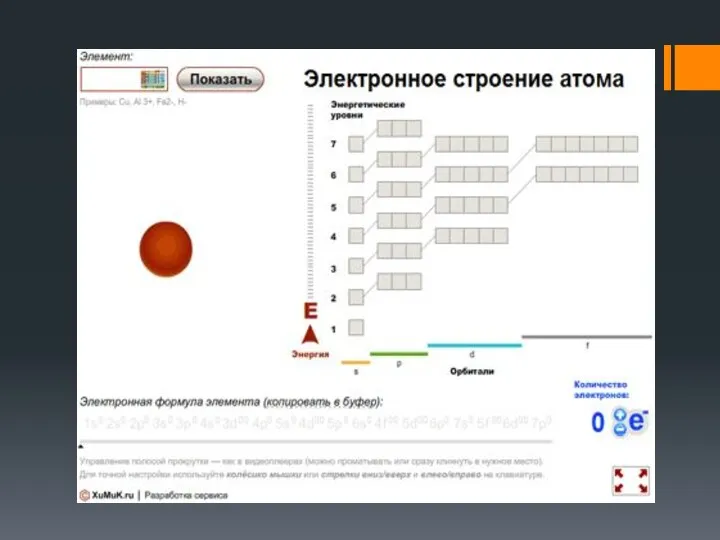
- 20. Электронные конфигурации атомов
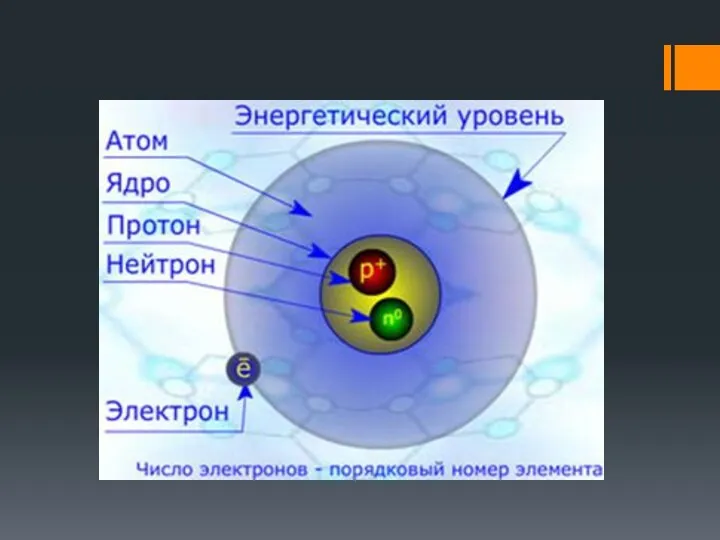
- 22. Порядковый номер элемента соответствует заряду атомного ядра, т.е. числу протонов и числу электронов в электронной оболочке
- 23. Закономерности элементов Строение атома элемента. (с ростом его порядкового номера) В пределах периода Увеличиваются заряды атомных
- 24. В пределах одной группы (главной подгруппы) Увеличиваются заряды атомных ядер элементов Число электронов на внешнем энергетическом
- 26. Скачать презентацию
















 Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Предельные одноосновные карбоновые кислоты
Предельные одноосновные карбоновые кислоты Оксосоединения. Основные понятия
Оксосоединения. Основные понятия Органічні сполуки. Предмет органічної хімії
Органічні сполуки. Предмет органічної хімії Классы неорганических веществ
Классы неорганических веществ Получение кислот
Получение кислот Типы расчетных задач, способы их решения. Задания 39-40
Типы расчетных задач, способы их решения. Задания 39-40 Икаит Ca[CO3]·6 (H2O)
Икаит Ca[CO3]·6 (H2O) Вищі карбонові кислоти. Мило, його мийна дія. 9 клас
Вищі карбонові кислоти. Мило, його мийна дія. 9 клас Практикум по органической и биоорганической химии
Практикум по органической и биоорганической химии Магматические породы и постмагматические процессы
Магматические породы и постмагматические процессы Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения
Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения Признаки химических реакций. Урок химии в 8 классе
Признаки химических реакций. Урок химии в 8 классе Кислотность органических соединений. Типы химических реакций
Кислотность органических соединений. Типы химических реакций Химические методы определения U, Pu, Th
Химические методы определения U, Pu, Th Химиядан сұрақтар
Химиядан сұрақтар Химическая организация клетки. Неорганические вещества, входящие в состав клетки
Химическая организация клетки. Неорганические вещества, входящие в состав клетки Галогены
Галогены Водородная связь
Водородная связь Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD
Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD Основы электрохимии
Основы электрохимии Коррозия металлов. Способы защиты металлов от коррозии
Коррозия металлов. Способы защиты металлов от коррозии Минералы и их строение
Минералы и их строение Коррозия металлов. Классификация коррозионных процессов
Коррозия металлов. Классификация коррозионных процессов Олигомеризация олефинов
Олигомеризация олефинов Применение уксусной кислоты
Применение уксусной кислоты Центрифугирование
Центрифугирование Первичная переработка нефти
Первичная переработка нефти