Содержание
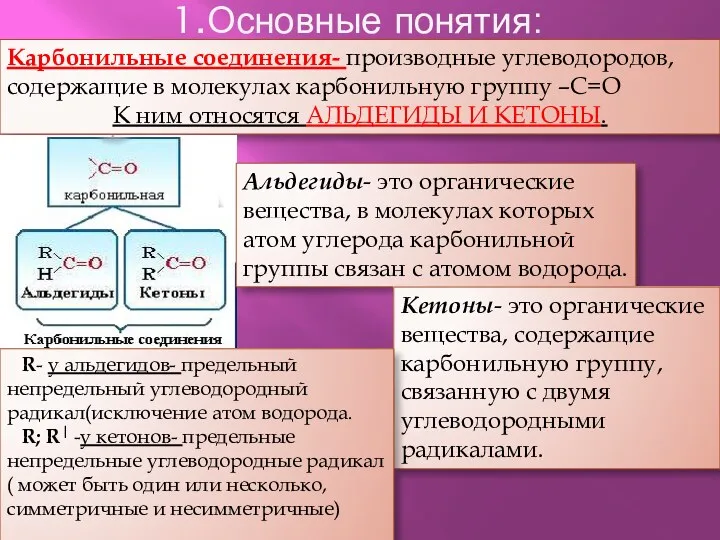
- 2. 1.Основные понятия: Карбонильные соединения- производные углеводородов, содержащие в молекулах карбонильную группу –С=О К ним относятся АЛЬДЕГИДЫ
- 3. 2. Номенклатура и изомерия. Альдегиды. Название по международной номенклатуре равно: название алкана плюс суффикс аль. Первоначальной
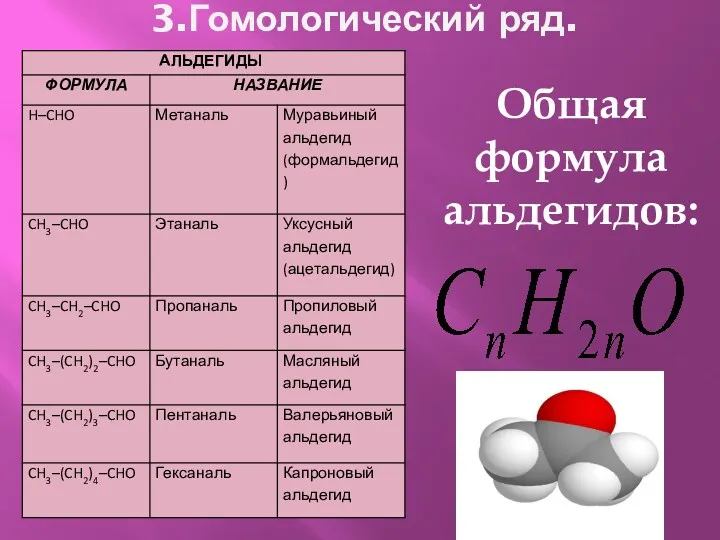
- 4. 3.Гомологический ряд. Общая формула альдегидов:
- 5. 4.Способы получения: I Общие методы. 1.Окисление спиртов(первичные спирты до альдегидов, вторичные- до кетонов) а) Каталитическое окисление
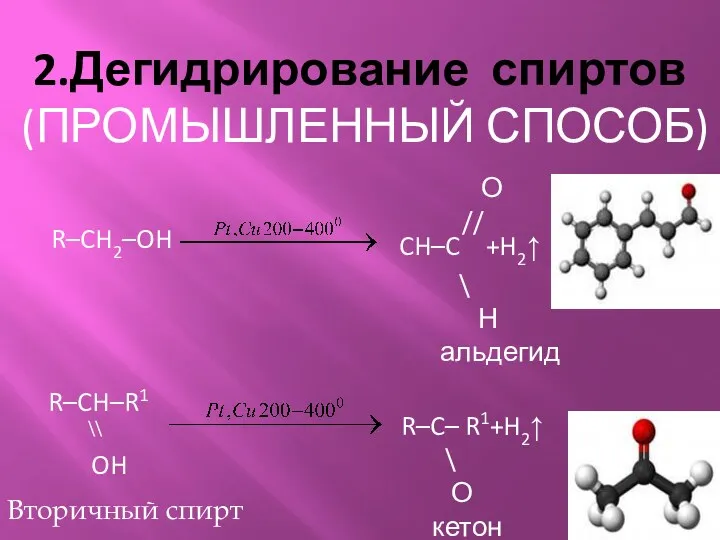
- 6. 2.Дегидрирование спиртов (ПРОМЫШЛЕННЫЙ СПОСОБ) R–CH2–OH \ Н альдегид CH–C +H2↑ О // R–CH–R1 \\ R–C– R1+H2↑
- 7. 3.Из дигалогенопроизводных. О // СН3–CH–Cl + 2 KOH→ CH3-CH-ОH + 2KCl → H2O + CH3- C
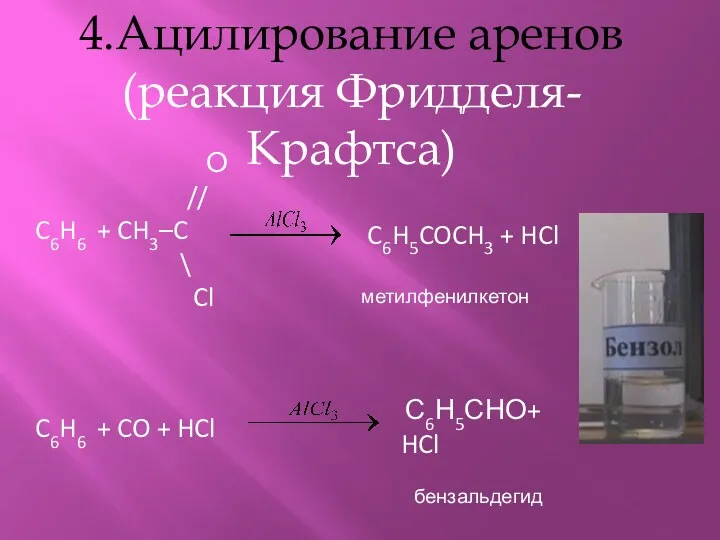
- 8. 4.Ацилирование аренов (реакция Фридделя-Крафтса) О // C6H6 + CH3–C \ Cl C6H5COCH3 + HCl метилфенилкетон C6H6
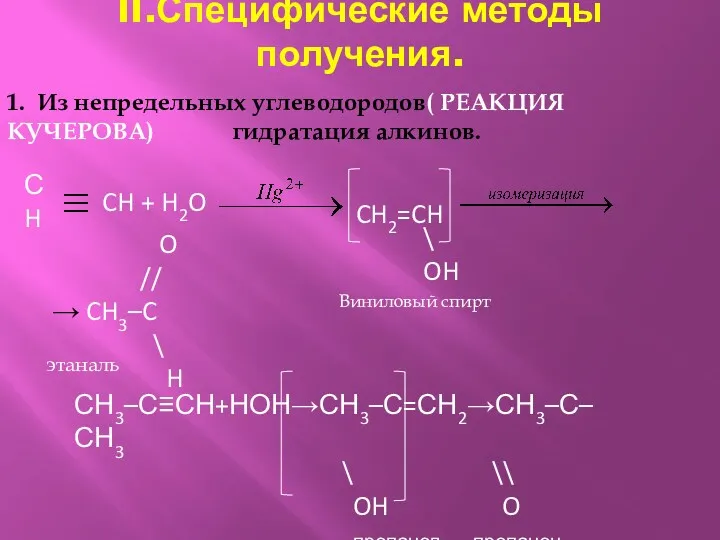
- 9. II.Специфические методы получения. 1. Из непредельных углеводородов( РЕАКЦИЯ КУЧЕРОВА) гидратация алкинов. СH CH + H2O CH2=CH
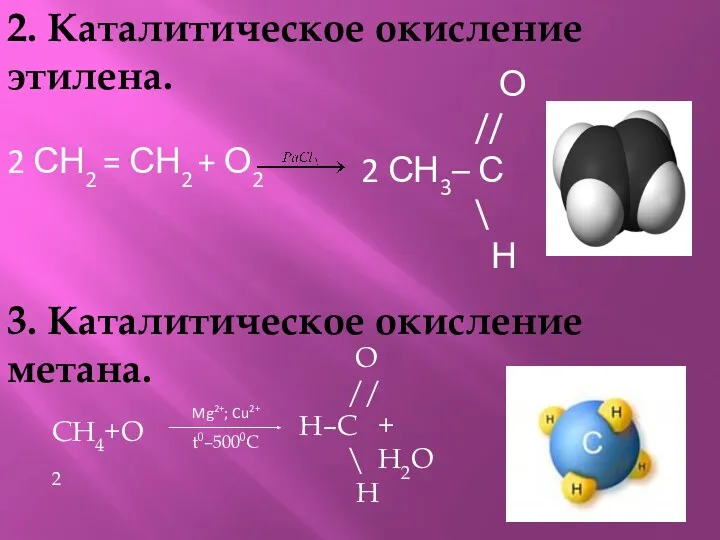
- 10. 2. Каталитическое окисление этилена. 2 СН2 = СН2 + О2 О // 2 СН3– С \
- 11. Физические свойства. Метаналь - газ с резким, неприятным запахом. Этаналь – летучая жидкость ( t0 кип-200С)
- 12. Химические свойства. Альдегиды и кетоны обладают электрофильным центром, способны вступать во взаимодействие с нуклеофильными реагентами, поэтому
- 13. 1. Реакция гидратации. О ОН // / CH3 – C + HOH → CH3 – CH
- 14. 3. Взаимодействие со спиртами. Полуацетали – это соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную
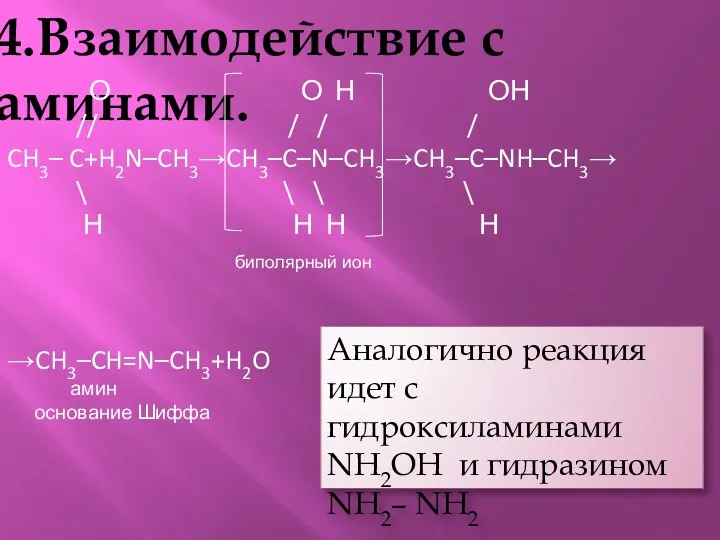
- 15. 4.Взаимодействие с аминами. О О Н ОН // / / / CH3– C+H2N–CH3→CH3–C–N–CH3→CH3–C–NH–CH3→ \ \ \
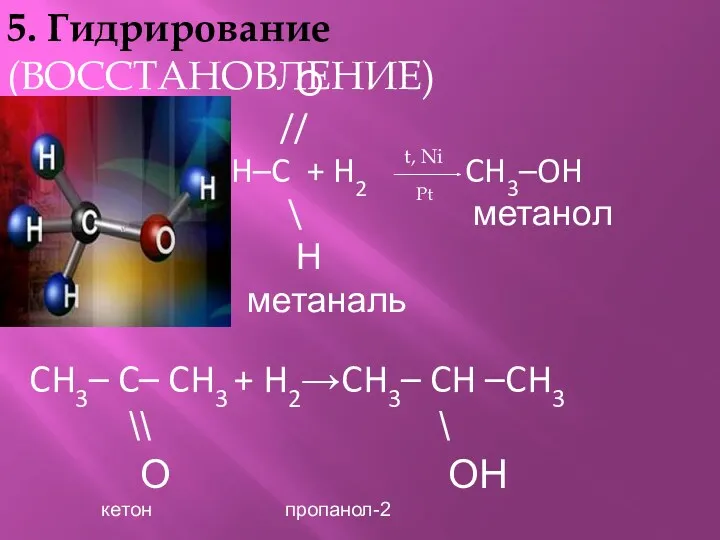
- 16. 5. Гидрирование(ВОССТАНОВЛЕНИЕ) О // H–C + H2 CH3–OH \ метанол Н метаналь t, Ni Pt CH3–
- 17. 6. Присоединение гидросульфита натрия. О SO Na // / CH3– C + NaHSO3 → CH3– CH↓
- 18. 7. Взаимодействие с фуксинсернистой кислотой. При прибавлении к раствору альдегид фуксинсернистой кислоты, раствор приобретает красное или
- 19. 8.Полимеризация альдегидов Линейная полимеризация. При испарении или длительном стоянии раствора формальдегида, происходит образование парофармальдегидов(ПАРАФОРМ) О //
- 20. II. Реакции окисления. Качественные реакции на альдегидную группу С=ОН 1. Реакция «Серебряного зеркала» AgNO3 + NH4OH
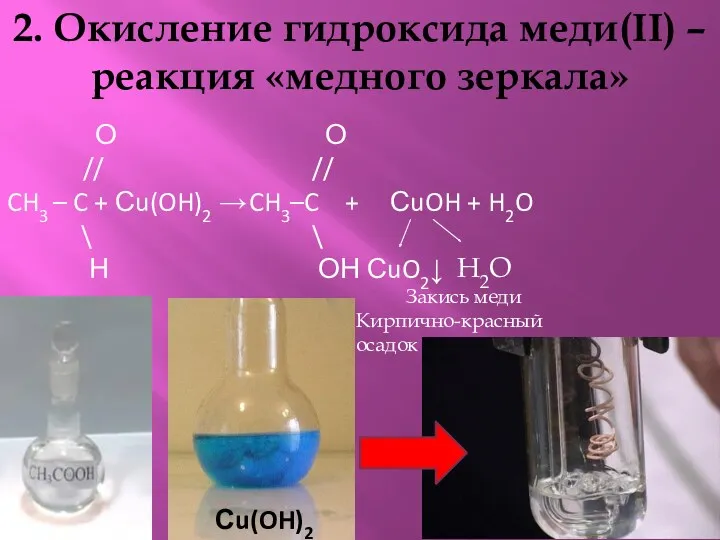
- 21. 2. Окисление гидроксида меди(II) – реакция «медного зеркала» О // CH3 – C + Сu(OH)2 →
- 22. 3.Окисление жидкостью Феллинга. CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4 О СООК О СООК // /
- 23. КЕТОНЫ НЕ ОКИСЛЯЮТСЯ СЛАБЫМИ КИСЛОТАМИ. Реакция окисления кетонов: О О // // CH3– C – CH3
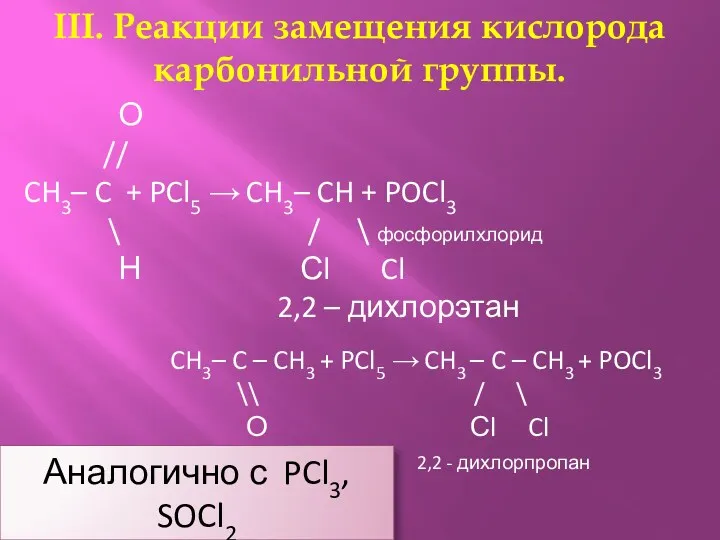
- 24. III. Реакции замещения кислорода карбонильной группы. О // CH3– C + PCl5 → CH3– CH +
- 25. IV. Реакции в углеводородном радикале – объясняется повышенной реакционной способностью атомов водорода, находящихся при ᾳ -
- 26. Отдельные представители. Формальдегид Ацетальдегид Хлорал Ацетон Бензальдегид
- 27. Формальдегид. Это газ, с неприятным резким , острым запахом, хорошо растворим в воде. 40% раствор формальдегида
- 28. Применение формальдегида.
- 29. Ацетальдегид. Бесцветная, летучая жидкость, с неприятным удушливым запахом – это в большой концентрации. В малых –
- 30. Хлораль. О // CCl3 – C - бесцветная масляная \ жидкость t◦кип.–900 Н При растворении в
- 31. Ацетон. Бесцветная жидкость с характерным запахом, легче воды, смешивается с ней в любых отношениях. Применяется в
- 32. Бензальдегид. Бесцветная масляная жидкость, с горьким миндальным запахом, в воде не растворим. Используется для получения красителей,
- 34. Скачать презентацию



















 Химия элементов
Химия элементов Щелочной характер растворов, применяемых в домашних условиях
Щелочной характер растворов, применяемых в домашних условиях Сутектік көрсеткіш ph. Тұздар гидролизі
Сутектік көрсеткіш ph. Тұздар гидролизі Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля Воздух и его свойства
Воздух и его свойства Частицы вещества: молекула, атом, ион
Частицы вещества: молекула, атом, ион Элементы триады железа: Fe, Co, Ni. (Лекция 16)
Элементы триады железа: Fe, Co, Ni. (Лекция 16) Каучук
Каучук Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів
Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів Oxidation – Reduction Reaction
Oxidation – Reduction Reaction Алкины. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция №4
Алкины. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция №4 Щелочные металлы
Щелочные металлы Природный каучук
Природный каучук Растворы электролитов. Лекция №3
Растворы электролитов. Лекция №3 Строение атома
Строение атома Таблицы. Определение характера оксидов
Таблицы. Определение характера оксидов Химическая технология ситаллов и композитов. Прессование
Химическая технология ситаллов и композитов. Прессование Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью
Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью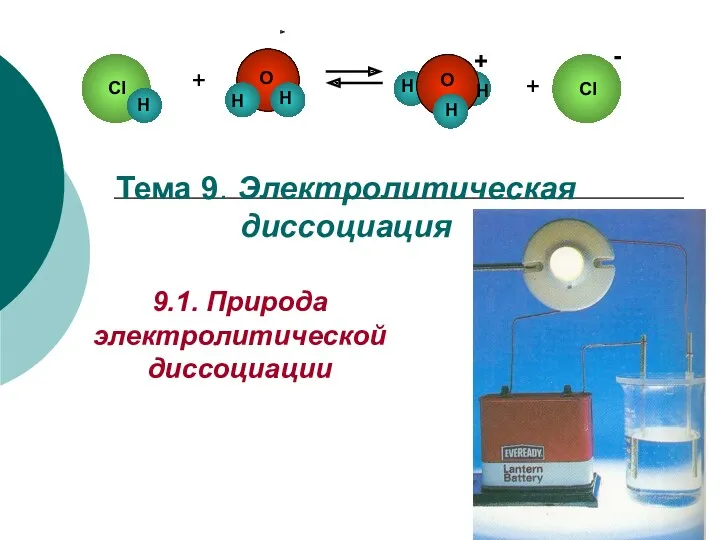 Электролитическая диссоциация
Электролитическая диссоциация КСЕ. Концепции химии. (Лекция 6)
КСЕ. Концепции химии. (Лекция 6) Химический факультет
Химический факультет Гетероциклические соединения. Классификация, номенклатура, строение и значение гетероциклов
Гетероциклические соединения. Классификация, номенклатура, строение и значение гетероциклов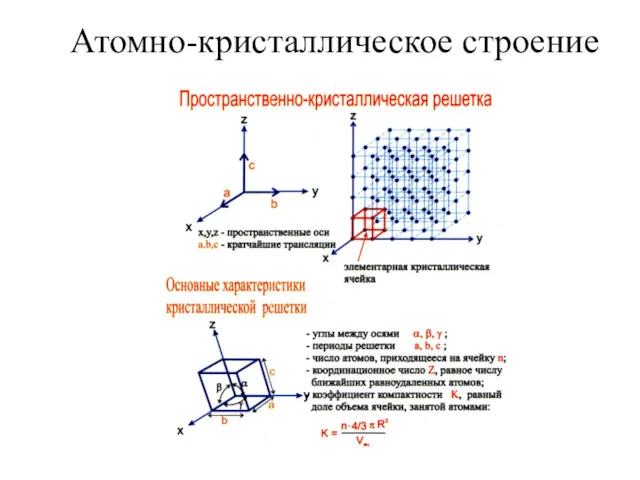 Атомно-кристаллическое строение
Атомно-кристаллическое строение Циклоалканы. 10 класс
Циклоалканы. 10 класс Плотность нефти и нефтепродуктов
Плотность нефти и нефтепродуктов Химическая связь. Природа химической связи
Химическая связь. Природа химической связи Минералы и их строение
Минералы и их строение Электролиз расплавов, водных растворов
Электролиз расплавов, водных растворов