Содержание
- 2. Терминология Электролиз – совокупность ОВР, осуществляющихся на электродах при пропускании через раствор или расплав электролита постоянного
- 3. Электролиз расплавов NaCl, расплав NaCl → Na+ + Cl- (диссоциация на ионы) Катод(-): Na+ Na+ +
- 4. Электролиз расплавов NaCl, расплав NaCl → Na+ + Cl- (диссоциация на ионы) Катод(-): Na+ Na+ +
- 5. Электролиз водных растворов
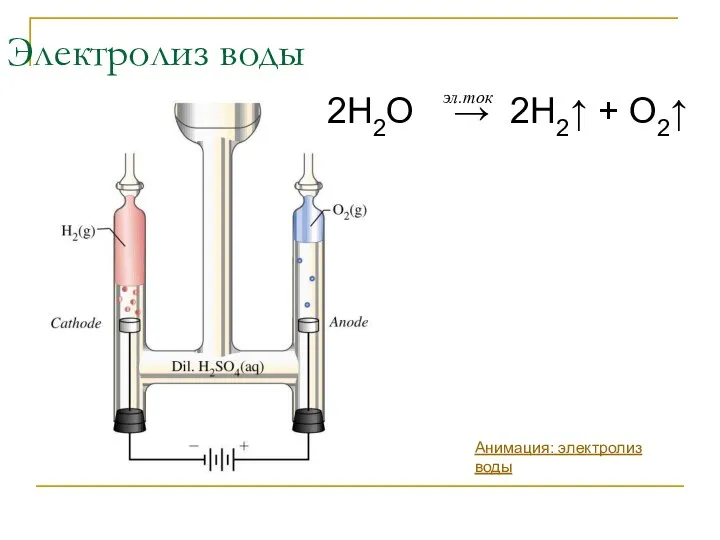
- 6. Электролиз воды 2H2O → 2H2↑ + O2↑ эл.ток Анимация: электролиз воды
- 7. Окисление и восстановление воды на электродах Катод H2O +1 -2 → H + OH- 0 2
- 8. Порядок восстановления на катоде Eº, В Процесс восстановления воды 2H2O + 2e- = H2 + 2OH-
- 9. Порядок окисления на аноде CO32-, SO42-, NO3- и т.д. 2H2O - 4e- → O20 + 4H+
- 10. Электролиз растворов солей (1). CuCl2, раствор CuCl2 → Cu2+ + 2Cl- (ЭД) Катод(-): Cu2+, H2O Cu2+
- 11. Электролиз CuCl2 Посмотрите схему
- 12. CuSO4, раствор CuSO4 → Cu2+ + SO42- (ЭД) Катод: Cu2+, H2O Cu2+ + 2e- → Cu0
- 13. NaCl, раствор NaCl → Na+ + Cl- (ЭД) Катод: Na+, H2O 2H2O + 2e- → H2↑
- 14. Электролиз растворов солей (4). Na2SO4, раствор Na2SO4 → 2Na+ + SO42- (ЭД) Катод: Na+, H2O 2H2O
- 15. Электролиз растворов солей (4). Na2SO4, раствор Na2SO4 → 2Na+ + SO42- (ЭД) Катод: Na+, H2O 2H2O
- 16. Электролиз растворов кислородсодержащих кислот H2SO4, раствор H2SO4 → 2H+ + SO42- (ЭД) Катод: H+, H2O 2H+
- 17. Электролиз растворов щелочей NaOH , раствор NaOH → Na+ + OH- (ЭД) Катод: Na+, H2O 2H2O
- 18. Электролиз по Кольбе CH3COONa , раствор CH3COONa → Na+ + CH3COO- (ЭД) Катод: Na+, H2O 2H2O
- 19. Электролиз с активным анодом NiSO4, раствор; анод - никель NiSO4 → Ni2+ + SO42- (ЭД) Катод:
- 21. Законы электролиза 1. Для любого данного электродного процесса количество вещества, испытывающее превращение в данном электродном процессе,
- 22. Законы электролиза 2. При прохождении одинакового количества электричества через растворы различных электролитов количества каждого из веществ,
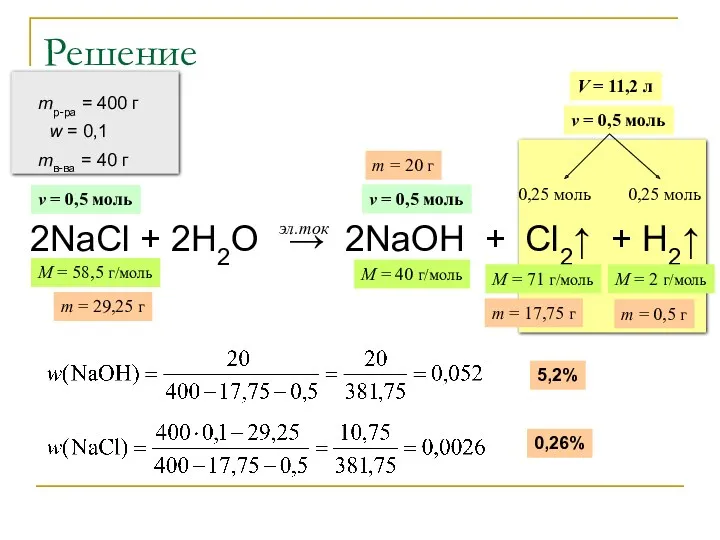
- 23. Расчетные задачи по теме «Электролиз» Через 10%-ный раствор хлорида натрия массой 400 г пропустили постоянный электрический
- 24. Решение 2NaCl + 2H2O → 2NaOH + Cl2↑ + H2↑ эл.ток mр-ра = 400 г w
- 25. Решение (продолжение) 2NaCl + 2H2O → 2NaOH + Cl2↑ + H2↑ эл.ток Ответ: w(NaOH) = 5,2%
- 26. Майкл Фарадей (22.09.1791 – 25.08.1867) с 1813 г. работал в лаборатории Г.Дэви 1813 – 1815 сопровождает
- 27. Майкл Фарадей 1825 директор лаборатории Королевского общества, с 1827 г. – профессор. 1828 – получил этилсерную
- 29. Скачать презентацию






















 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Соединения щелочных металлов
Соединения щелочных металлов Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою Алканы
Алканы Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Предельные углеводороды
Предельные углеводороды Комплесные соединения
Комплесные соединения Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты
Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Алюминий и его соединения
Алюминий и его соединения Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Азотистые гетероциклические соединения
Азотистые гетероциклические соединения Формы минералов и их агрегатов
Формы минералов и их агрегатов Химические свойства металлов
Химические свойства металлов Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі Угарный газ
Угарный газ Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Ферум та його сполуки
Ферум та його сполуки Аминокислоты. Белки
Аминокислоты. Белки