Содержание
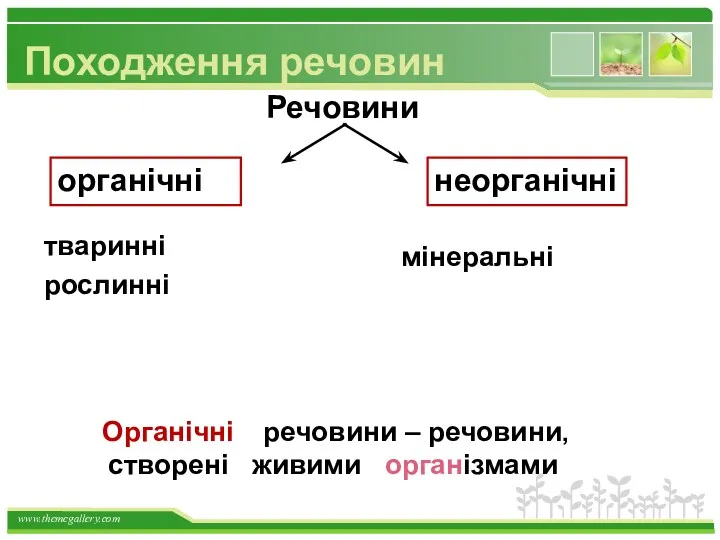
- 2. Походження речовин Речовини рослинні мінеральні органічні неорганічні речовини – речовини, створені живими організмами Органічні тваринні
- 3. Найважливіші характеристики ОС 1) Багатоманітністьсть ( близько 27 млн.) 2)До складу обов’язково входять С і Н,
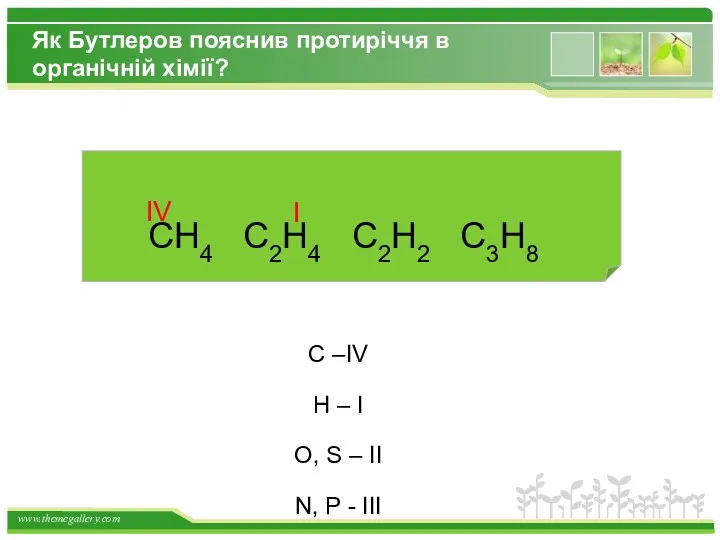
- 4. Як Бутлеров пояснив протиріччя в органічній хімії? CH4 C2H4 C2H2 C3H8 C –IV H – I
- 5. Бутлеров Олександр Михайлович (1828-1886) Російський хімік, академік Петербурзької АН (з 1874 р.). Творець теорії хімічної будови
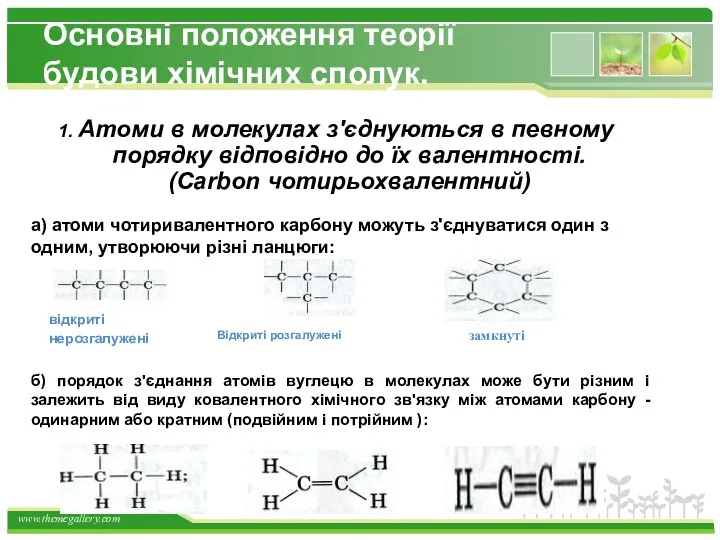
- 6. Основні положення теорії будови хімічних сполук. 1. Атоми в молекулах з'єднуються в певному порядку відповідно до
- 7. Друге положення Властивості речовин залежать не тільки від їх якісного і кількісного складу, але і від
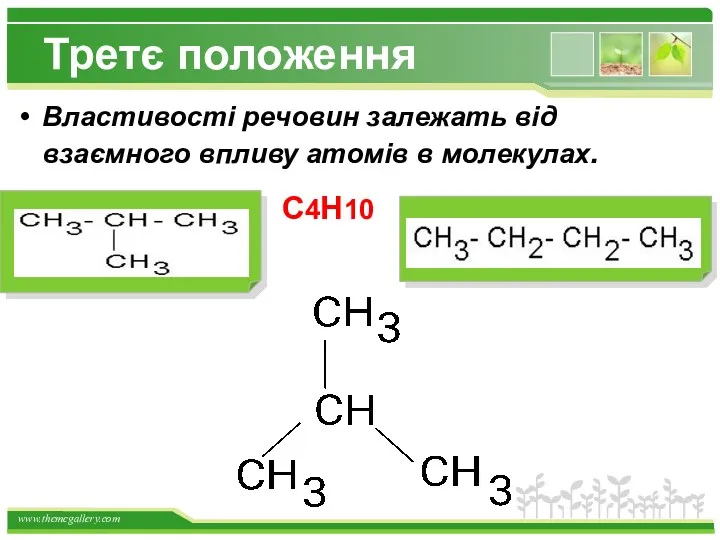
- 8. Третє положення Властивості речовин залежать від взаємного впливу атомів в молекулах. С4Н10
- 9. Класифікація ОС Природні – утворені природнім шляхом, без втручання людини. мед нафта бавовна
- 10. Класифікація ОС Штучні – створює людина в лаборатортних умовах, схожі на природні речовини. хутро бензин шовк
- 11. Класифікація ОС Синтетичні –створює людина в лаборатортних умовах, подібних речовин в природі немає пральні порошки ліки
- 12. Вуглеводні Цілі: Классифікація вуглеводнів Види сполучень атомів Карбону між собою Структурні формули органічних речовин Будова молекул
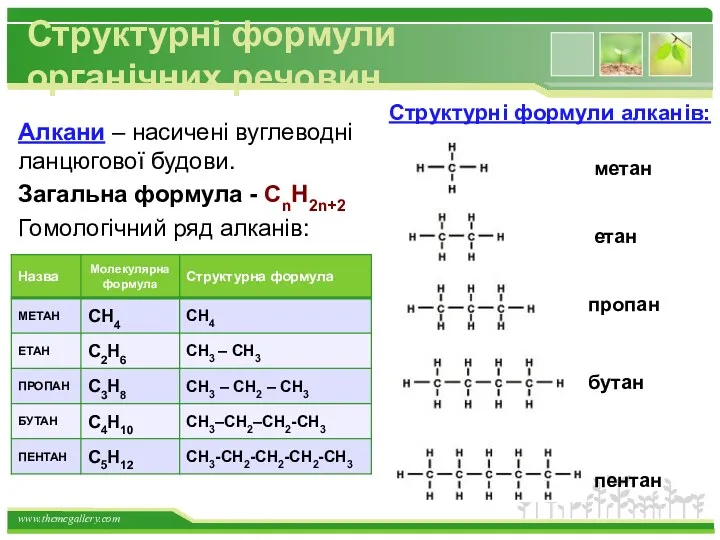
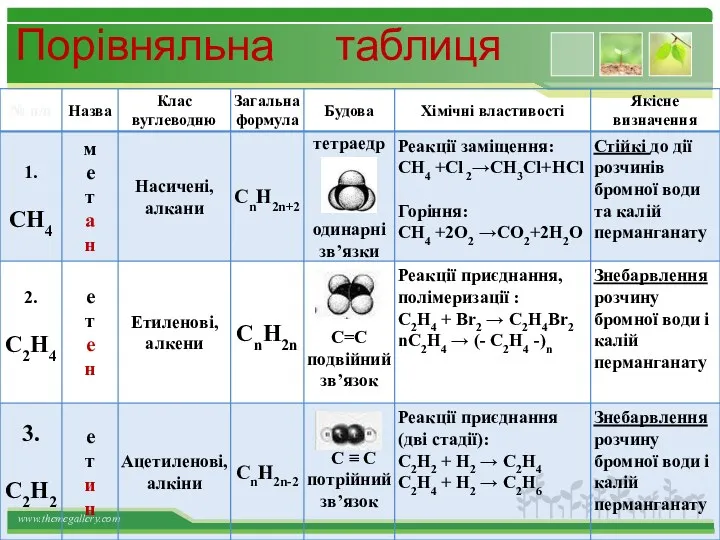
- 13. Структурні формули органічних речовин Алкани – насичені вуглеводні ланцюгової будови. Загальна формула - СnH2n+2 Гомологічний ряд
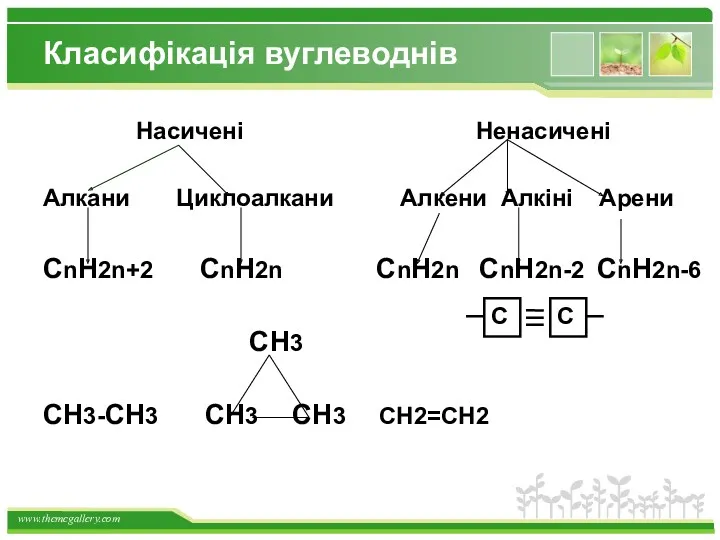
- 14. Класифікація вуглеводнів Насичені Ненасичені Алкани Циклоалкани Алкени Алкіні Арени CnH2n+2 CnH2n CnH2n CnH2n-2 CnH2n-6 CH3 CH3-CH3
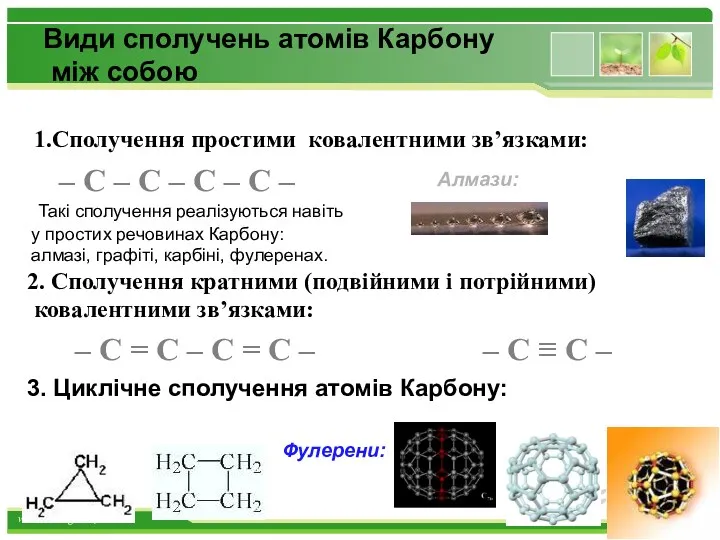
- 15. Види сполучень атомів Карбону між собою 1.Сполучення простими ковалентними зв’язками: – С – С – С
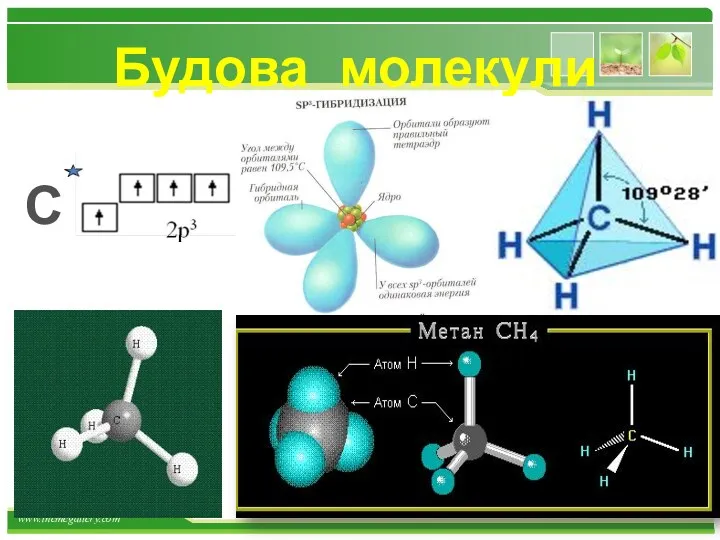
- 16. Будова молекули С
- 17. Фізичні властивості метану: Метан (СН4) - газ; без кольору; без запаху; майже не розчиняється у воді;
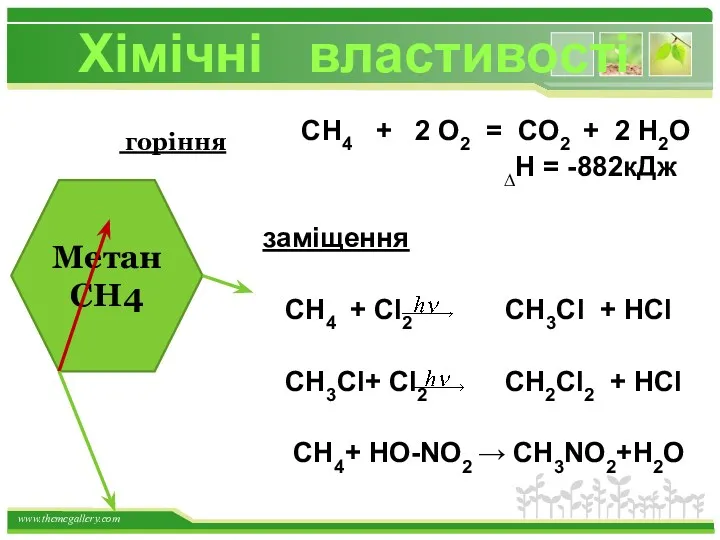
- 18. СН4 + 2 О2 = СО2 + 2 Н2О ∆Н = -882кДж заміщення СН4 + Cl2
- 19. Застосування алканів
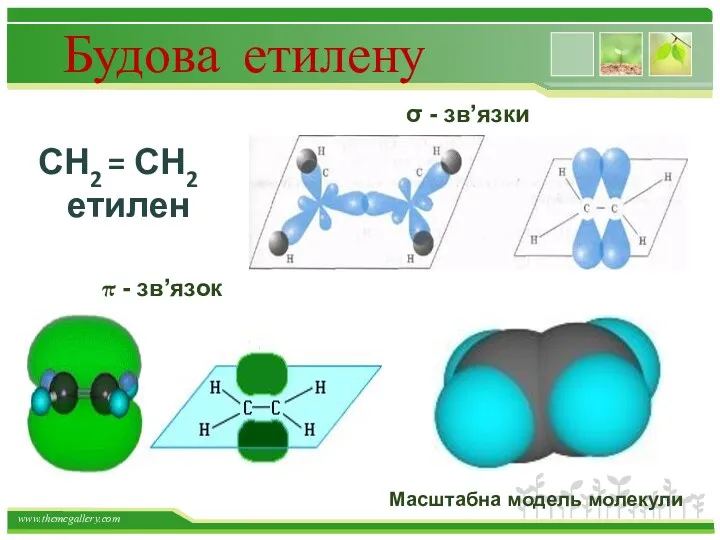
- 20. Будова етилену СН2 = СН2 етилен σ - зв’язки π - зв’язок Масштабна модель молекули
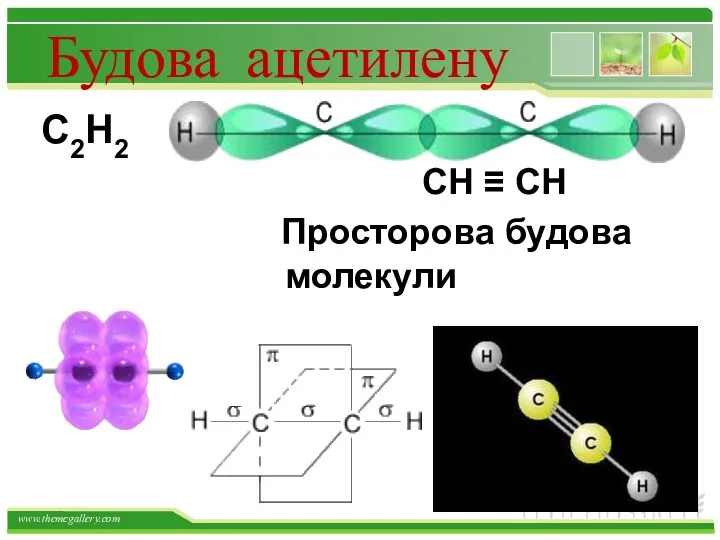
- 21. Будова ацетилену С2Н2 СН ≡ СН Просторова будова молекули
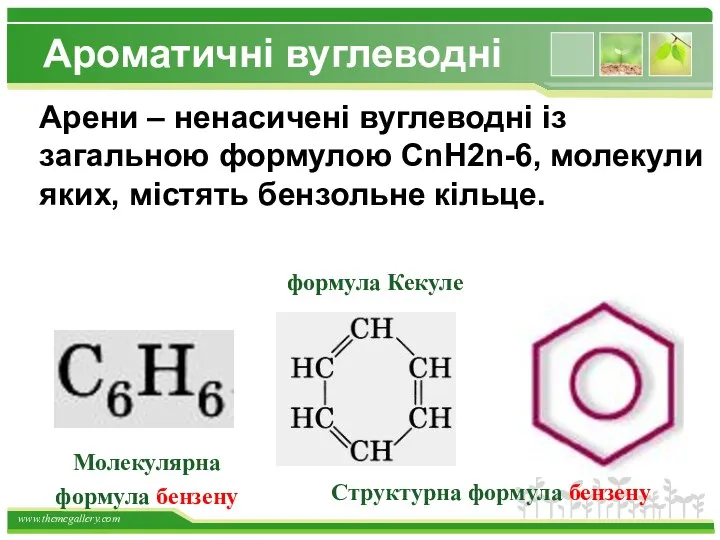
- 22. Структурна формула бензену Арени – ненасичені вуглеводні із загальною формулою CnH2n-6, молекули яких, містять бензольне кільце.
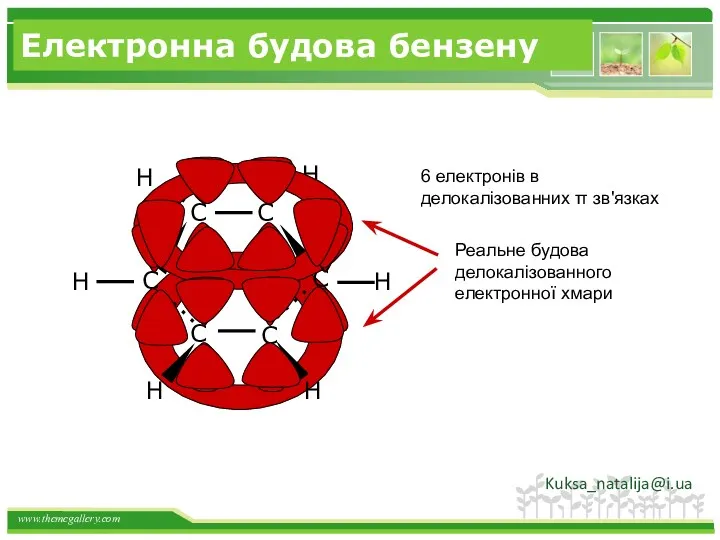
- 23. Електронна будова бензену 6 електронів в делокалізованних π зв'язках Kuksa_natalija@i.ua
- 24. Фізичні властивості етилену С2Н4 безбарвний газ; добре розчинний в органічних розчинниках; tплавл = - 169,2 ̊С;
- 25. Фізичні властивості С2Н2 безбарвний газ; майже без запаху; малорозчинний у воді, але під тиском добре розчиняється
- 26. Фізичні властивості бензену. безбарвна рідина, з різким характерним запахом, легше води, розчиняється у воді, розчинний в
- 27. Хімічні властивості етилену Горіння (з виділенням великої кількості теплоти): С2Н4 + 3O2 → 2СО2 +2Н2О 2.
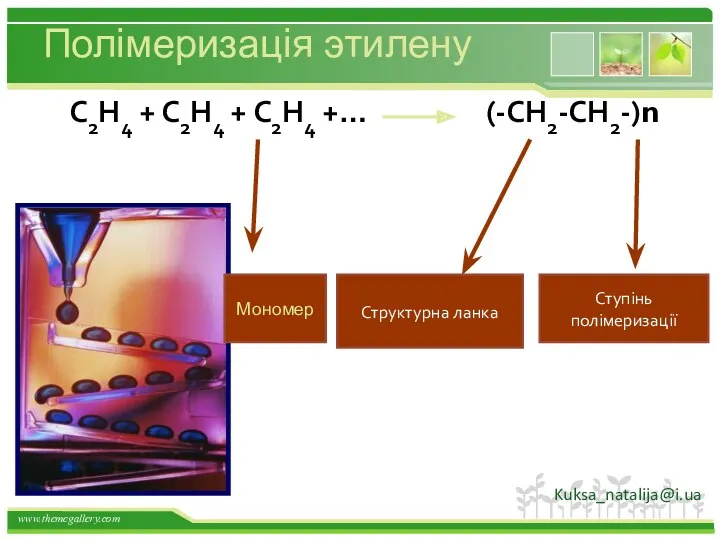
- 28. Полімеризація этилену С2Н4 + С2Н4 + С2Н4 +… (-СН2-СН2-)n Структурна ланка Ступінь полімеризації Мономер Kuksa_natalija@i.ua
- 29. Хімічні властивості ацетилену Горіння (яскравим кіптявим полум’ям): 2С2Н2 + 5O2 → 4СО2 +2Н2О 2. Реакції приєднання
- 30. Порівняльна таблиця
- 31. Бензен горить. Полум'я бензену кіптяве з за високого вмісту карбону в молекулі. Хімічні властивості бензену Через
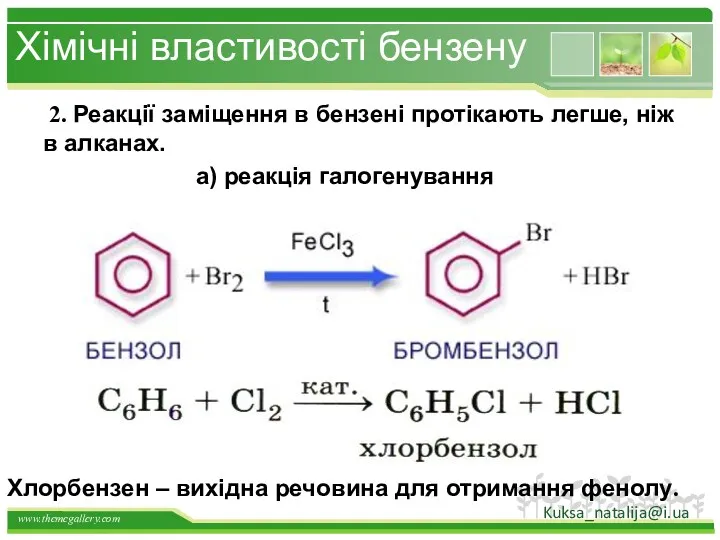
- 32. Хімічні властивості бензену 2. Реакції заміщення в бензені протікають легше, ніж в алканах. а) реакція галогенування
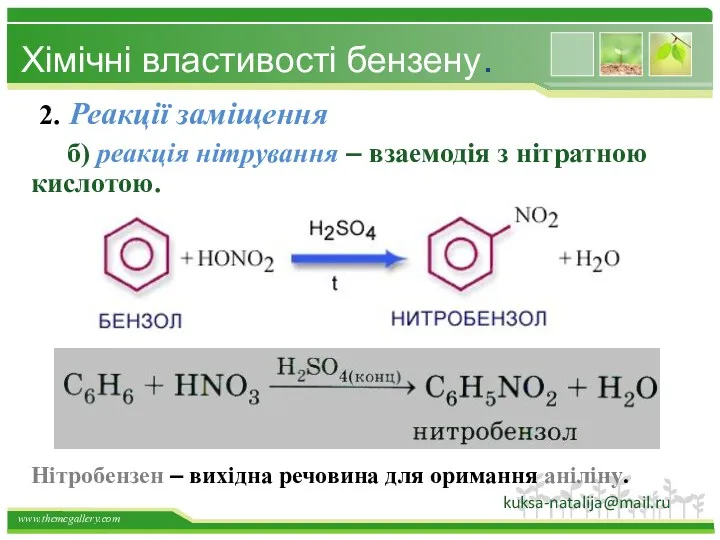
- 33. 2. Реакції заміщення б) реакція нітрування – взаемодія з нітратною кислотою. Хімічні властивості бензену. Нітробензен –
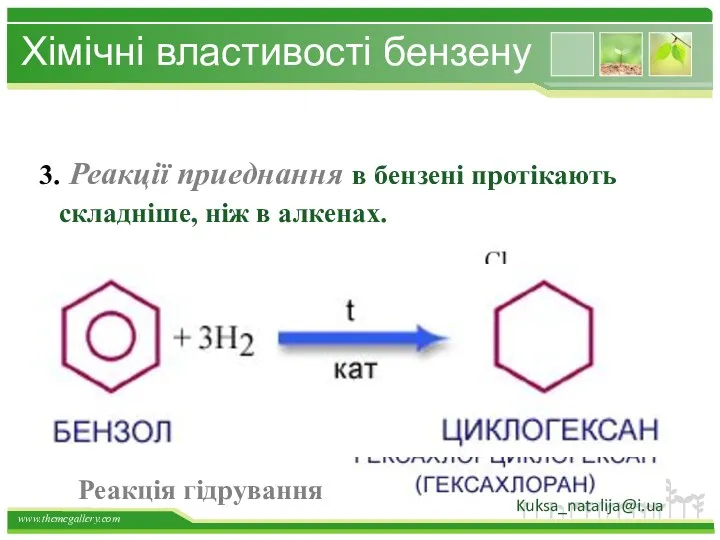
- 34. Хімічні властивості бензену 3. Реакції приеднання в бензені протікають складніше, ніж в алкенах. Реакція гідрування Kuksa_natalija@i.ua
- 35. Хімічні властивості бензену Незважаючи на високу ненасиченість молекули бензену (за складом), він не дає характерних, якісних
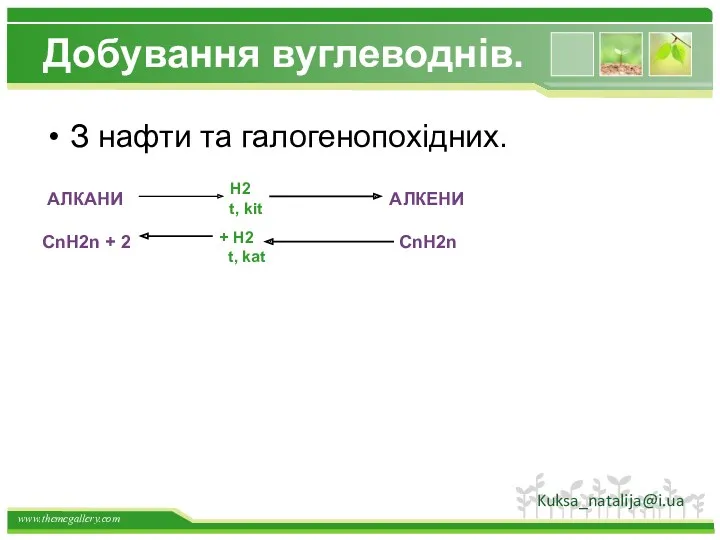
- 36. Добування вуглеводнів. З нафти та галогенопохідних. АЛКАНИ CnH2n + 2 АЛКЕНИ CnH2n H2 t, kit +
- 37. Добування вуглеводнів. АЛКЕНИ - H2 t, kat АЛКІНИ СnH2n + H2 t, kat СnH2n-2 Kuksa_natalija@i.ua
- 38. Добування бензену. Бензен є першим представником аренів. Його можна отримати трімерізаціей ацетилену. Бензен отримують при переробці
- 39. Застосування алкенів
- 40. Застосування алкінів
- 42. Скачать презентацию




















 Лекция 5. Коллигативные свойства растворов
Лекция 5. Коллигативные свойства растворов становление органической химии
становление органической химии Полимерные материалы
Полимерные материалы Природные (натуральные) полимеры. Композиционные материалы
Природные (натуральные) полимеры. Композиционные материалы ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации
ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации Возобновляемое сырье органической химии
Возобновляемое сырье органической химии Растворы и растворители
Растворы и растворители Поляризация электродов
Поляризация электродов Алкены (олефины). Лекция 3
Алкены (олефины). Лекция 3 Электроотрицательность химических элементов
Электроотрицательность химических элементов Алюминий и бор
Алюминий и бор Карбон қышқылдары
Карбон қышқылдары Атыраудағы химиялық өндіріс кәсіп орындары
Атыраудағы химиялық өндіріс кәсіп орындары Формальдегід. Будова та шкідливість
Формальдегід. Будова та шкідливість Изучение состава чая
Изучение состава чая Особенности строения твердых тел
Особенности строения твердых тел Галогенопохідні ароматичних вуглеводнів
Галогенопохідні ароматичних вуглеводнів Амины. Физические и химические свойства
Амины. Физические и химические свойства Массовая доля вещества в растворе. Урок химии. 8 класс
Массовая доля вещества в растворе. Урок химии. 8 класс Каучук. История открытия
Каучук. История открытия Types of chemical bonds in crystals
Types of chemical bonds in crystals Степень окисления. Подготовка к контрольной работе
Степень окисления. Подготовка к контрольной работе Химические свойства металлов
Химические свойства металлов Углеводы (сахариды)
Углеводы (сахариды) Изменения, происходящие с липидами в процессах технологической переработки сырья и параметры, характеризующие их
Изменения, происходящие с липидами в процессах технологической переработки сырья и параметры, характеризующие их Basis Sets and Pseudopotentials
Basis Sets and Pseudopotentials Ізомерія. Структурна ізомерія
Ізомерія. Структурна ізомерія Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату