Содержание
- 2. Получение металлов 1. Восстановление металлов из оксидов углем или угарным газом MеxOy + C = CO2
- 3. 3 Алюминотермия (восстановление более активным металлом) MеxOy + Al = Al2O3 + Me 4. Водородотермия -
- 4. 1) Щелочные и щелочноземельные металлы получают в промышленности электролизом расплавов солей (хлоридов): 2NaCl –расплав, электр. ток.
- 5. 2) Алюминий в промышленности получают в результате электролиза расплава оксида алюминия в криолите Na3AlF6 (из бокситов):
- 7. 1) Металлы реагируют с водой
- 8. Помните!!! Алюминий реагирует с водой подобно активным металлам, образуя основание (без оксидной пленки): 2Al + 6H2O
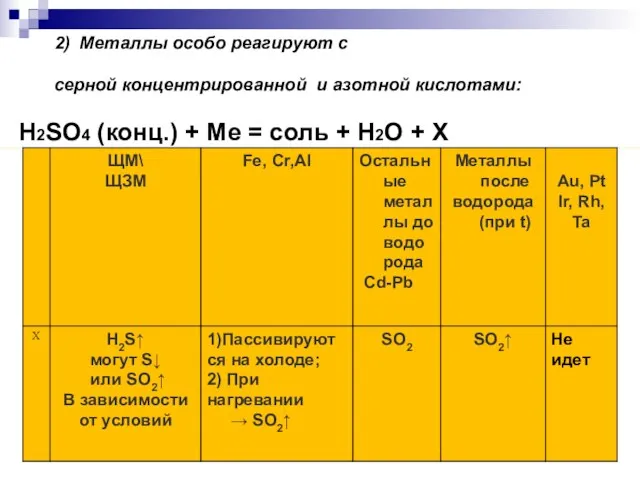
- 9. 2) Металлы особо реагируют с серной концентрированной и азотной кислотами: H2SO4 (конц.) + Me = соль
- 10. H2SO4 (разб) + Zn = ZnSO4 + H2↑ H2SO4 (разб) + Cu ≠ 2H2SO4 (конц.) +
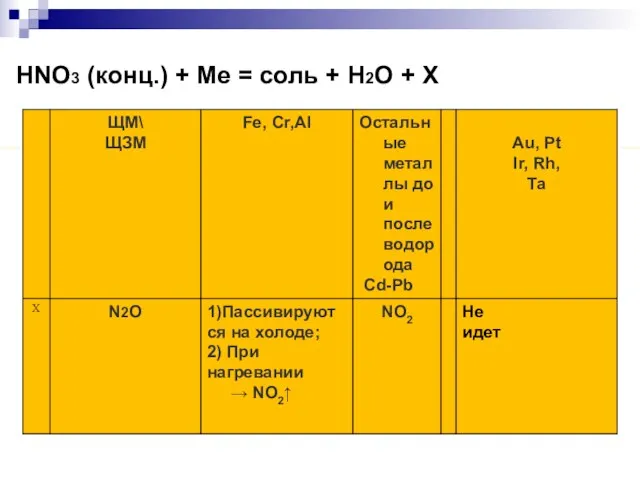
- 12. HNO3 (конц.) + Me = соль + H2O + Х H2SO4 (конц.) + Me = соль
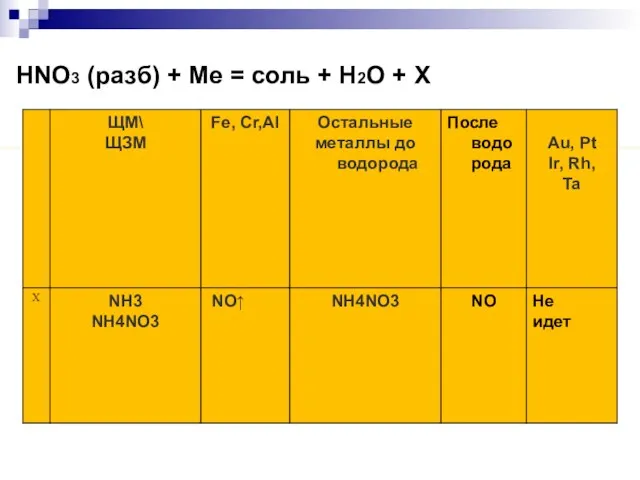
- 13. HNO3 (разб) + Me = соль + H2O + Х H2SO4 (конц.) + Me = соль
- 14. 4HNO3 (k) + Cu = Cu(NO3)2 + 4H2O + 2NO2↑ 8HNO3 (p) + 3Cu = 3Cu(NO3)2
- 15. 3) С растворами солей менее активных металлов Ме + Соль = Новый металл + Новая соль
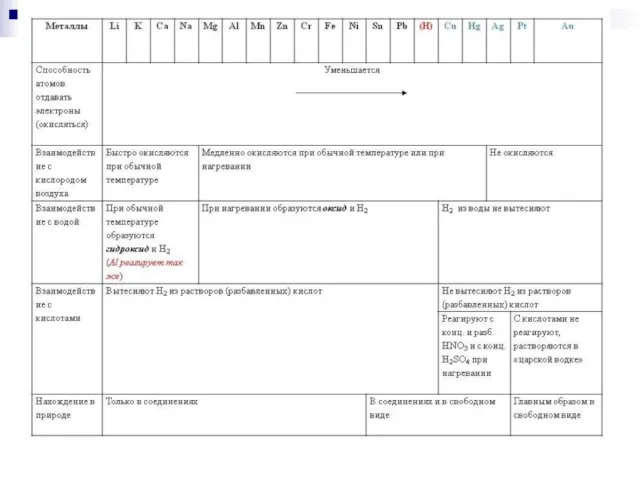
- 16. Активность металла в реакциях с кислотами, водными растворами солей и др. можно определить, используя электрохимический ряд,
- 17. от калия к золоту восстановительная способность (способность отдавать электроны) уменьшается, все металлы, стоящие в ряду левее
- 18. 4) С неметаллами образуются бинарные соединения: 2Li + Cl2 → 2LiCl (галогениды) 2Na + S →
- 19. ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ №1. Закончить уравнения практически осуществимых реакций, назвать продукты реакции Li+ H2O = Cu
- 21. Скачать презентацию














 Соединения галогенов
Соединения галогенов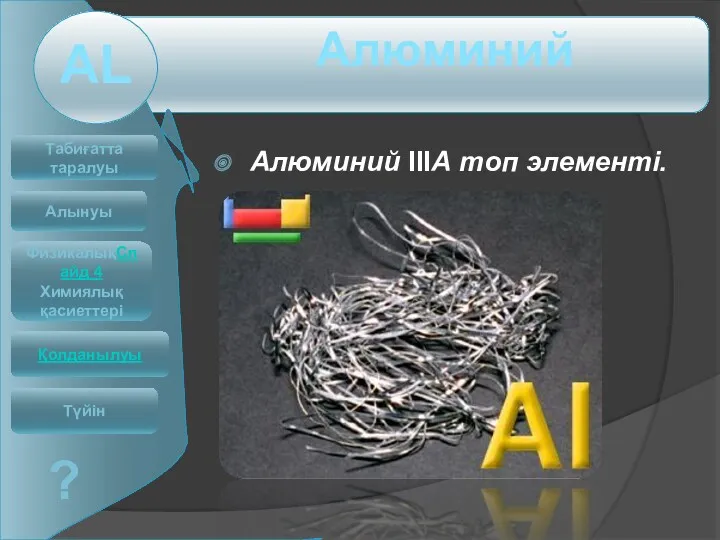 Алюминий IIIА топ элементі
Алюминий IIIА топ элементі О проекте концепции преподавания химии в РФ
О проекте концепции преподавания химии в РФ Типы химических реакций
Типы химических реакций Аналитическая химия. Количественный анализ (ч.1. титриметрия)
Аналитическая химия. Количественный анализ (ч.1. титриметрия) Кислоты. Удивительные факты
Кислоты. Удивительные факты Строение атомов. Понятие о квантовой механике
Строение атомов. Понятие о квантовой механике Производство серной кислоты
Производство серной кислоты Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Азот. Нахождение в природе
Азот. Нахождение в природе Волокнистое сырьё. Технологические и эксплуатационные свойства
Волокнистое сырьё. Технологические и эксплуатационные свойства Липиды (жиры)
Липиды (жиры) Процессы нитрозирования и основные реакции диазосоединений
Процессы нитрозирования и основные реакции диазосоединений Особливості горіння дисперсних систем
Особливості горіння дисперсних систем Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16)
Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16) Твердые вещества
Твердые вещества Хроматографические методы анализа
Хроматографические методы анализа Атомы и молекулы
Атомы и молекулы Высокомолекулярные соединения (синтетическое волокно капрон)
Высокомолекулярные соединения (синтетическое волокно капрон) CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі
CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі Откуда берутся кристаллы
Откуда берутся кристаллы Прості й складні речовини. Хімічні формули. Метали і неметали
Прості й складні речовини. Хімічні формули. Метали і неметали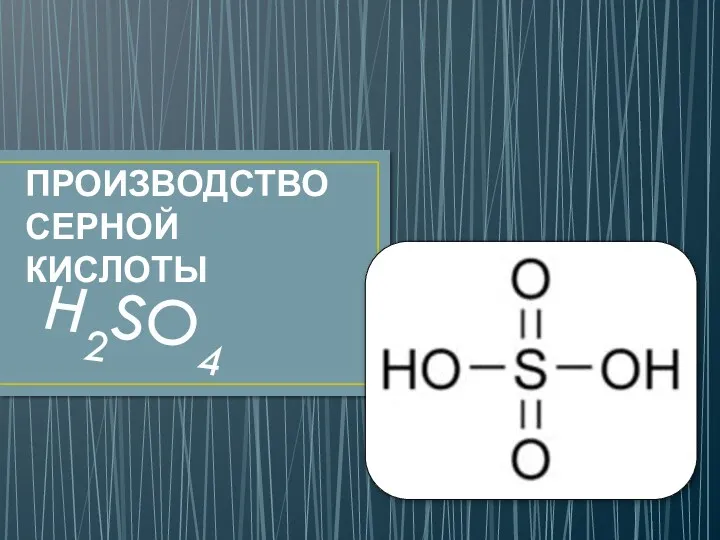 Производство серной кислоты
Производство серной кислоты Твердые тела
Твердые тела Углеводороды (классификация и номенклатура)
Углеводороды (классификация и номенклатура) Кислородсодержащие соединения серы. Оксиды серы
Кислородсодержащие соединения серы. Оксиды серы Химическая посуда
Химическая посуда Полиэтилен
Полиэтилен