Содержание
- 2. УДИВИТЕЛЬНЫЕ ФАКТЫ Ботаникам известно более восьмисот видов растений, вырабатывающих синильную кислоту и использующих ее как оружие
- 3. КИСЛОТЫ В НАШЕЙ ПИЩЕ Фрукты, овощи, молочные продукты, лекарства поставляют целый букет кислот: яблочную, щавелевую, лимонную,
- 4. КИСЛОТЫ В НАШЕЙ ЖИЗНИ Аскорбиновая, фолиевая, оротовая, пангамовая, никотиновая и другие кислоты являются витаминами. Аминокислоты, соединяясь
- 5. Если воспалительные процессы в желудке больного человека текут на фоне повышенной кислотности, раковых поражений, как правило,
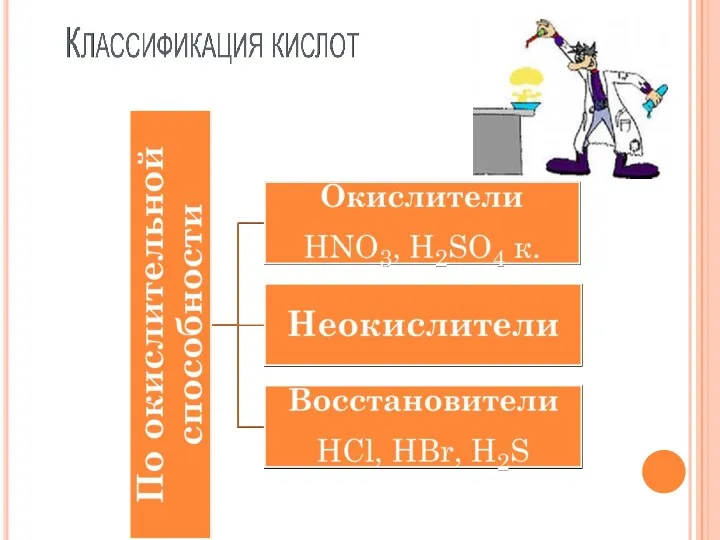
- 6. КЛАССИФИКАЦИЯ КИСЛОТ
- 7. СИЛА КИСЛОРОДОСОДЕРЖАЩИХ КИСЛОТ По периоду для кислородосодержащих кислот слева направо возрастает сила кислот. H2SiO3→H3PO4→ H2SO4→HClO4 Чем
- 8. СИЛА БЕСКИСЛОРОДНЫХ КИСЛОТ По периоду слева направо сила бескислородных кислот возрастает. H2S→HCl По группе cила бескислородных
- 9. 2) Какое из утверждений не верно? А) Основность кислоты определяется числом атомов водорода в молекуле; Б)
- 10. 4) Какая из перечисленных кислот способна к ступенчатой диссоциации А) хлорная б) бензойная в) азотистая г)
- 11. 5) Соотнесите: 6) Как изменяется сила кислот хлора в ряду HClO4 →HClO3 →HClO → HClO2
- 12. 7) Какая из кислот, формулы которых перечислены, имеет наибольшую константу диссоциации А) CH2Br COOH Б) CBr3
- 13. Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. http://files.school-collection.edu.ru/dlrstore/273e6145-6cc8-fe8a-376e-9765c4e8a054/index.htm ХИМИЧЕСКИЕ
- 14. 3. Взаимодействие кислот с основными оксидами. http://files.school-collection.edu.ru/dlrstore/52f55b81-2186-f7fb-e965-75186329579b/index.htm 4. Взаимодействие кислот с металлами http://files.school-collection.edu.ru/dlrstore/432f464f-1f22-5224-e016-91243ab1f09c/index.htm
- 15. 5. Взаимодействие с солями, если выпадает осадок или выделяется газ: http://www.youtube.com/watch?v=on8v5ORgl1k
- 16. http://www.youtube.com/watch?v=ic0ZS1zqn9Q 6. Взаимодействие кислот со спиртами
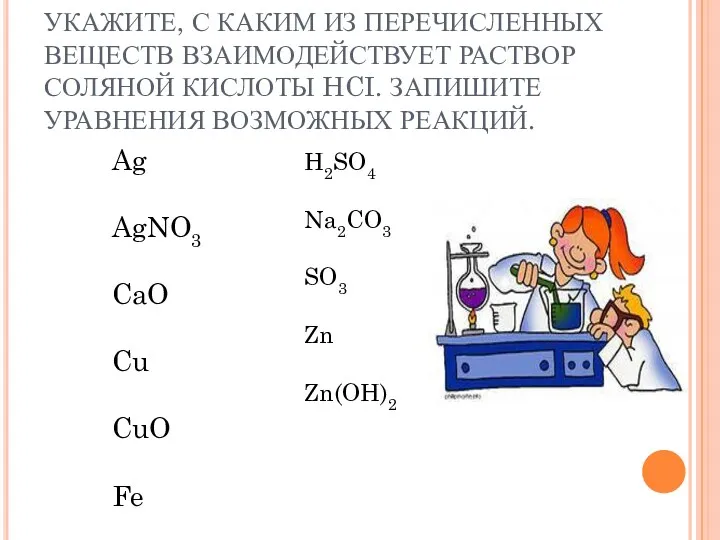
- 17. УКАЖИТЕ, С КАКИМ ИЗ ПЕРЕЧИСЛЕННЫХ ВЕЩЕСТВ ВЗАИМОДЕЙСТВУЕТ РАСТВОР СОЛЯНОЙ КИСЛОТЫ HCI. ЗАПИШИТЕ УРАВНЕНИЯ ВОЗМОЖНЫХ РЕАКЦИЙ. Ag
- 18. Ag CI2 CO2 C6H5OH Fe2O3 CH3OH KOH УКАЖИТЕ, С КАКИМИ ИЗ ПЕРЕЧИСЛЕННЫХ ВЕЩЕСТВ РЕАГИРУЕТ РАСТВОР УКСУСНОЙ
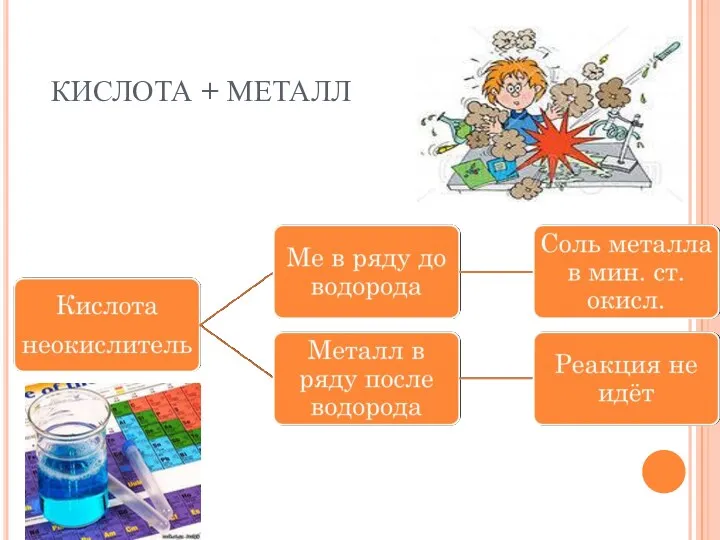
- 20. КИСЛОТА + МЕТАЛЛ
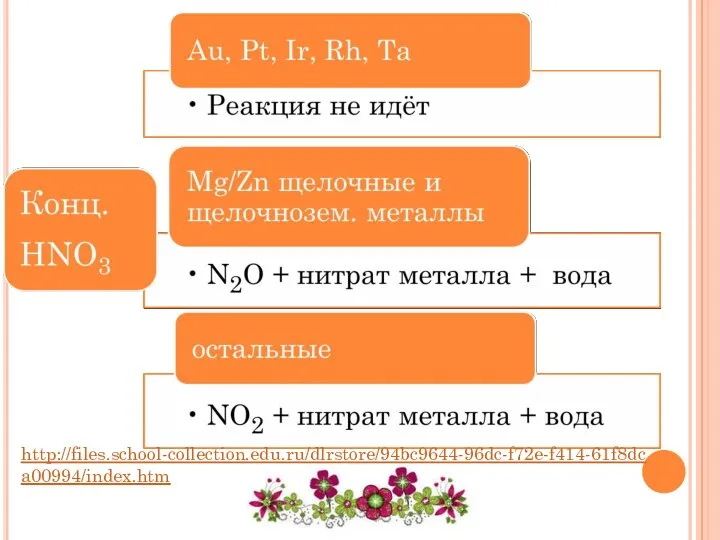
- 22. http://files.school-collection.edu.ru/dlrstore/94bc9644-96dc-f72e-f414-61f8dca00994/index.htm
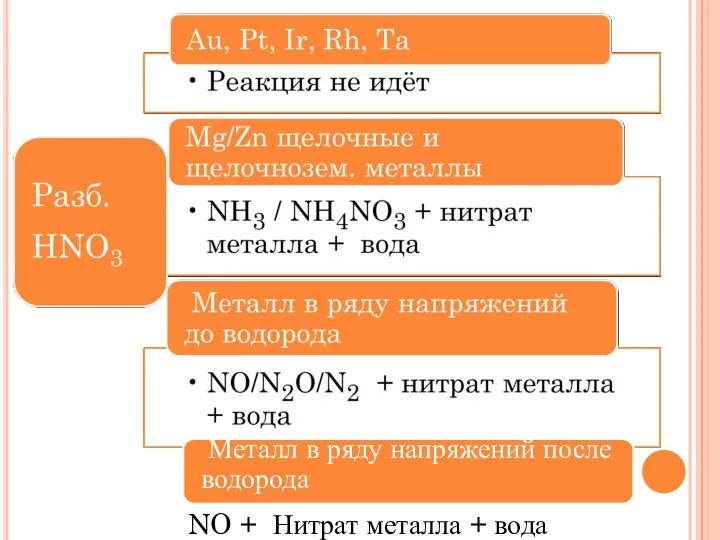
- 23. NO + Нитрат металла + вода
- 24. Допишите схемы уравнений реакций, расставьте коэффициенты а) Zn + HCl→ б) HBr + Al → в)
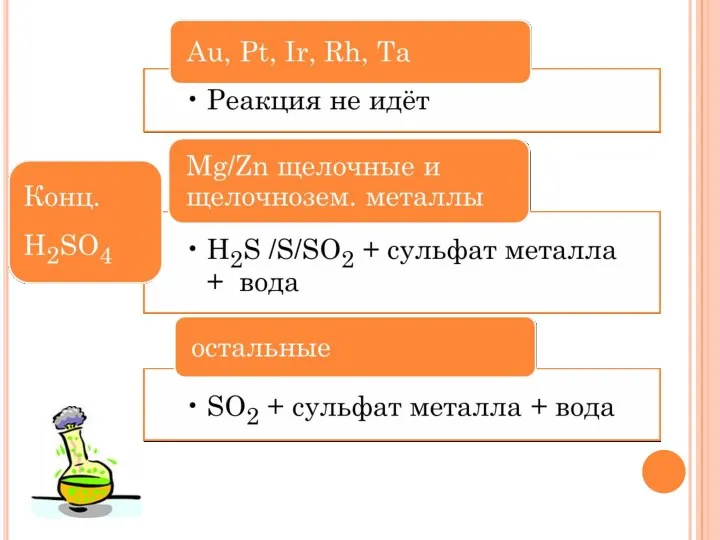
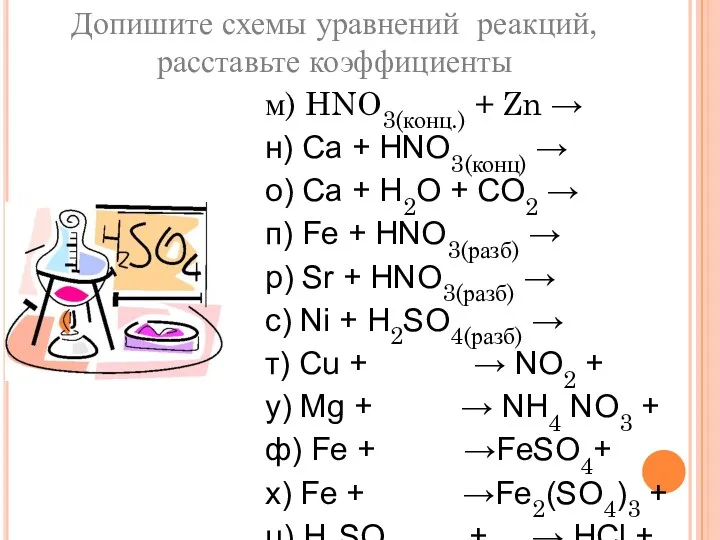
- 25. Допишите схемы уравнений реакций, расставьте коэффициенты м) HNO3(конц.) + Zn → н) Ca + HNO3(конц) →
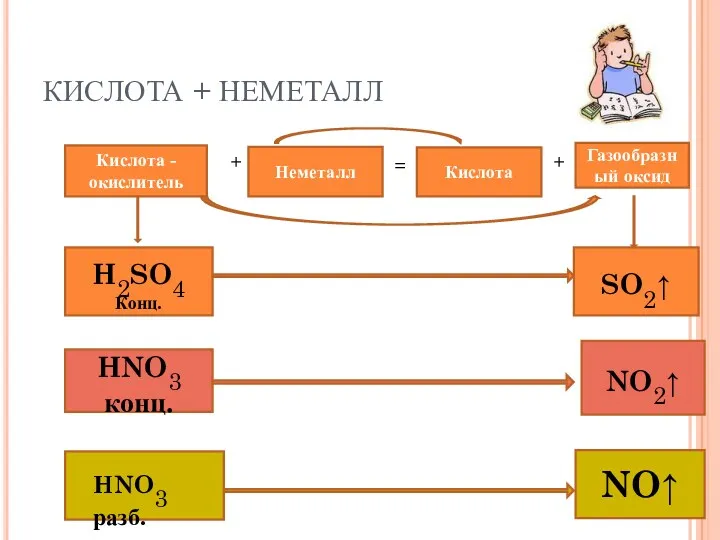
- 26. КИСЛОТА + НЕМЕТАЛЛ Кислота - окислитель + Неметалл = Кислота + Газообразный оксид H2SO4 Конц. SO2↑
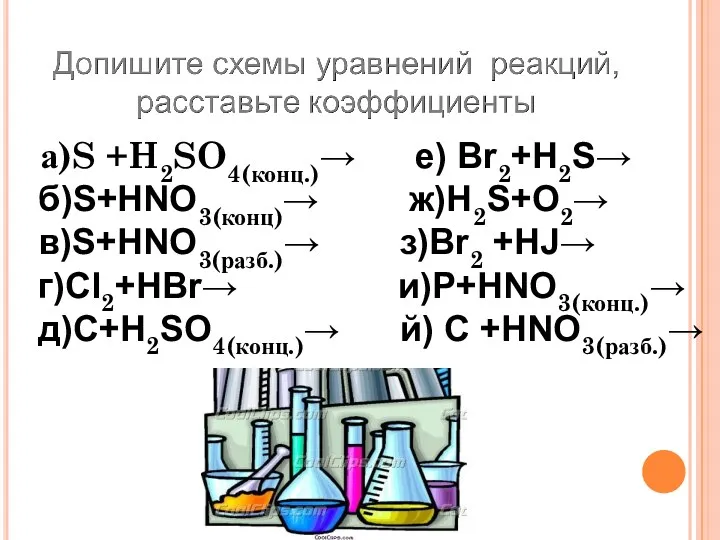
- 27. а)S +H2SO4(конц.)→ е) Br2+H2S→ б)S+HNO3(конц)→ ж)H2S+O2→ в)S+HNO3(разб.)→ з)Br2 +HJ→ г)Cl2+HBr→ и)P+HNO3(конц.)→ д)C+H2SO4(конц.)→ й) C +HNO3(разб.)→
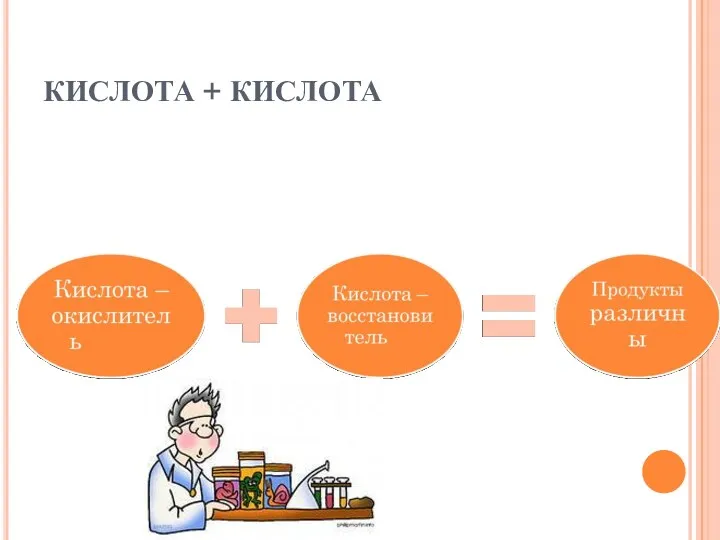
- 28. КИСЛОТА + КИСЛОТА
- 30. Скачать презентацию

















 Щелочные металлы IА группы. Литий
Щелочные металлы IА группы. Литий Эфирные масла
Эфирные масла Проект установки каталитического риформинга мощностью 1200 тыс. тонн
Проект установки каталитического риформинга мощностью 1200 тыс. тонн Хімічні властивості алканів
Хімічні властивості алканів Периодическая система химических элементов Д.И. Менделеева. Игра
Периодическая система химических элементов Д.И. Менделеева. Игра Аминокислоты N H2 – C H – C O O H
Аминокислоты N H2 – C H – C O O H Окислительновосстановительные реакции (ОВР)
Окислительновосстановительные реакции (ОВР) Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Азотсодержащие соединения. Амины. Аминокислоты
Азотсодержащие соединения. Амины. Аминокислоты Методы окислительно-восстановительного и комплексонометри-ческого титрования
Методы окислительно-восстановительного и комплексонометри-ческого титрования Коррозия металлов
Коррозия металлов Chem reactions. Different Typesof Chemical Reactions
Chem reactions. Different Typesof Chemical Reactions Анализ качества неорганических лекарственных средств количественно определяемых методами редоксиметрии
Анализ качества неорганических лекарственных средств количественно определяемых методами редоксиметрии Минеральные удобрения
Минеральные удобрения Физические свойства карбоновых кислот. Общие химические свойства неорганических и органических кислот. 10 класс
Физические свойства карбоновых кислот. Общие химические свойства неорганических и органических кислот. 10 класс Основные химические понятия
Основные химические понятия Термохимия. Термохимические уравнения
Термохимия. Термохимические уравнения Алкены. Гомологический ряд и изомерия
Алкены. Гомологический ряд и изомерия Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Комбинированные задачи. 11 класс
Комбинированные задачи. 11 класс Щелочные металлы
Щелочные металлы Органічні сполуки. Предмет органічної хімії
Органічні сполуки. Предмет органічної хімії Характеристика химического элемента по его положению в периодической системе элементов Д.И.Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д.И.Менделеева Основные особенности композитов по сравнению с традиционными материалами
Основные особенности композитов по сравнению с традиционными материалами Исследование снежного покрова
Исследование снежного покрова Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Основи. Фізичні властивості основ
Основи. Фізичні властивості основ Растворимость, ее зависимость от разных факторов. Насыщенные и ненасыщенные растворы. Физико-химическая сущность растворения
Растворимость, ее зависимость от разных факторов. Насыщенные и ненасыщенные растворы. Физико-химическая сущность растворения