Содержание
- 2. Расположение в периодической системе Особенности строения атома Физические свойства Химические свойства Открытие Получение Na+ и K+
- 3. ОСОБЕННОСТИ СТРОЕНИЯ АТОМА
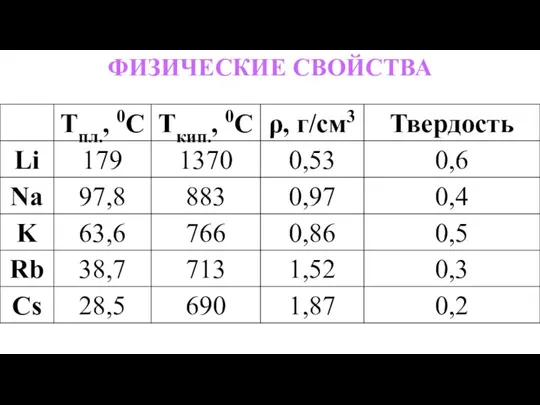
- 4. ФИЗИЧЕСКИЕ СВОЙСТВА
- 5. ХИМИЧЕСКИЕ СВОЙСТВА I. Реакции с неметаллами 1. Взаимодействие с галогенами: 2Na + Cl2 → 2NaCl 2.
- 6. 2K + 2O2 → K2O4 надпероксид K 6K + K2O4 → 4K2O оксид K 3. Взаимодействие
- 7. II. Реакции со сложными веществами 1. Взаимодействие с водой: 2Na + 2H2O → 2NaOH + H2↑
- 8. КАЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ Для распознавания соединений щелочных металлов по окраске пламени исследуемое вещество вносится в
- 11. ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ В 1807 г. в Англии Г. Деви открыл натрий и калий В 1817г.
- 13. Скачать презентацию









 Классификация удобрений
Классификация удобрений Минерал хромдиопсид. Месторождения
Минерал хромдиопсид. Месторождения Алкины. Гомологический ряд алкинов
Алкины. Гомологический ряд алкинов Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Спирти
Спирти Ионные уравнения
Ионные уравнения Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Взрывчатые вещества, их история и применение
Взрывчатые вещества, их история и применение Функціональні матеріали для високоенергетичної електроніки. (Лекція 2)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 2) Хімічні властивості металів
Хімічні властивості металів Железо и его соединения
Железо и его соединения Фізичні та хімічні явища (гра)
Фізичні та хімічні явища (гра) Минералы и горные породы
Минералы и горные породы Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты
Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты Переохлажденные жидкости и их применение. Процесс кристаллизации
Переохлажденные жидкости и их применение. Процесс кристаллизации Валентность химических элементов
Валентность химических элементов Теория сплавов
Теория сплавов Хром. Свойства
Хром. Свойства Приготовление растворов солей с определенной массовой долей растворенного вещества
Приготовление растворов солей с определенной массовой долей растворенного вещества Элементы термодинамики. Кинетика химических реакций
Элементы термодинамики. Кинетика химических реакций Водород. Общая характеристика, нахождение в природе. Получение и физические свойства
Водород. Общая характеристика, нахождение в природе. Получение и физические свойства Галогены. Получение и применение галогенов
Галогены. Получение и применение галогенов Нефть и способы её переработки
Нефть и способы её переработки Действующие вещества. Лексикон
Действующие вещества. Лексикон Реакції йонного обміну між електролітами у водних розчинах
Реакції йонного обміну між електролітами у водних розчинах Алканы.Определение. Общая формула класса углеводородов
Алканы.Определение. Общая формула класса углеводородов Способы выражения состава раствора. Задача 7
Способы выражения состава раствора. Задача 7