Содержание
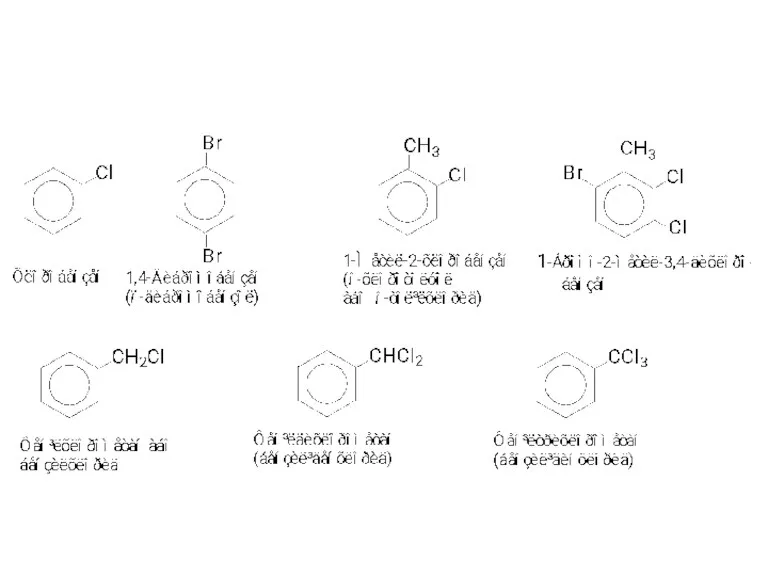
- 3. МЕТОДИ ОДЕРЖАННЯ Існують три основних способи одержання галогенопохідних ароматич-них вуглеводнів: 1 - заміщення атома водню на
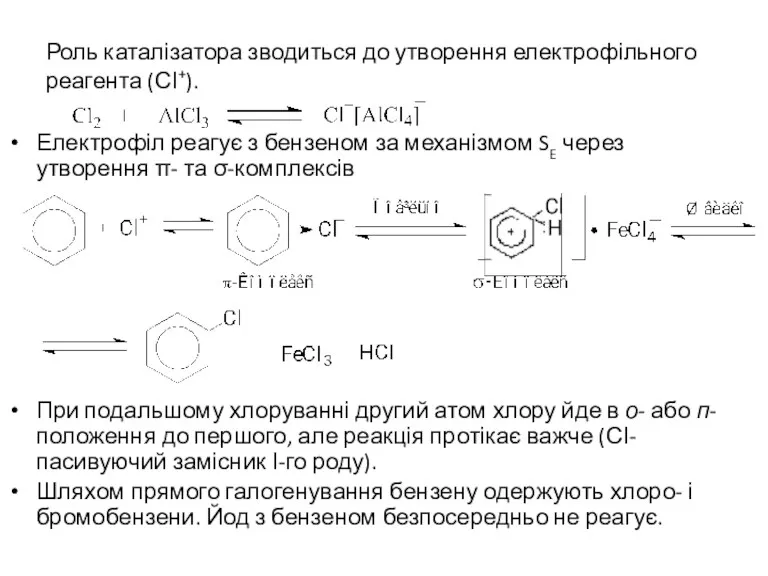
- 4. Роль каталізатора зводиться до утворення електрофільного реагента (СІ+). Електрофіл реагує з бензеном за механізмом SE через
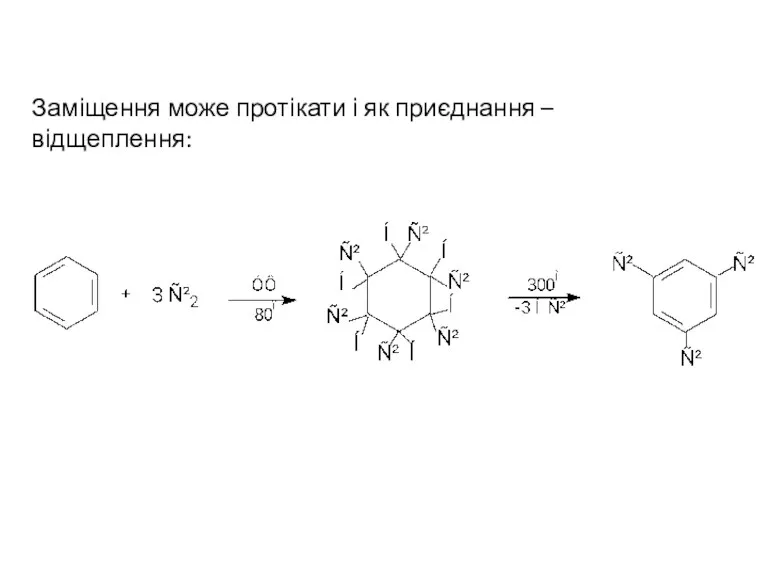
- 5. Заміщення може протікати і як приєднання – відщеплення:
- 6. 2. Заміщення атома водню на атом галогену в бічному ланцюзі Галогенування бічного ланцюга аренів протікає за
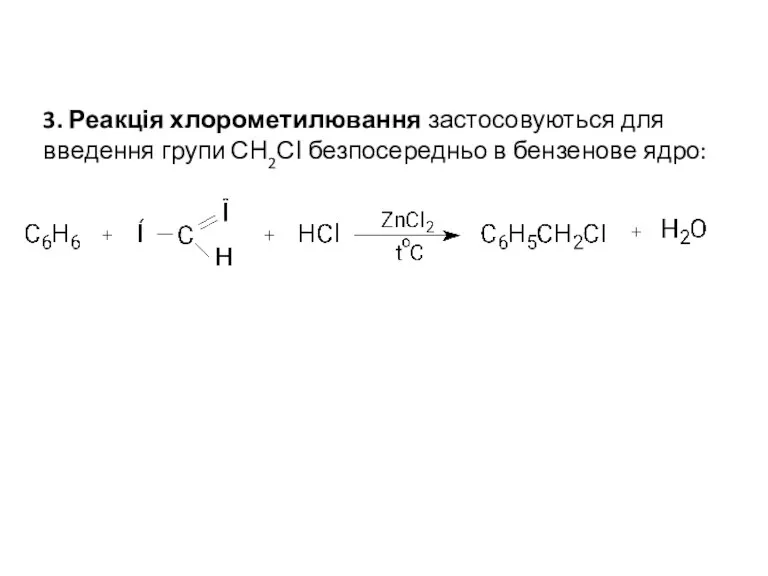
- 7. 3. Реакція хлорометилювання застосовуються для введення групи СН2СІ безпосередньо в бензенове ядро:
- 8. хімічні властивості Величини дипольних моментів у них менші, ніж у подібних галогеналканів. Це свідчить про меншу
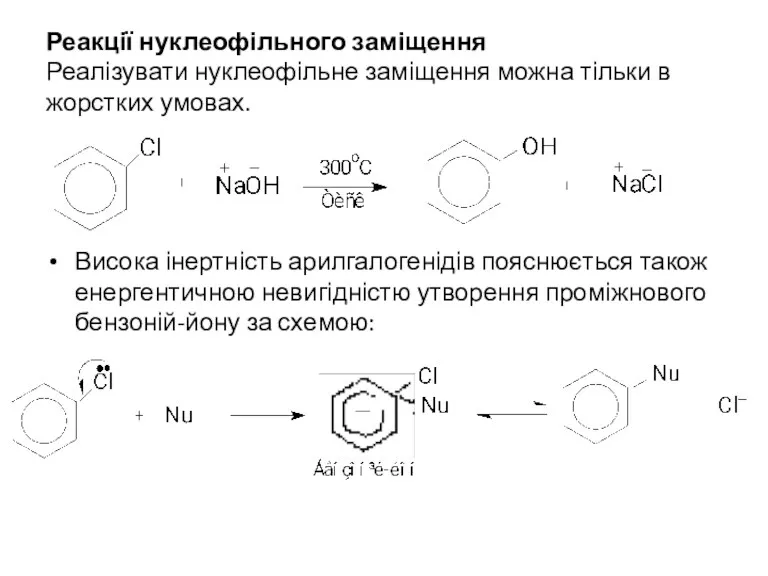
- 9. Реакції нуклеофільного заміщення Реалізувати нуклеофільне заміщення можна тільки в жорстких умовах. Висока інертність арилгалогенідів пояснюється також
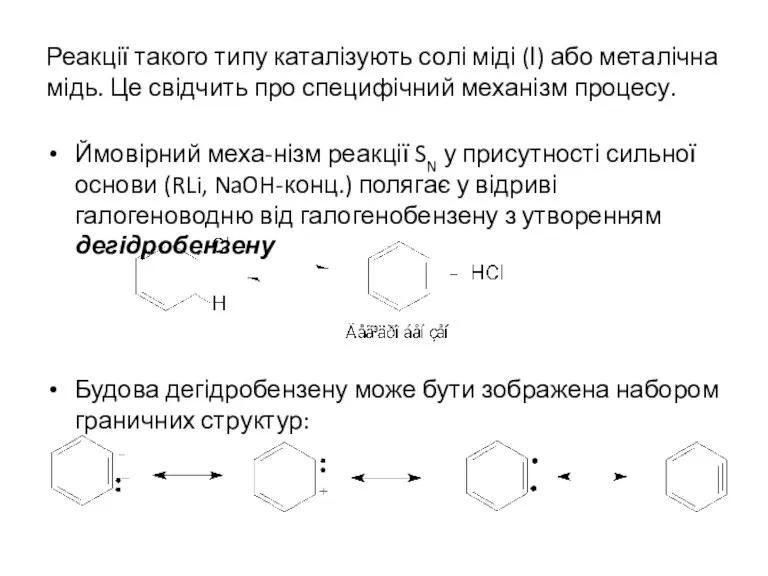
- 10. Реакції такого типу каталізують солі міді (І) або металічна мідь. Це свідчить про специфічний механізм процесу.
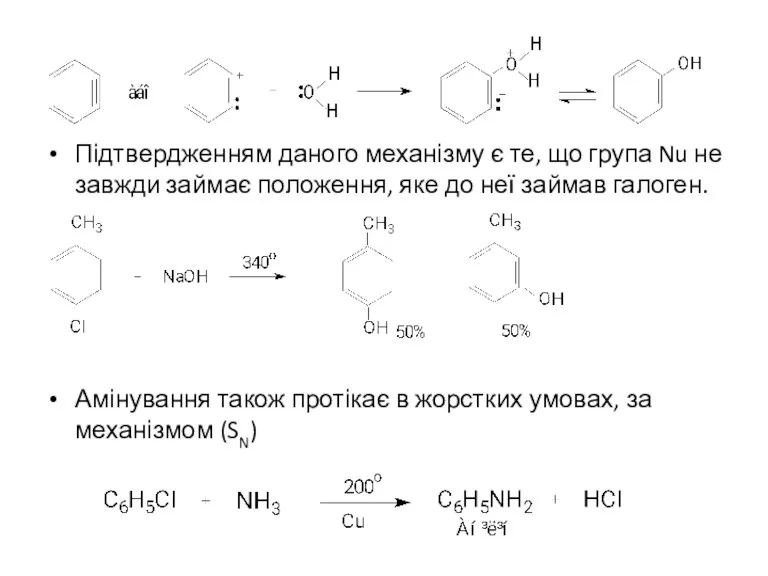
- 11. Підтвердженням даного механізму є те, що група Nu не завжди займає положення, яке до неї займав
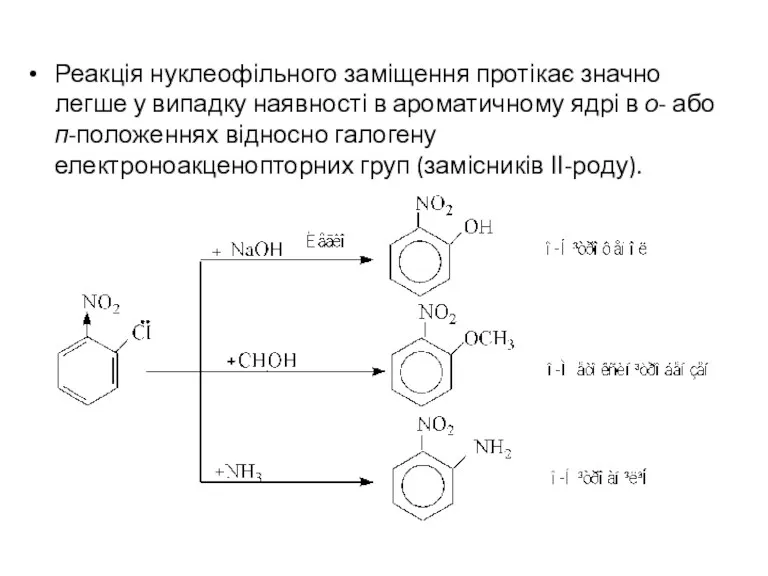
- 12. Реакція нуклеофільного заміщення протікає значно легше у випадку наявності в ароматичному ядрі в о- або п-положеннях
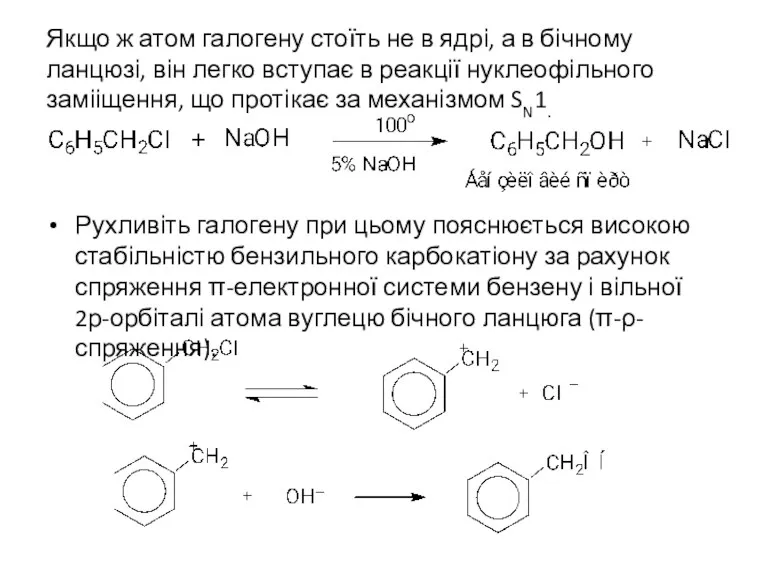
- 13. Якщо ж атом галогену стоїть не в ядрі, а в бічному ланцюзі, він легко вступає в
- 15. Скачать презентацию



 Расчет процесса горения: состав горючей системы и расчет количества воздуха, необходимого для горения
Расчет процесса горения: состав горючей системы и расчет количества воздуха, необходимого для горения Физические свойства минералов
Физические свойства минералов Химия элементов VA группы (пниктогены или пникти́ды)
Химия элементов VA группы (пниктогены или пникти́ды) Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5) Алкалоиды
Алкалоиды Механизмы трансформации энергии в фотосинтезе
Механизмы трансформации энергии в фотосинтезе Электрохимическая коррозия металлов
Электрохимическая коррозия металлов Цікаві історичні факти з походження назв хімічних елементів
Цікаві історичні факти з походження назв хімічних елементів Серная кислота. ОХТ, лекция №7
Серная кислота. ОХТ, лекция №7 Оксиды. Формулы оксидов ( 8 класс)
Оксиды. Формулы оксидов ( 8 класс) Группа галогенов в периодической системе
Группа галогенов в периодической системе Химические уравнения Закон сохранения массы веществ
Химические уравнения Закон сохранения массы веществ Решение задач. Способы выражения состава раствора
Решение задач. Способы выражения состава раствора Общая характеристика элементов V-А-группы. Азот
Общая характеристика элементов V-А-группы. Азот Сероводород. Сульфиды
Сероводород. Сульфиды Качественные реакции на органические вещества
Качественные реакции на органические вещества Карбон
Карбон Медь, графит, алмаз
Медь, графит, алмаз Водород. Нахождение в природе. Физические и химические свойства. Применение
Водород. Нахождение в природе. Физические и химические свойства. Применение Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды Сернистый газ. Сернистая кислота и её соли
Сернистый газ. Сернистая кислота и её соли Электрохимические процессы
Электрохимические процессы Ионные уравнения. Реакции ионного обмена
Ионные уравнения. Реакции ионного обмена Химия и живопись
Химия и живопись Обмен липидов
Обмен липидов Реакции ионного обмена
Реакции ионного обмена Азот
Азот Алюминий и его соединения. Строение атома
Алюминий и его соединения. Строение атома