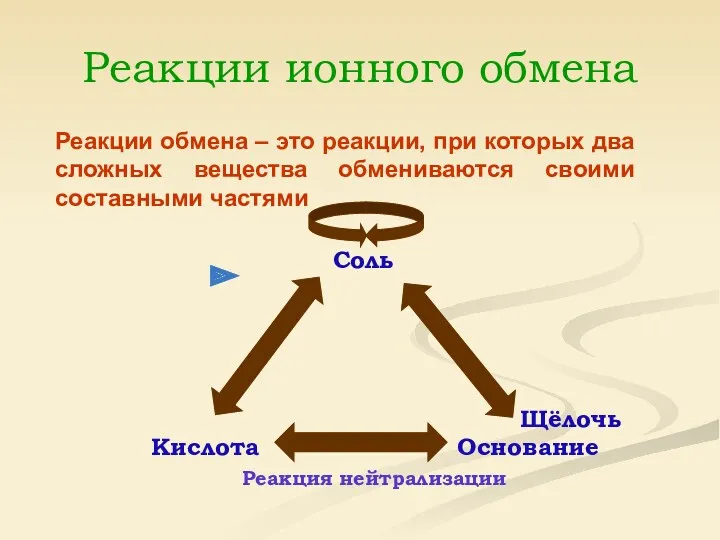
Алгоритм составления ионных уравнений.
3. Исключите из обеих частей уравнения одинаковые
ионы и запишите
оставшиеся в сокращенное ионное уравнение.
1. Запишите молекулярное уравнение. Расставьте коэффициенты.
Определите по таблице растворимости электролиты.
Укажите осадки, газы.
2NaOH+H2SO4 =
Na2SO4+2H2O
2. Запишите электролиты в виде ионов с учётом коэффициентов и индексов, а уходящие из сферы реакции - в виде молекул.
2Na++2OH-+2H++SO42- = 2Na++SO42-+2H2O
2OH-+2H+=2H2O
OH-+H+=H2O
Данная реакция взаимодействия кислоты с основанием
называется реакцией нейтрализации.




 Поліметилметакрилат
Поліметилметакрилат Криминалистическое исследование нефтепродуктов, горючесмазочных материалов, спиртосодержащих жидкостей,
Криминалистическое исследование нефтепродуктов, горючесмазочных материалов, спиртосодержащих жидкостей, Методы хроматографии. Ионообменная хроматография
Методы хроматографии. Ионообменная хроматография Органическая химия. Жиры
Органическая химия. Жиры Неметаллы. Занятие 20
Неметаллы. Занятие 20 Кристаллические решетки
Кристаллические решетки Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Растворение. Растворимость веществ в воде. Классификация растворов
Растворение. Растворимость веществ в воде. Классификация растворов Аналитические химические реакции. Классификация аналитических химических реакций
Аналитические химические реакции. Классификация аналитических химических реакций Электролитическая диссоциация
Электролитическая диссоциация Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Матеріали на основі аерогелів: класифікація, підходи до синтезу та сфери застосування
Матеріали на основі аерогелів: класифікація, підходи до синтезу та сфери застосування Неметаллы: общая характеристика
Неметаллы: общая характеристика Макромолекулалардың молекулалық массасы және молекулалық массалық таралу функциялары
Макромолекулалардың молекулалық массасы және молекулалық массалық таралу функциялары Каучук и резина
Каучук и резина Сплави алюмінію. Характеристики та застосування
Сплави алюмінію. Характеристики та застосування Подготовка к ВПР по химии. 8 класс
Подготовка к ВПР по химии. 8 класс Циклические алифатические углеводороды
Циклические алифатические углеводороды Мыло. Синтетические моющие средства
Мыло. Синтетические моющие средства Химические реакции или химические явления
Химические реакции или химические явления Экспериментальное решение задач по теме: Классы неорганических соединений
Экспериментальное решение задач по теме: Классы неорганических соединений Основные классы неорганических веществ. Соединения химических элементов
Основные классы неорганических веществ. Соединения химических элементов Бензин. Производство бензина
Бензин. Производство бензина Элементы химической термодинамики
Элементы химической термодинамики Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа
Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Механизмы органических реакций
Механизмы органических реакций