Содержание
- 2. Мета уроку: познайомитися з ароматичними вуглеводнями, особливостями будови ароматичного зв’язку, фізичними і хімічними властивостями бензену та
- 3. Ароматичні вуглеводні – це сполуки Карбону та Гідрогену в молекулах яких є бензольне кільце. Загальна формула
- 4. Історія відкриття бензену Вперше бензен описав німецький хімік Іоганн Глаубер у 1649 р. Він отримав бензен
- 5. У 1833-1835 рр.. німецький хімік Е. Митчерлих досліджував цю речовину, визначив його формулу С6Н6 і назвав
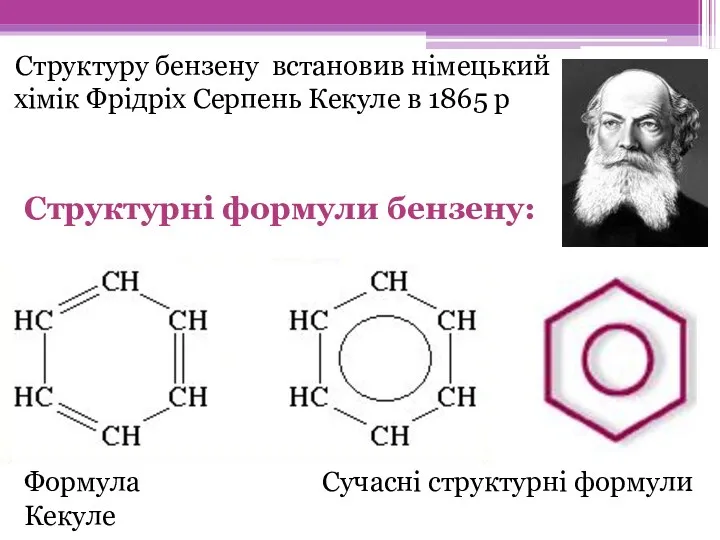
- 6. Структуру бензену встановив німецький хімік Фрідріх Серпень Кекуле в 1865 р Формула Кекуле Сучасні структурні формули
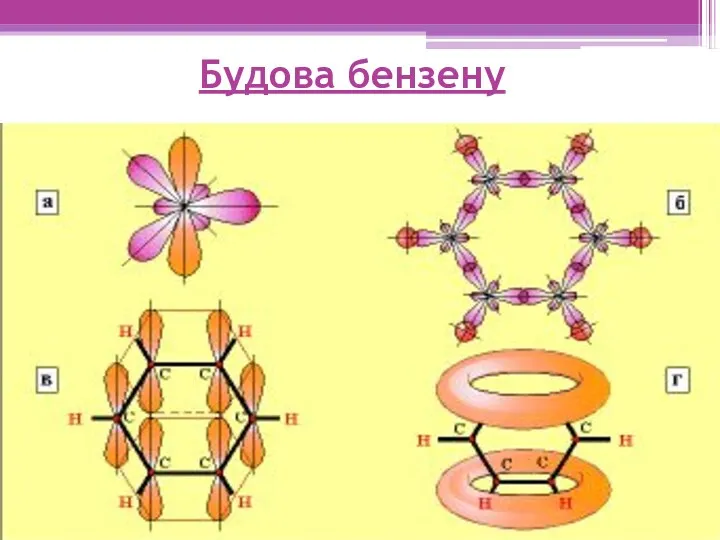
- 7. Будова бензену
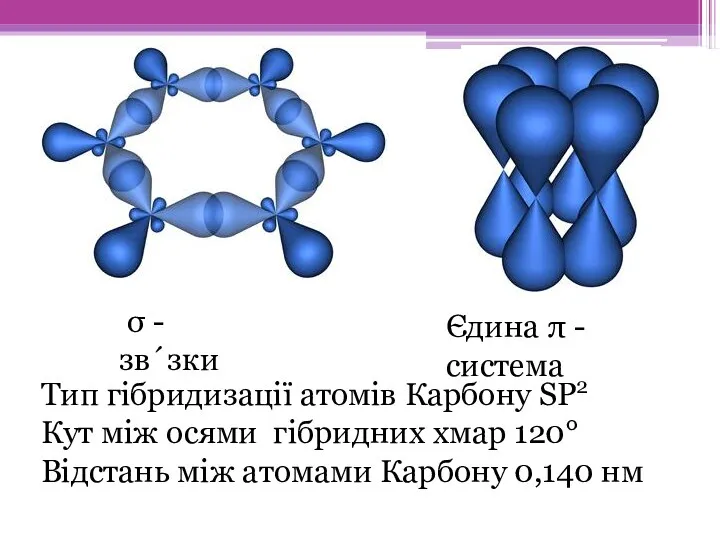
- 8. Тип гібридизації атомів Карбону SP2 Кут між осями гібридних хмар 120° Відстань між атомами Карбону 0,140
- 9. Фізичні властивості бензену. 1. Безбарвна рідина. 2. Із характерним запахом. 3. tпл = 5,5°С; tкип =
- 10. Це цікаво! Дослідження смолеподібної речовини, отриманої з тютюнового диму показали, що в ній містяться, крім нікотину,
- 11. Хімічні властивості бензену.
- 12. І. Реакції окиснення: Горіння (Горить бензен яскраво-червоним кіптявим полум’ям) . (запишіть рівняння реакції)
- 13. 2) Розчин перманганату калію не знебарвлюється, тобто бензен стійкий до дії окисників.
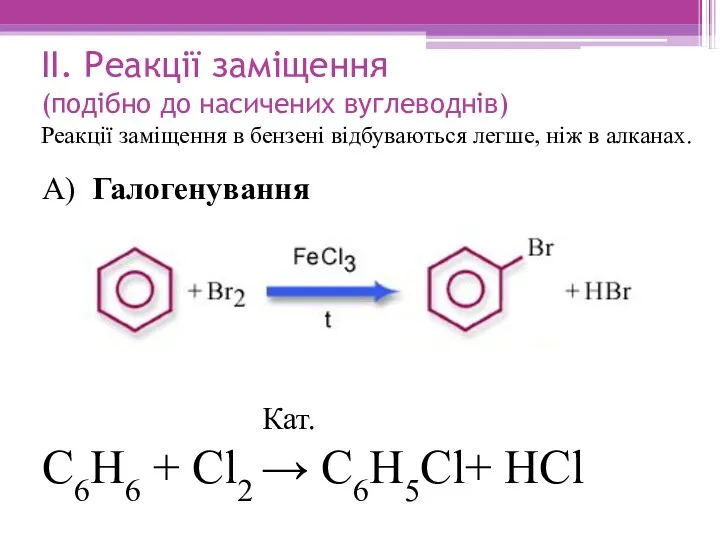
- 14. ІІ. Реакції заміщення (подібно до насичених вуглеводнів) Реакції заміщення в бензені відбуваються легше, ніж в алканах.
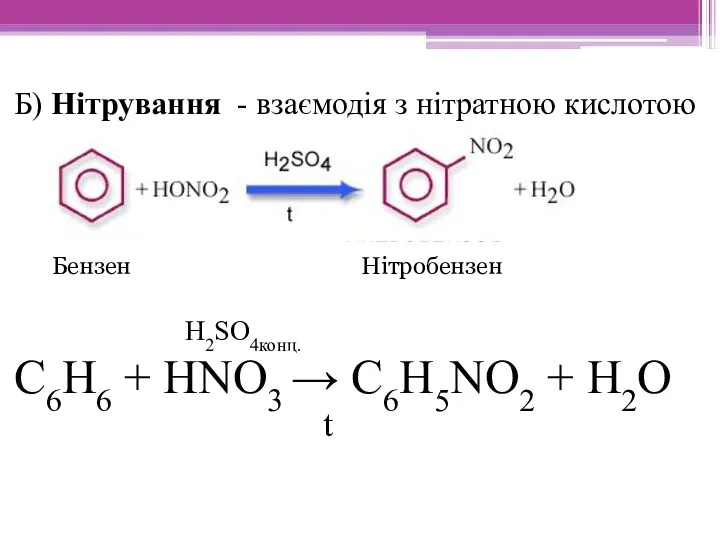
- 15. Б) Нітрування - взаємодія з нітратною кислотою H2SO4конц. С6Н6 + HNO3 → С6Н5NO2 + Н2O t
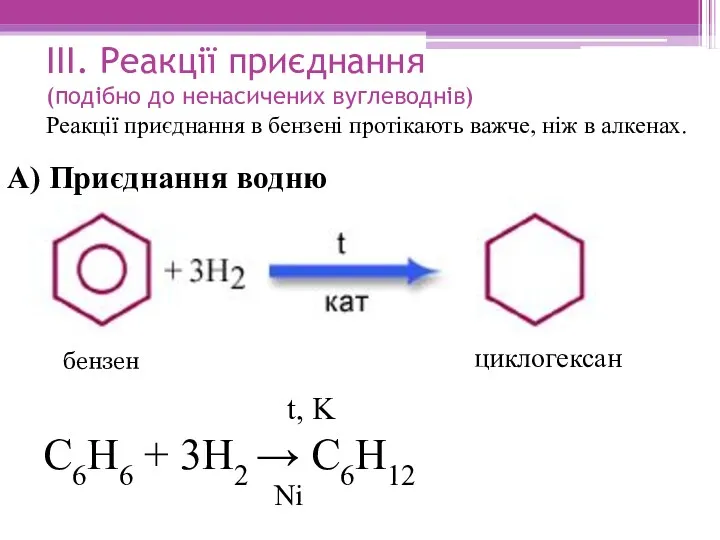
- 16. ІІІ. Реакції приєднання (подібно до ненасичених вуглеводнів) Реакції приєднання в бензені протікають важче, ніж в алкенах.
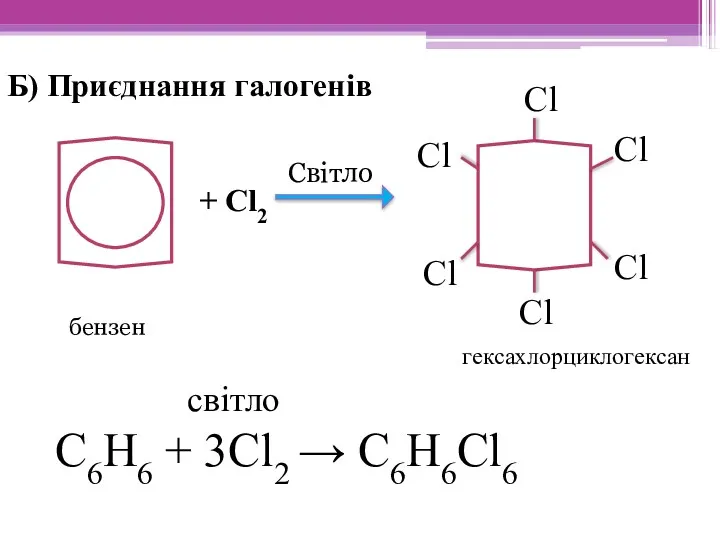
- 17. Б) Приєднання галогенів + Сl2 світло С6Н6 + 3Сl2 → С6Н6Cl6 Cl Cl Cl Cl Cl
- 18. Незважаючи на високу ненасиченість молекули бензену (за складом), він не дає характерних, якісних реакцій для ненасичених
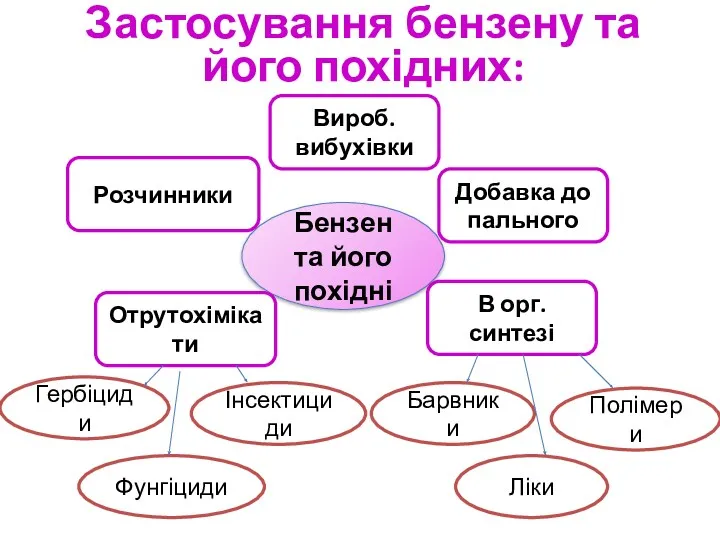
- 19. Бензен та його похідні Розчинники В орг. синтезі Отрутохімікати Добавка до пального Вироб. вибухівки Фунгіциди Інсектициди
- 20. Розв’яжіть задачі 1. Визначити молекулярну формулу вуглеводню, густина його за воднем становить 39. Масова частка Карбону
- 22. Скачать презентацию










 Характеристика химических элементов и химических реакций
Характеристика химических элементов и химических реакций СОЕДИНЕНИЯ ХРОМА
СОЕДИНЕНИЯ ХРОМА Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу
Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу Алкины. Тема 4
Алкины. Тема 4 Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины)
Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины) Закономерности изменения химических свойств элементов и их соединений. Лекция 2. Индустрия красоты
Закономерности изменения химических свойств элементов и их соединений. Лекция 2. Индустрия красоты Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл
Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл Оксиды, их классификация и свойства
Оксиды, их классификация и свойства Изотопы, их свойства и применение
Изотопы, их свойства и применение Равновесия в растворах электролитов
Равновесия в растворах электролитов Аминокислоты. Белки
Аминокислоты. Белки Энергетический обмен
Энергетический обмен Закон действующих масс и его применение в аналитической химии
Закон действующих масс и его применение в аналитической химии Химическое равновесие в газах и растворах
Химическое равновесие в газах и растворах Соли-электролиты
Соли-электролиты Железо, его физические и химические свойства. Урок химии в 9 классе
Железо, его физические и химические свойства. Урок химии в 9 классе Основания. Названия оснований
Основания. Названия оснований Трансмиссионные масла
Трансмиссионные масла Оценка химической обстановки при авариях на химически опасных объектах
Оценка химической обстановки при авариях на химически опасных объектах Оксигеновмісні сполуки. Одноатомні та багатоатомні спирти. Феноли. Лекція №6
Оксигеновмісні сполуки. Одноатомні та багатоатомні спирти. Феноли. Лекція №6 Метаморфические породы. (Лекция 10)
Метаморфические породы. (Лекция 10) Классификация химических реакций
Классификация химических реакций Топливный элемент
Топливный элемент Свойства растворов и гетерогенных систем
Свойства растворов и гетерогенных систем Виведення формул органічних сполук за масовими частками елементів
Виведення формул органічних сполук за масовими частками елементів Все о чае
Все о чае Введение в геохимию
Введение в геохимию Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник