Содержание
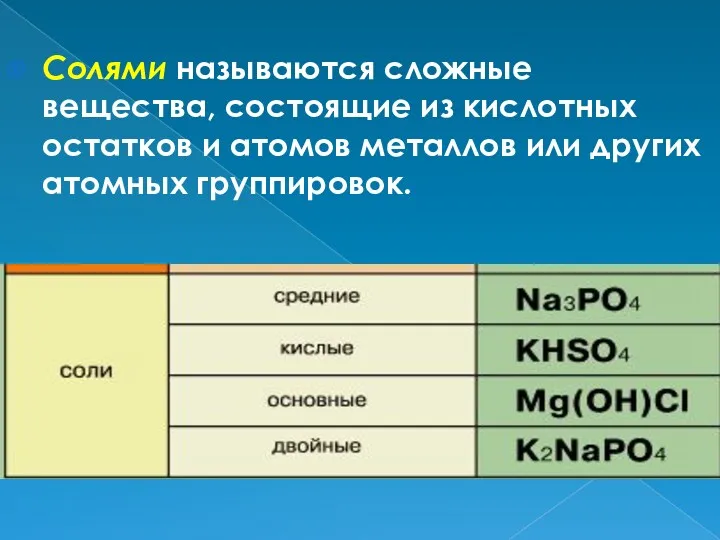
- 2. Солями называются сложные вещества, состоящие из кислотных остатков и атомов металлов или других атомных группировок.
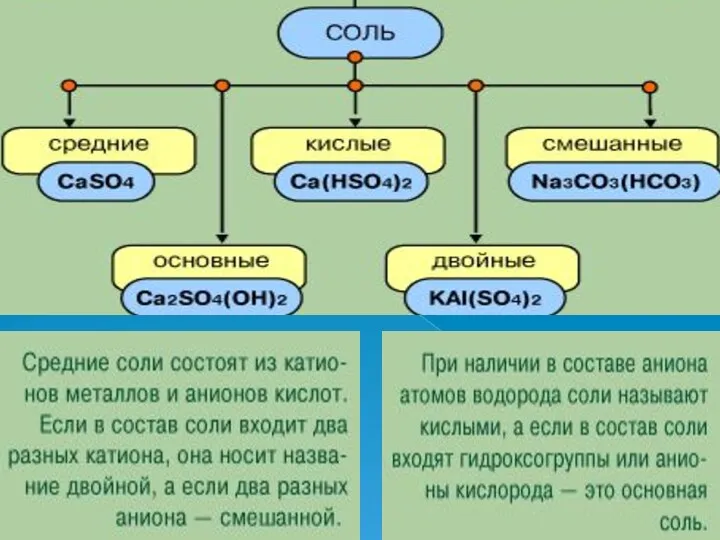
- 4. Если происходит полная нейтрализация, то образуется средняя соль: 2Н3РО4 + 3Са(ОН)2 = Ca3(PO4)2 + 6Н2О Если
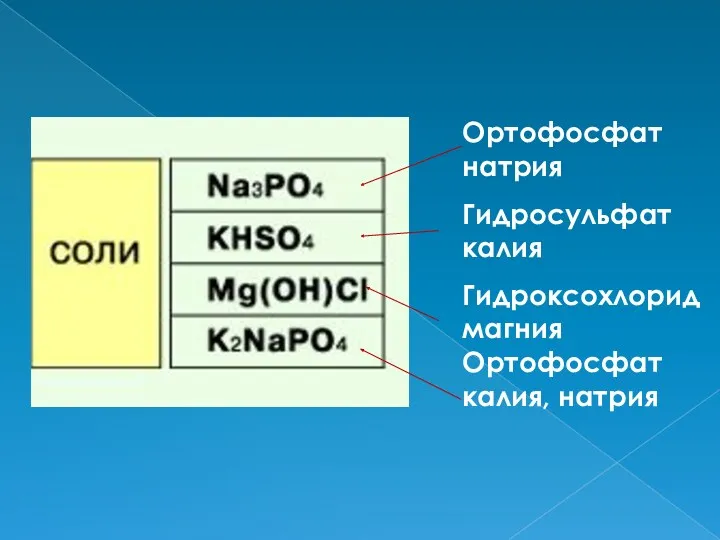
- 5. Ортофосфат натрия Гидросульфат калия Гидроксохлорид магния Ортофосфат калия, натрия
- 6. Физические свойства солей Соли имеют различный цвет. Соли являются твердыми веществами с самой различной растворимостью в
- 7. Медный купорос
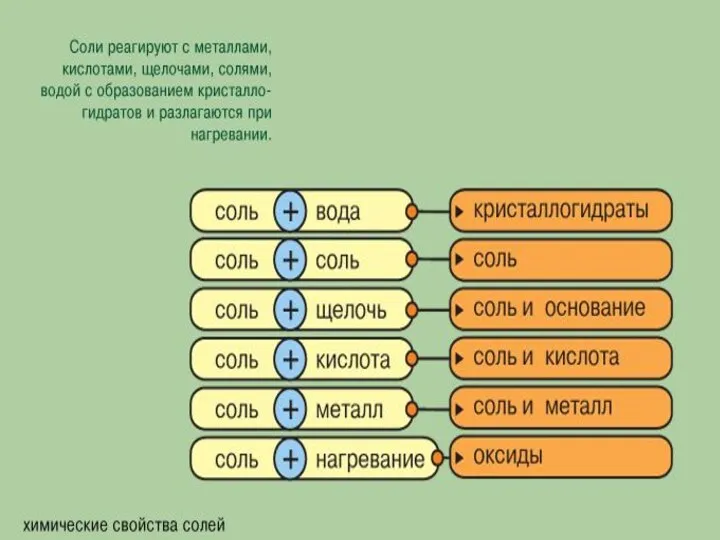
- 8. Химические свойства солей 1. Диссоциация. А) Как электролиты средние соли в водных растворах диссоциируют на катионы
- 10. 2. Ме1 + соль1 → Ме2 + соль2 Zn + CuSO4 = ZnSO4 + Cu↓ Zn0
- 11. 5. Соль1 + соль2 = соль3 + соль4 KCl + AgNO3 = AgCl↓ + KNO3 Ag+
- 12. Способы получения солей 1. Ме + неМе = ? 2Na + Cl2 = 2NaCl 2. Ме
- 13. Способы получения солей 4. Кислота + соль = ? H2SO4 + BaCl2 = BaSO4 + 2HCl
- 14. 7. МехОу + кислота = ? H2SO4 + CaO = CaSO4 + H2O CaO + 2Н+
- 16. Скачать презентацию









 топ през
топ през Благородные металлы
Благородные металлы Полимеры, бумага
Полимеры, бумага Анализ раствора кальция хлорида 5%-200 мл
Анализ раствора кальция хлорида 5%-200 мл Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Магний и кальций
Магний и кальций Вода. 8 класс
Вода. 8 класс Гидролиз солей. Лекция №9
Гидролиз солей. Лекция №9 Кислородные соединения серы. 2 часть
Кислородные соединения серы. 2 часть Переходные элементы
Переходные элементы Деструктивные процессы переработки нефти
Деструктивные процессы переработки нефти Складання рівнянь окисно-відновних реакцій. Метод електронного балансу
Складання рівнянь окисно-відновних реакцій. Метод електронного балансу Законы химии
Законы химии Plastic is one of the challenges of the 21st century
Plastic is one of the challenges of the 21st century Методы определения механических свойств полимерных композиционных материалов
Методы определения механических свойств полимерных композиционных материалов Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение Энергетика химических процессов. Термодинамика. (Лекция 4)
Энергетика химических процессов. Термодинамика. (Лекция 4) Циклоалканы. 10 класс
Циклоалканы. 10 класс Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік
Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік Сера и ее соединения
Сера и ее соединения Термохимия. Расчет тепловых эффектов химических реакций
Термохимия. Расчет тепловых эффектов химических реакций Реакции SR в ряду алканов
Реакции SR в ряду алканов Классификация химических реакций. 8 класс
Классификация химических реакций. 8 класс Спирты, фенолы, тиолы
Спирты, фенолы, тиолы Оксиды. 8 класс
Оксиды. 8 класс Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Природный и попутный нефтяной газы
Природный и попутный нефтяной газы Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение)