Содержание
- 2. Доказательство подлинности катиона кальция Реакция осаждения с раствором аммония оксалата Методика. К 0,5 мл препарата прибавляют
- 3. Реакция осаждения с раствором аммония оксалата белый осадок кальция оксалата Раствор кальция хлорида 5%-200 мл Подлинность
- 4. осадок не растворим в растворе аммиака осадок не растворим в уксусной кислоте +NH4OH +CH3COOH Осадок кальция
- 5. осадок растворим в хлористоводо-родной кислоте +HCl осадок растворим в хлористоводо-родной кислоте Осадок кальция оксалата
- 6. Доказательство подлинности хлорид-иона Реакция осаждения с раствором серебра нитрата К 0,5 мл препарата прибавляют по 2-3
- 7. Реакция осаждения с раствором серебра нитрата белый творожистый осадок серебра хлорида Раствор кальция хлорида 5%-200 мл
- 8. осадок серебра хлорида не растворился осадок серебра хлорида растворился + HNO3 разв. +NH4OH
- 9. Комплексонометрический метод (прямое титрование) Титрант: 0,05 М раствор трилона Б. Индикатор: хромовый темно-синий. Среда: аммиачный буфер
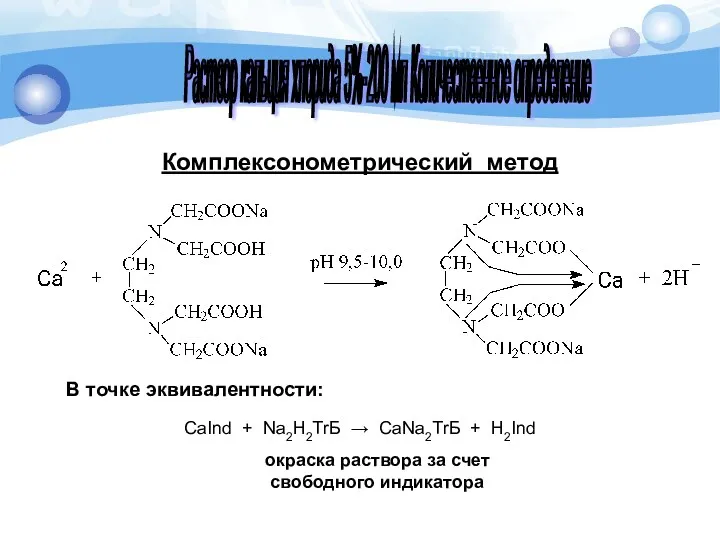
- 10. Комплексонометрический метод В точке эквивалентности: окраска раствора за счет свободного индикатора CaInd + Na2H2ТrБ → CaNa2ТrБ
- 11. Комплексонометрический метод (прямое титрование) К 1 мл препарата прибавляют 5 мл воды, 5 мл аммиачного буферного
- 12. Отмеривают пипеткой навеску препарата
- 13. Прибавляют воду очищенную
- 14. Прибавляют аммиачный буферный раствор
- 15. Прибавляют индикаторную смесь хромового темно-синего
- 16. Окраска раствора до начала титрования
- 17. Титруют раствором трилона Б до сине-фиолетового окрашивания
- 18. Окраска раствора в конце титрования
- 19. Список литературы Беликов, В.Г. Фармацевтическая химия / 4-е изд., перераб. и доп. – М., МЕДпрессинформ", 2008.
- 21. Скачать презентацию

















 Ансамбль пор в реальном твердом теле
Ансамбль пор в реальном твердом теле Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) Aluminium
Aluminium Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №15
Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №15 Бензо́л (C6H6, PhH)
Бензо́л (C6H6, PhH) Классы неорганических веществ
Классы неорганических веществ Заключительный урок в 8 классе Тест по химии.
Заключительный урок в 8 классе Тест по химии. Реакции ионного обмена
Реакции ионного обмена кл химия Классификация химических элементов
кл химия Классификация химических элементов Галогены. Получение и применение галогенов
Галогены. Получение и применение галогенов Жоғары молекулалық қосылыстар химиясы
Жоғары молекулалық қосылыстар химиясы Органолептические и визуальные методы идентификация полимера
Органолептические и визуальные методы идентификация полимера Форми періодичної системи хімічних елементів
Форми періодичної системи хімічних елементів Мыло. Синтетические моющие средства
Мыло. Синтетические моющие средства Каталитический риформинг
Каталитический риформинг Экстракция. Понятия в экстракции
Экстракция. Понятия в экстракции Методы определения вязкости жидкости
Методы определения вязкости жидкости
 Методы термического обезвреживания промышленных газов
Методы термического обезвреживания промышленных газов Геохимическая классификация элементов
Геохимическая классификация элементов Целлюлоза
Целлюлоза Электротехнический фарфор – разновидность твердого фарфора
Электротехнический фарфор – разновидность твердого фарфора Активированные кислородные метаболиты
Активированные кислородные метаболиты Количественный анализ. Гравиметрия
Количественный анализ. Гравиметрия Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Соли, как производные кислот и оснований
Соли, как производные кислот и оснований Электрохимический ряд напряжений металлов. Свойства металлов
Электрохимический ряд напряжений металлов. Свойства металлов