Содержание
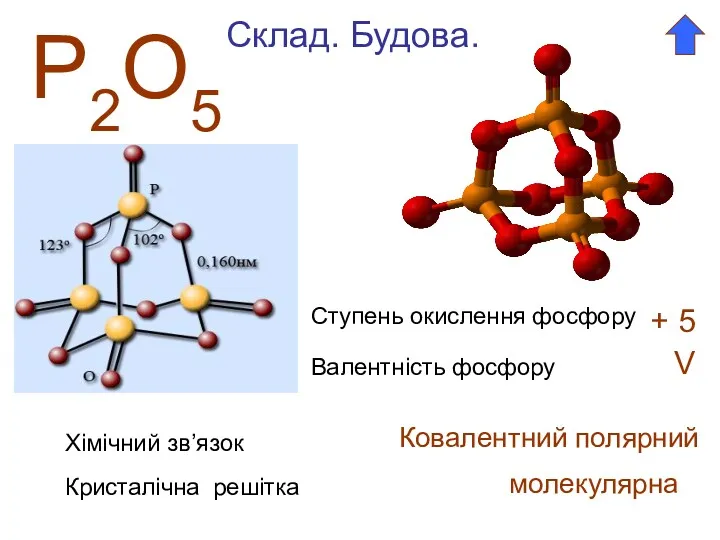
- 2. Р2О5 Ступень окислення фосфору + 5 Валентність фосфору V Склад. Будова. Хімічний зв’язок Ковалентний полярний Кристалічна
- 3. Фізичні властивості оксиду фосфору (V) Оксид фосфору (V), або фосфорний ангідрид, Р2О5 – білий порошок. Дуже
- 4. Хімічні властивості оксиду фосфору (V) До якої групи оксидів відноситься оксид фосфору (V) ? Оксид фосфорау
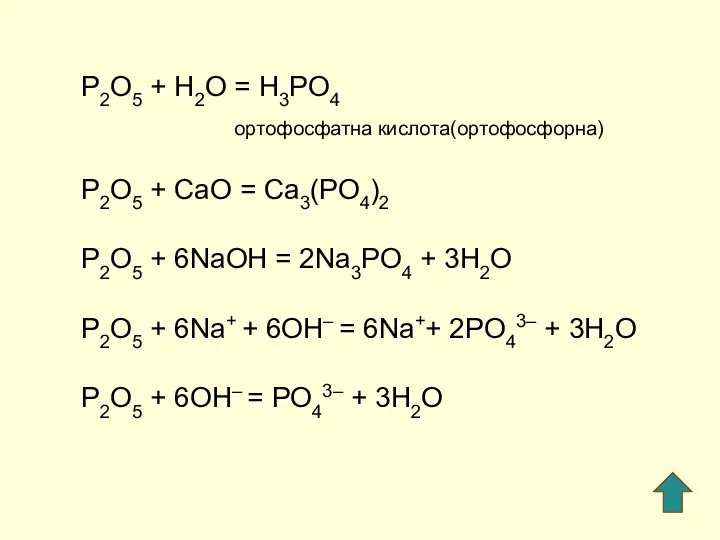
- 5. P2O5 + H2O = H3PO4 ортофосфатна кислота(ортофосфорна) P2O5 + СaO = Ca3(PO4)2 P2O5 + 6NaOH =
- 6. Одержання ортофосфорної кислоти
- 7. Склад. Будова. Властивості. Н3РО4 Ступінь окислення фосфору + 5 Валентність фосфору V Хімічний зв’язок ковалентний полярний
- 8. Ортофосфорна кислота (H3РO4). Класифікація: Ортофосфорна кислота по: наявності оксигену: основність: розчинність в воді: летучість: ступінь електролітичної
- 9. Хімічні властивості Ортофосфорна кислота проявляє всі властивості кислот Опишіть хімічні властивості ортофосфорної кислоти 1) з лугами:
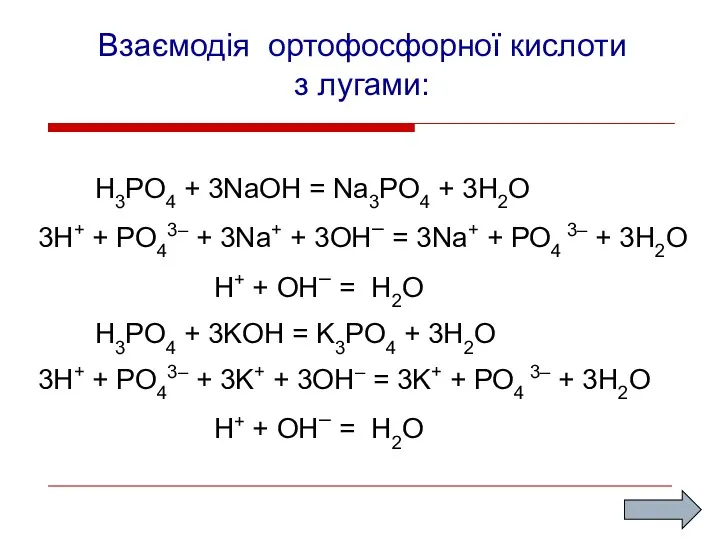
- 10. Взаємодія ортофосфорної кислоти з лугами: H3PO4 + 3NaOH = Na3PO4 + 3H2O 3H+ + PO43– +
- 11. Взаємодія ортофосфорної кислоти з основними оксидами: 2H3PO4 + 3Na2O = 2Na3PO4 + 3H2O 6H+ + 2PO43–
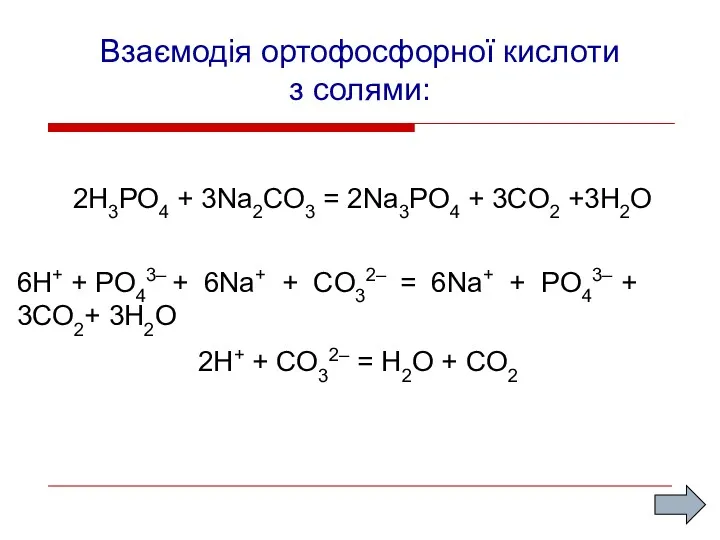
- 12. Взаємодія ортофосфорної кислоти з солями: 2H3PO4 + 3Na2CO3 = 2Na3PO4 + 3CO2 +3H2O 2H+ + CO32–
- 13. Взаємодія ортофосфорної кислоти з металами Ортофосфорна кислота може бути слабким окислювачем тільки за рахунок іонів Н+
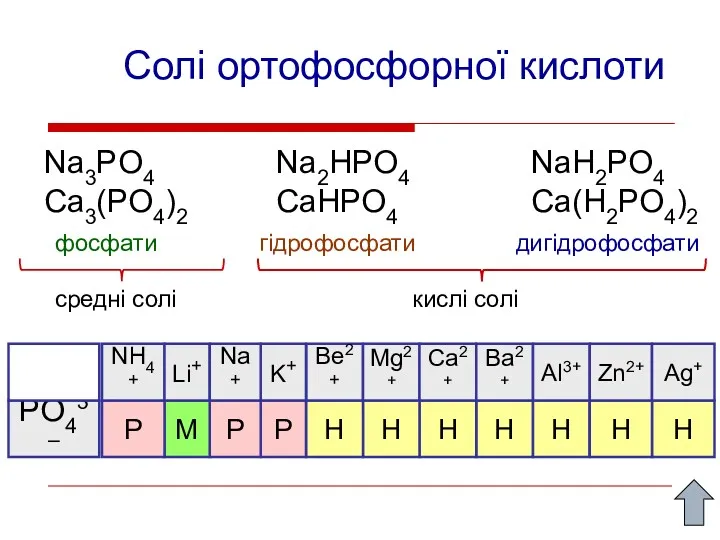
- 14. Солі ортофосфорної кислоти Na3PO4 Ca3(PO4)2 Na2HPO4 CaHPO4 NaH2PO4 Ca(H2PO4)2 фосфати гідрофосфати дигідрофосфати средні солі кислі солі
- 15. Застосування ортофосфорної кислоти і фосфатів 1 2 3 5 4 7 6 В харчовій промисловості як
- 17. Скачать презентацию









 Средние породы. Типичный андезитовый вулкан
Средние породы. Типичный андезитовый вулкан Учение об агрегатных состояниях вещества. Жидкое состояние. Твердое состояние. Плазма
Учение об агрегатных состояниях вещества. Жидкое состояние. Твердое состояние. Плазма Общие представления о фазовых состояниях и фазовых переходах полимеров
Общие представления о фазовых состояниях и фазовых переходах полимеров Кремний и его соединения. Нахождение в природе
Кремний и его соединения. Нахождение в природе Неметаллы: общая характеристика
Неметаллы: общая характеристика Гидролиз солей
Гидролиз солей Алкандар,жалпы формуласы, гомологтық қатары, изомерлері, атаулары
Алкандар,жалпы формуласы, гомологтық қатары, изомерлері, атаулары Полимеры, бумага
Полимеры, бумага Залежність фізичних властивостей речовин від типу кристалічних ґраток
Залежність фізичних властивостей речовин від типу кристалічних ґраток Минеральные удобрения
Минеральные удобрения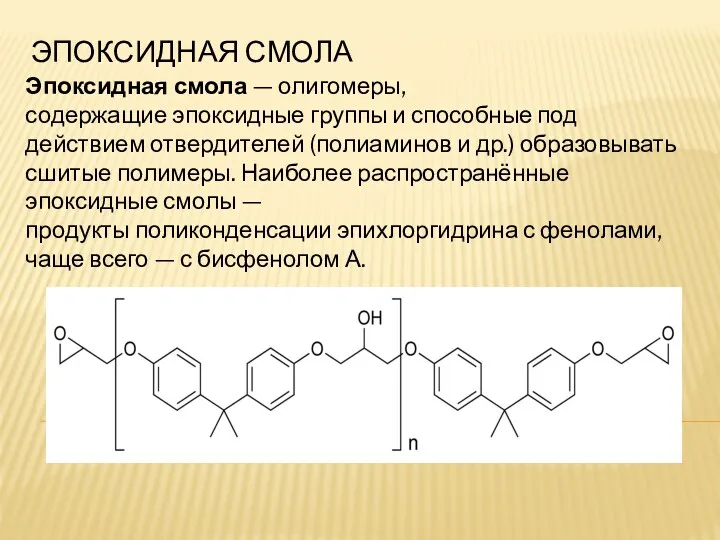 Эпоксидная смола
Эпоксидная смола Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Химия в повседневной жизни человека
Химия в повседневной жизни человека Введение в органическую химию
Введение в органическую химию Ерітіндіден заттарды бөлу әдістері
Ерітіндіден заттарды бөлу әдістері Коллигативные свойства растворов
Коллигативные свойства растворов Коррозия металла. Способы защиты от коррозии
Коррозия металла. Способы защиты от коррозии Техника безопасности и правила работы в лаборатории. 10 класс
Техника безопасности и правила работы в лаборатории. 10 класс Вещества и их превращения Роль химии в нашей жизни
Вещества и их превращения Роль химии в нашей жизни Выделение транс-анетола из эфирных масел
Выделение транс-анетола из эфирных масел Качественные реакции на органические вещества
Качественные реакции на органические вещества Распределение электронов в атомах. 8 класс
Распределение электронов в атомах. 8 класс Посуда, ее виды и использование
Посуда, ее виды и использование Титриметрические методы количественного определения лекарственных веществ
Титриметрические методы количественного определения лекарственных веществ Кинетика химических реакций. Химическое равновесие
Кинетика химических реакций. Химическое равновесие Неорганические полимеры
Неорганические полимеры Основные классы неорганических соединений
Основные классы неорганических соединений Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты)