Содержание
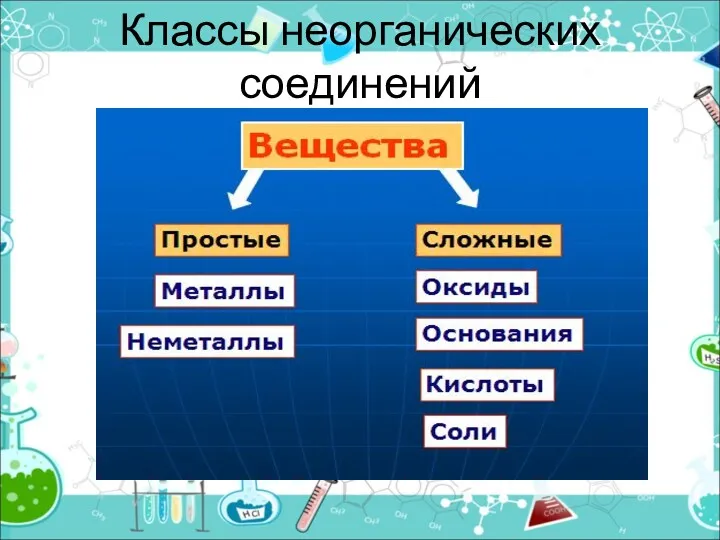
- 2. Классы неорганических соединений
- 3. соли ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- 4. Эпиграф урока «Просто знать еще не все, знания необходимо еще использовать» И.В.Гете (немецкий естествоиспытатель)
- 5. Цели урока: -Обобщение знаний о : классификации солей по составу; номенклатуре солей; физических и химических свойствах
- 6. Соли
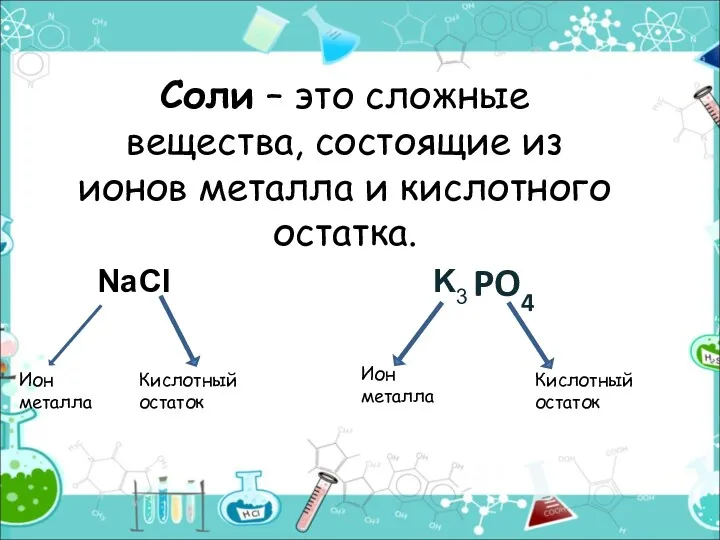
- 7. Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка. PO4 Ион металла Кислотный
- 8. Соли как электролиты Соли – это электролиты, образующие при электролитической диссоциации катионы металлов и анионы кислотных
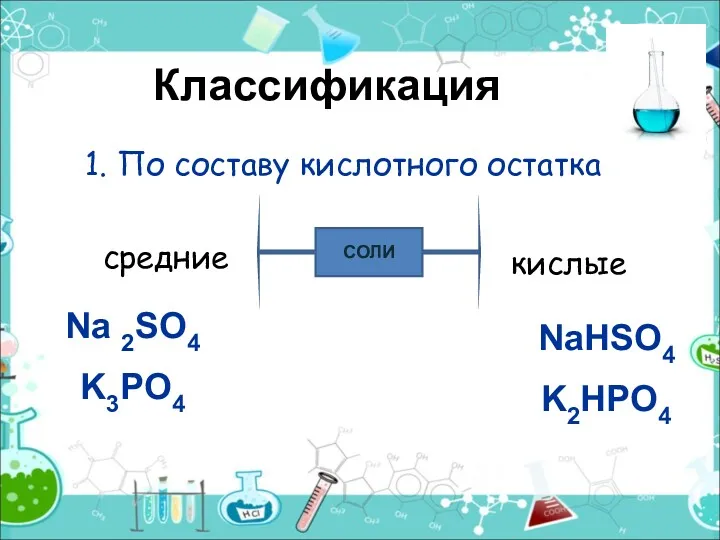
- 9. Классификация 1. По составу кислотного остатка СОЛИ средние кислые Na 2SO4 K3PO4 NaHSO4 K2HPO4
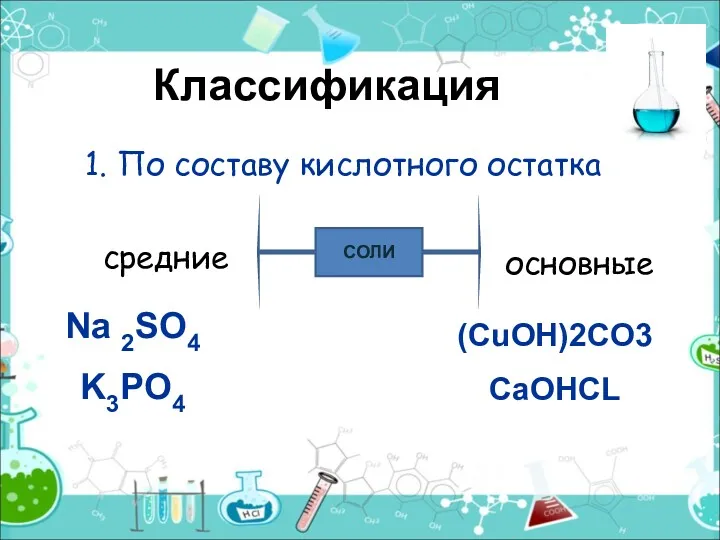
- 10. Классификация 1. По составу кислотного остатка СОЛИ средние основные Na 2SO4 K3PO4 (CuOH)2CO3 CaOHCL
- 11. Номенклатура кислых солей Указать название кислотного остатка К названию кислотного остатка прибавить «гидро-» Наименование металла в
- 12. Номенклатура основных солей Указать название кислотного остатка К названию кислотного остатка прибавить «гидроксо-» Наименование металла в
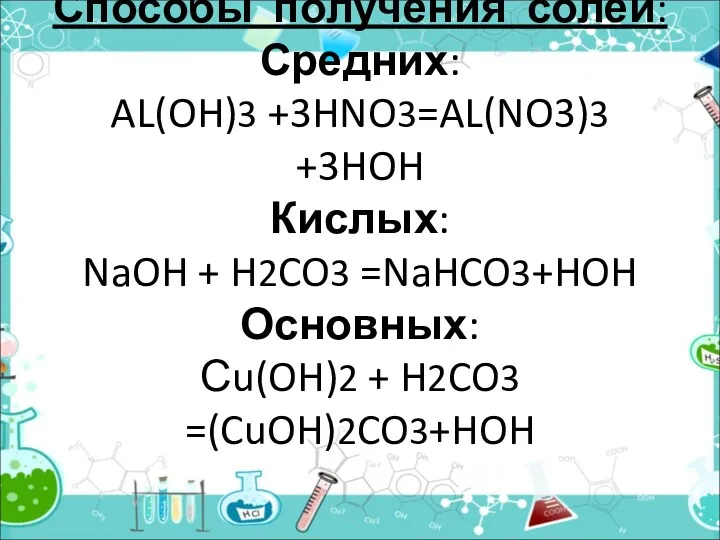
- 13. Способы получения солей: Средних: AL(OH)3 +3HNO3=AL(NO3)3 +3HOH Кислых: NaOH + H2CO3 =NaHCO3+HOH Основных: Сu(OH)2 + H2CO3
- 14. Химические свойства 1. Взаимодействие с металлами: SnCl2 + Zn ? Свободный металл должен быть расположен ……………
- 15. Химические свойства 2. Взаимодействие с основаниями: 2NaОН + CuSO4 → Соли взаимодействуют с ……………….. основаниями, или
- 16. Химические свойства 3.Взаимодействие с кислотами: Сильные кислоты вытесняют более …………. из их солей! CaCO3 + HCl
- 17. Химические свойства 4. Взаимодействие солей между собой КСl + AgNO3 → AgCl + KNO3
- 18. Химические свойства 5. Разложение при нагревании : СаСО3= CaO + CO2 KNO3 = KNO2 + O2
- 19. Викторина о солях 1.Из какой муки нельзя испечь хлеб? 2.Какую соль называют «несъедобным сахаром»? 3.При лечении
- 20. Способы получения 1. Кислота + основание = соль + вода H2SO4 +2NaOH = Na2SO4 + 2H2O
- 22. Скачать презентацию














 Медь и её сплавы
Медь и её сплавы Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Урок 25
Урок 25 Прикладная геохимия. Вторичные ореолы
Прикладная геохимия. Вторичные ореолы Классификация органических веществ
Классификация органических веществ Поняття про багатоатомні спирти на прикладі гліцеролу, його хімічні властивості
Поняття про багатоатомні спирти на прикладі гліцеролу, його хімічні властивості Кислород как элемент
Кислород как элемент Реакции ионного обмена
Реакции ионного обмена Классификация процессов и производств в химической технологии
Классификация процессов и производств в химической технологии Карбоновые кислоты (часть 1)
Карбоновые кислоты (часть 1)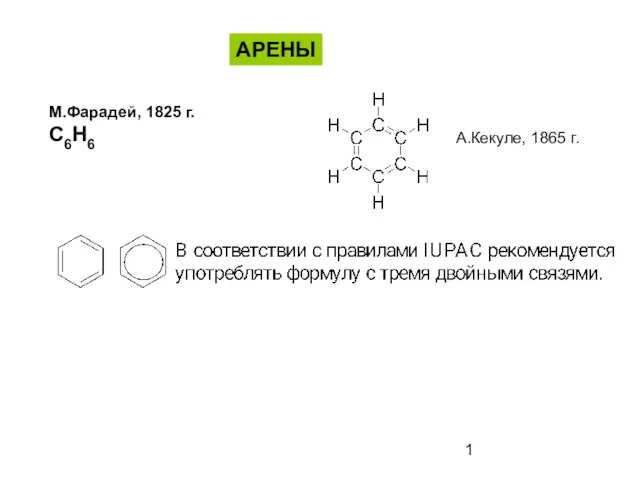 Ароматические соединения - арены
Ароматические соединения - арены Органическая химия
Органическая химия Теоретические основы органической химии
Теоретические основы органической химии Облагораживание тяжелых нефтей и природных битумов
Облагораживание тяжелых нефтей и природных битумов Электролитическая диссоциация
Электролитическая диссоциация Установление структуры биополимеров
Установление структуры биополимеров Гидролиз. Классификация солей
Гидролиз. Классификация солей Коллоидная химия
Коллоидная химия Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2)
Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2) Итоговая контрольная работа по химии
Итоговая контрольная работа по химии Мило. Мийні засоби
Мило. Мийні засоби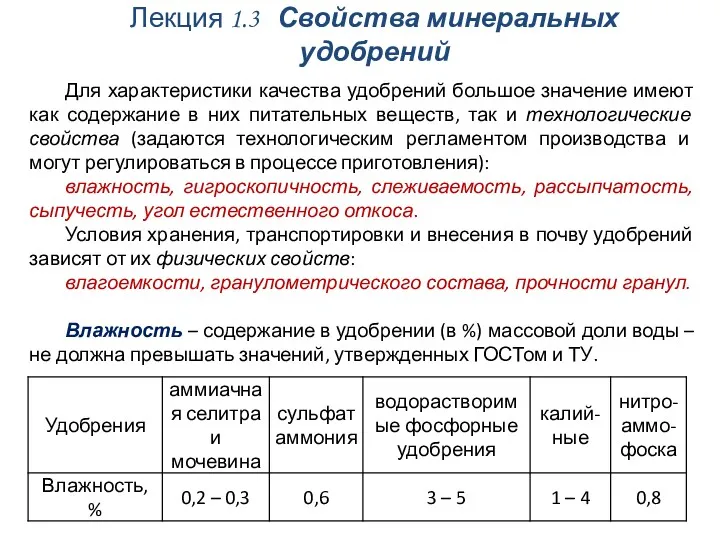 Свойства минеральных удобрений
Свойства минеральных удобрений Мыльная история. (3 класс)
Мыльная история. (3 класс) Неорганические соединения. Основания
Неорганические соединения. Основания kremniy
kremniy Камни и минералы
Камни и минералы Сложные эфиры. Жиры
Сложные эфиры. Жиры Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени