Содержание
- 2. Атомы объединяются в молекулы при возникновении между ними химических связей. Образование химического соединения (молекулы, сложного иона
- 3. В зависимости от характера распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи:
- 4. Ковалентная связь Ковалентная связь – связь, образованная общими электронными парами атомов. Для описания химических связей в
- 5. Метод валентных связей (ВС) В 1916 г. американский ученый Льюис высказал предположение о том, что химическая
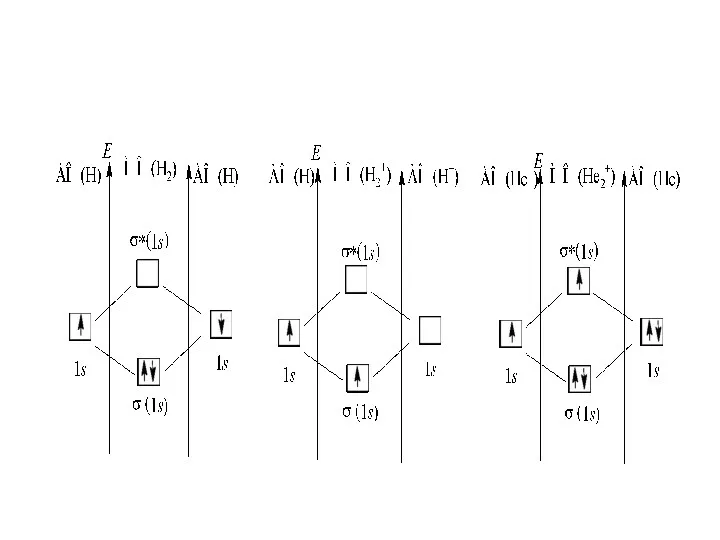
- 6. Результаты расчета зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов. При совпадающем направлении
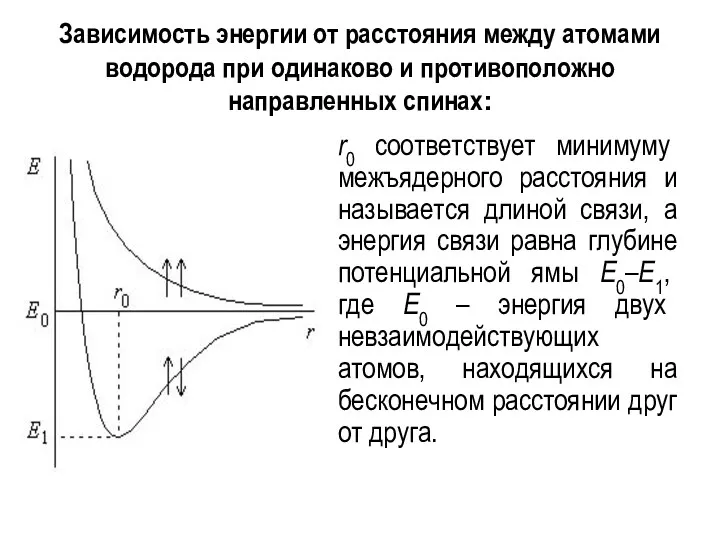
- 7. Зависимость энергии от расстояния между атомами водорода при одинаково и противоположно направленных спинах: r0 соответствует минимуму
- 8. Образование химической связи между атомами водорода является результатом взаимопроникновения (перекрывания) электронных облаков. Вследствие этого перекрывания плотность
- 9. Основные положения метода ВС 1. Ковалентная связь образуется между двумя атомами за счет взаимодействия электронных орбиталей
- 10. Различают следующие механизмы образования ковалентной связи: обменный (спин-валентный); донорно-акцепторный; дативный.
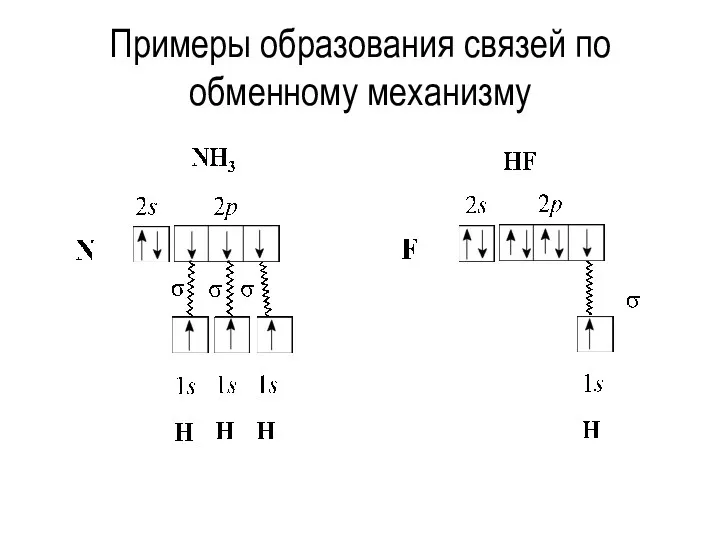
- 11. Обменный (спин-валентный) механизм механизм, по которому каждый из связываемых атомов предоставляет для ее образования по одному
- 13. Примеры образования связей по обменному механизму
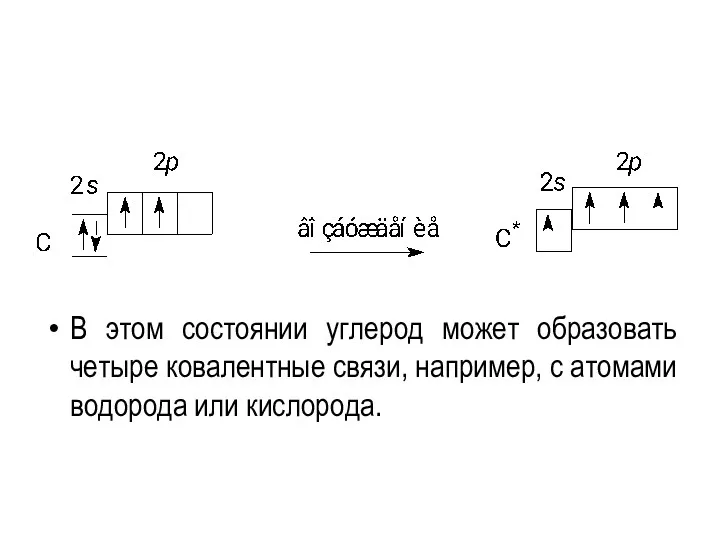
- 14. у атома углерода только два неспаренных электрона, и он может образовать только две ковалентные связи по
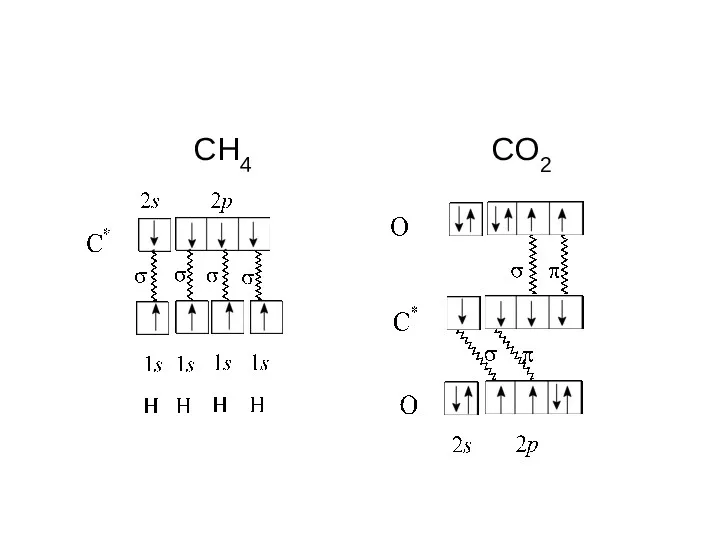
- 15. В этом состоянии углерод может образовать четыре ковалентные связи, например, с атомами водорода или кислорода.
- 16. CH4 CO2
- 17. Донорно-акцепторный механизм Химическая связь образуется за счет предоставления одним атомом в общее пользование пары электронов, а
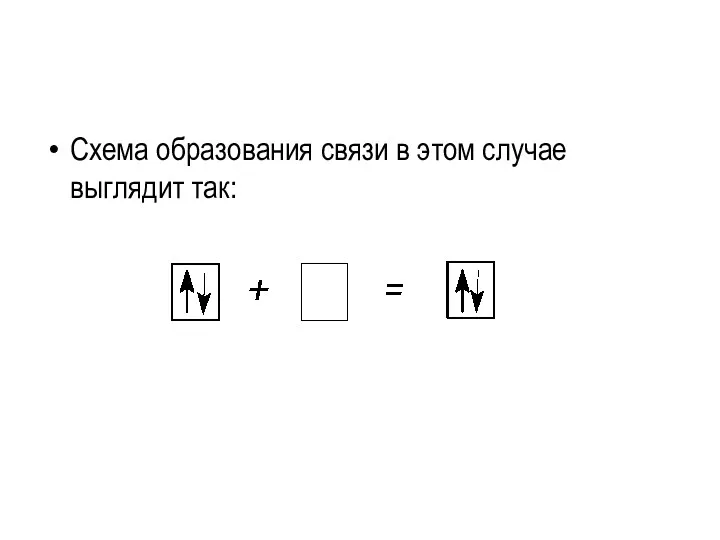
- 18. Схема образования связи в этом случае выглядит так:
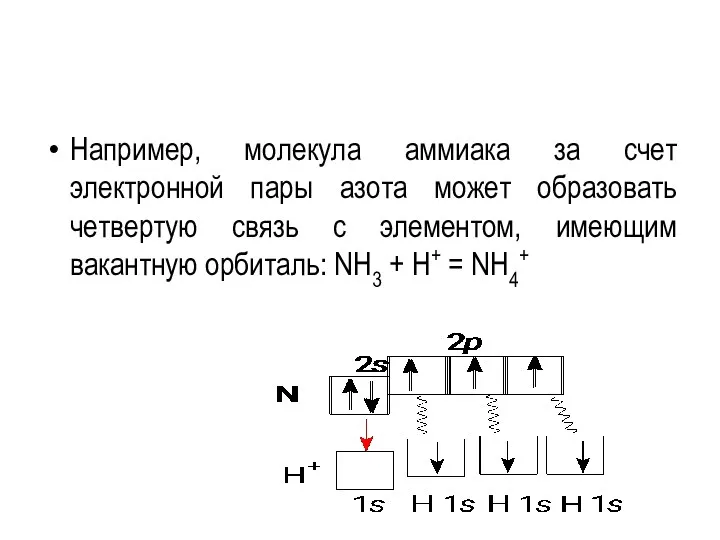
- 19. Например, молекула аммиака за счет электронной пары азота может образовать четвертую связь с элементом, имеющим вакантную
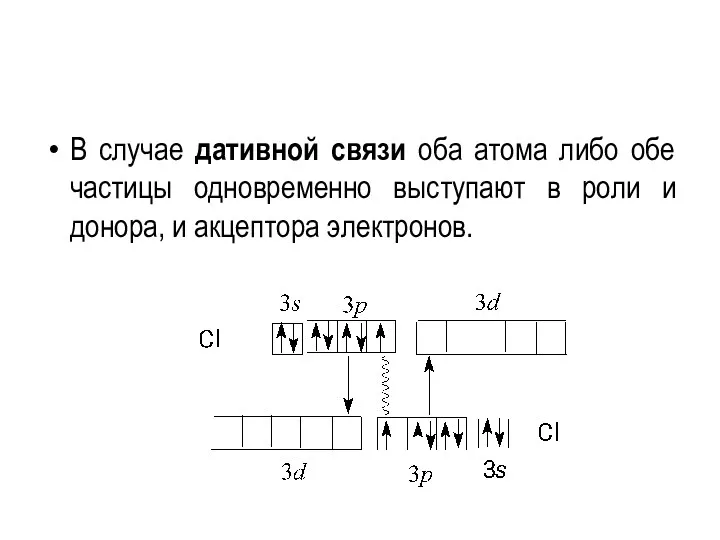
- 20. В случае дативной связи оба атома либо обе частицы одновременно выступают в роли и донора, и
- 21. Электронные облака атомов имеют различную форму, их взаимное перекрывание может осуществляться разными способами. В зависимости от
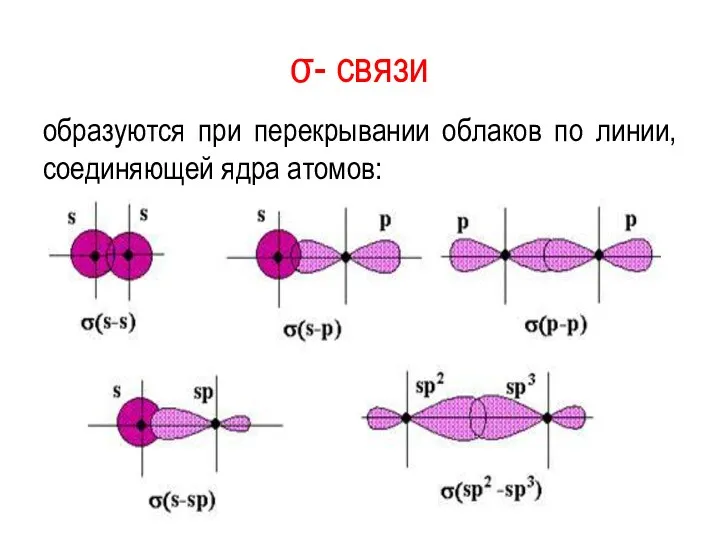
- 22. σ- связи образуются при перекрывании облаков по линии, соединяющей ядра атомов:
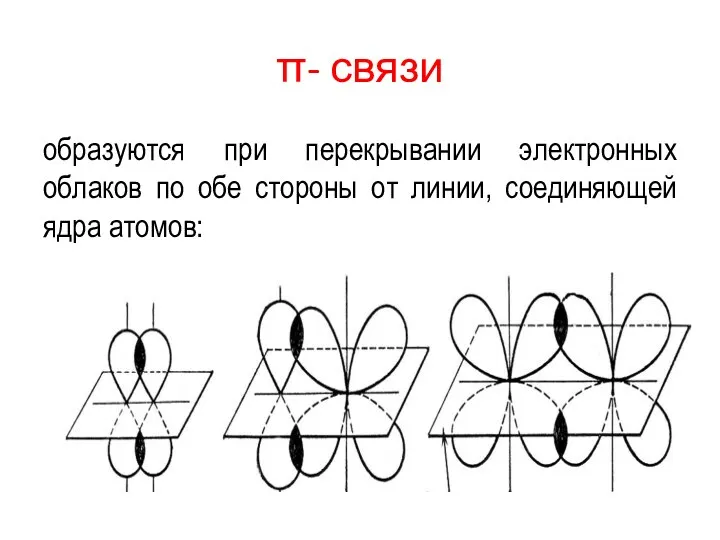
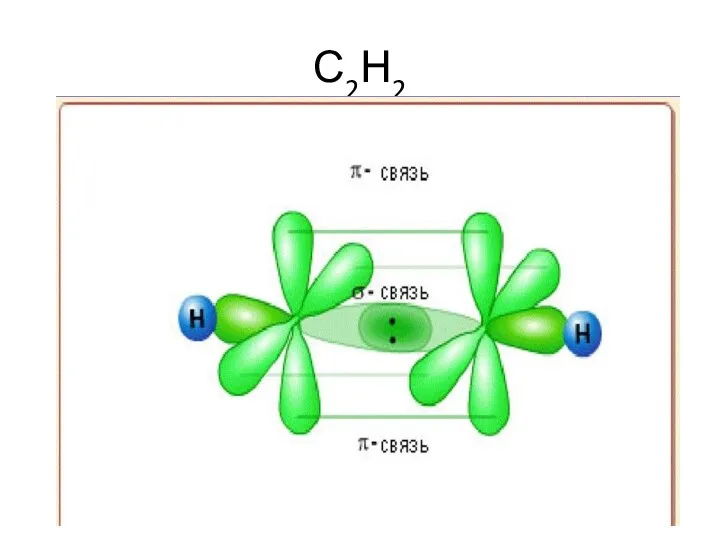
- 23. π- связи образуются при перекрывании электронных облаков по обе стороны от линии, соединяющей ядра атомов:
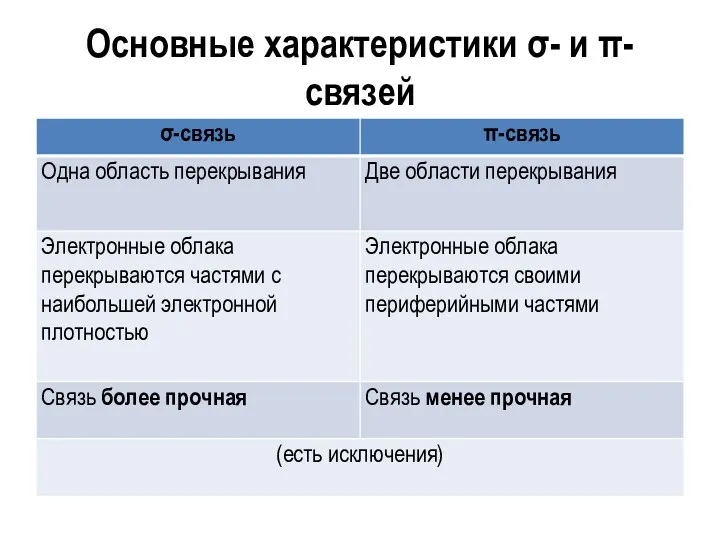
- 24. Основные характеристики σ- и π-связей
- 25. Химическая связь характеризуется следующими параметрами: 1) длиной связи – межъядерным расстоянием между двумя химически связанными атомами;
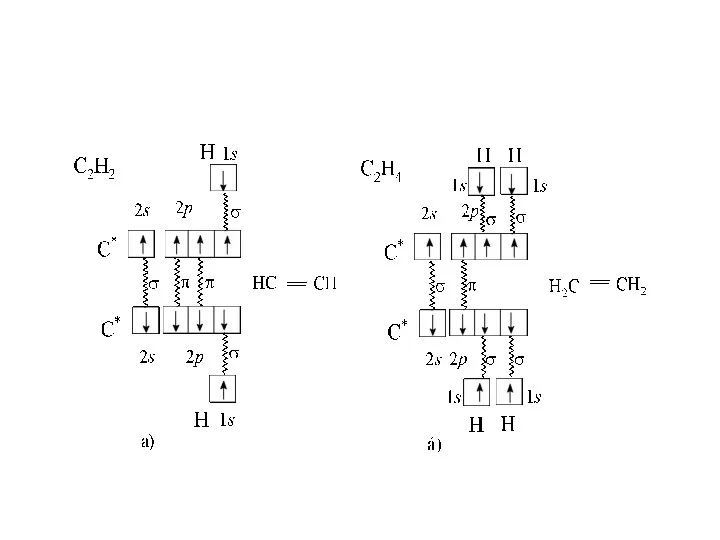
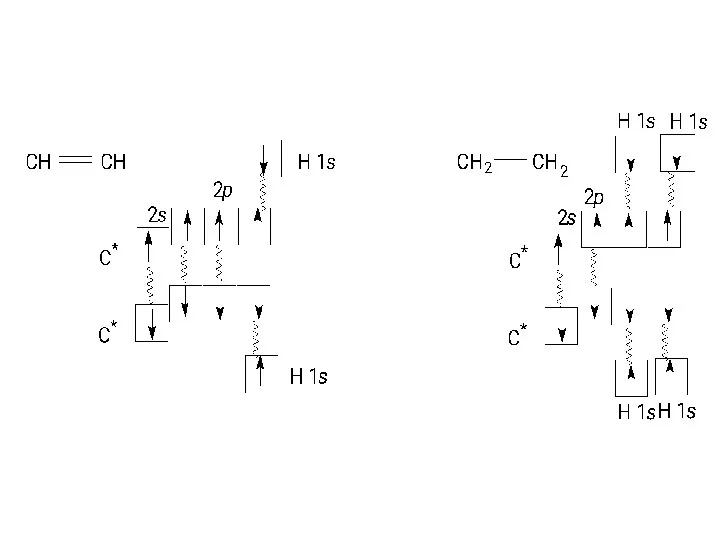
- 26. π-связь возможна только в случае образования кратных связей (двойных и тройных). Кратные связи короче и прочнее
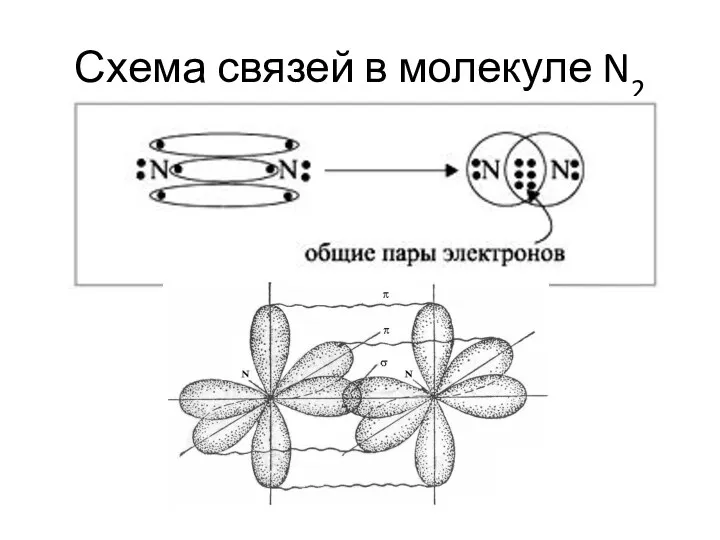
- 27. Схема связей в молекуле N2
- 28. С2Н2
- 29. Свойства ковалентной связи Ковалентная связь обладает: насыщаемостью, направленностью, поляризуемостью.
- 30. Поляризуемость Если электронная пара, связывающая в молекуле два одинаковых атома, в равной мере принадлежит обоим атомам,
- 31. Для наглядного изображения ковалентной связи в химических формулах используются точки (точка соответствует электрону, две точки между
- 32. Ковалентная неполярная связь существует в молекулах одноэлементных газов: H2, O2, N2, Cl2 …
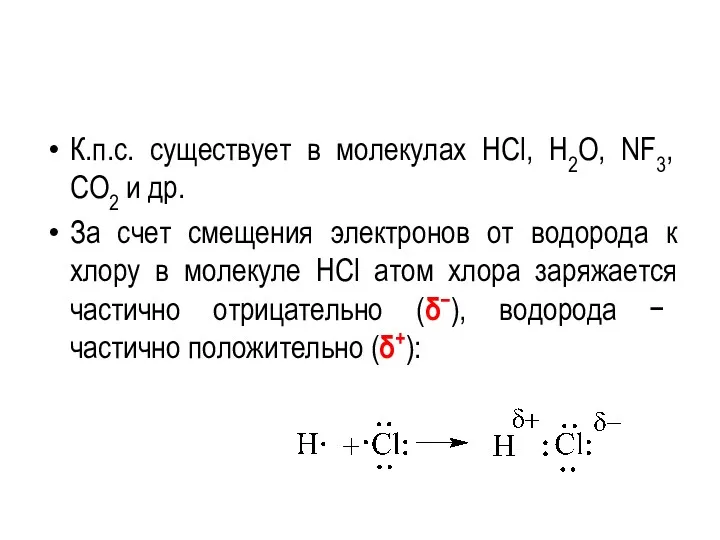
- 33. Если электронная пара связывает два атома с различной электроотрицательностью, то она смещается в сторону более электроотрицательного
- 34. К.п.с. существует в молекулах HCl, H2O, NF3, CO2 и др. За счет смещения электронов от водорода
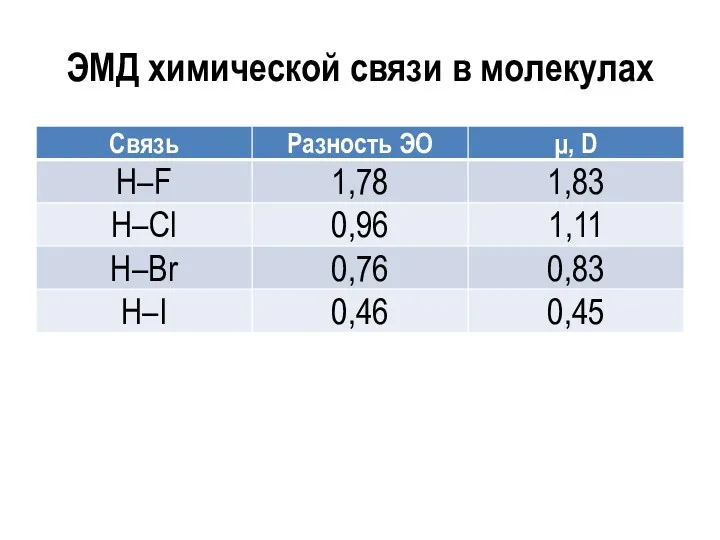
- 35. Мерой полярности связи является электрический момент диполя (ЭМД) μ, представляющий собой произведение длины диполя l на
- 36. Электрический момент диполя в Кл · м имеет значения порядка 10−29, поскольку длина диполя имеет значение
- 37. ЭМД химической связи в молекулах
- 38. Химическая связь в большинстве соединений сочетает свойства ковалентной и ионной связи. Степень ионности характеризуется эффективным зарядом
- 39. Насыщаемость Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т. е. их способностью к образованию строго
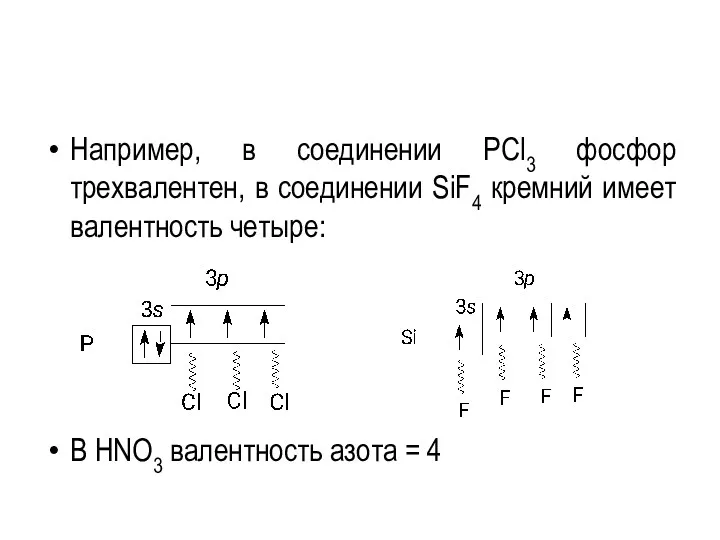
- 41. Например, в соединении PCl3 фосфор трехвалентен, в соединении SiF4 кремний имеет валентность четыре: В HNO3 валентность
- 42. Направленность Направленность ковалентной связи обусловливается тем, что электронные облака атомов имеют определенное конфигурацию – расположение в
- 43. Гибридизация сопровождается изменением формы и энергии электронных облаков, которое происходит при поглощении энергии и сопровождается образованием
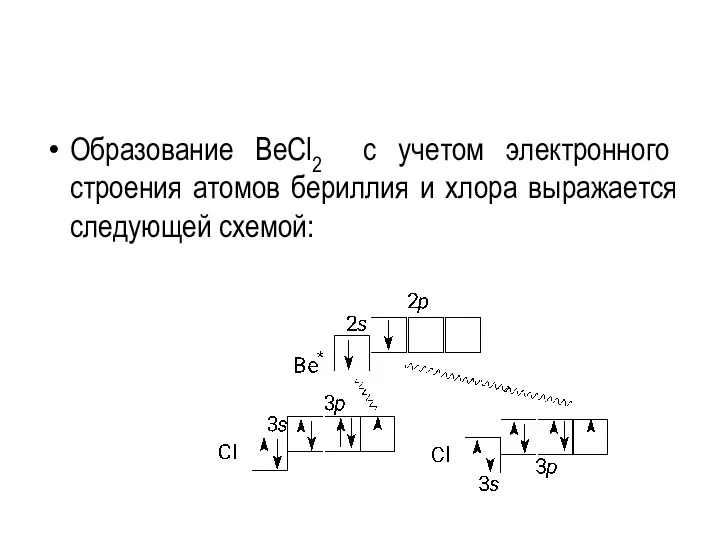
- 44. Образование BeCl2 с учетом электронного строения атомов бериллия и хлора выражается следующей схемой:
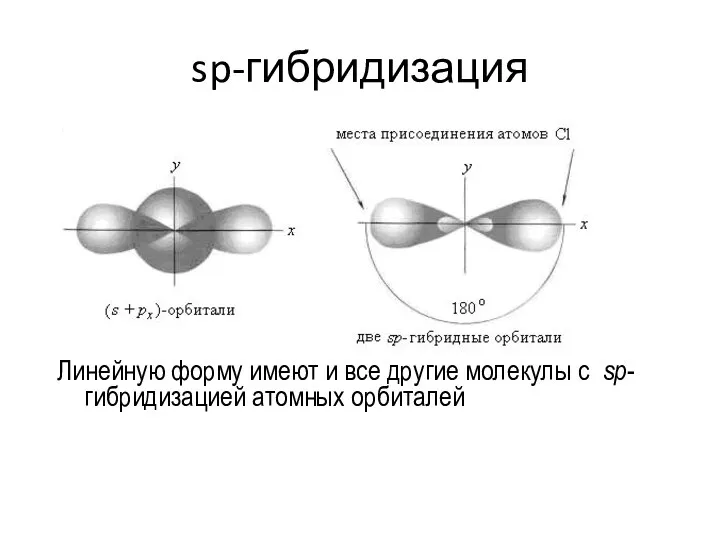
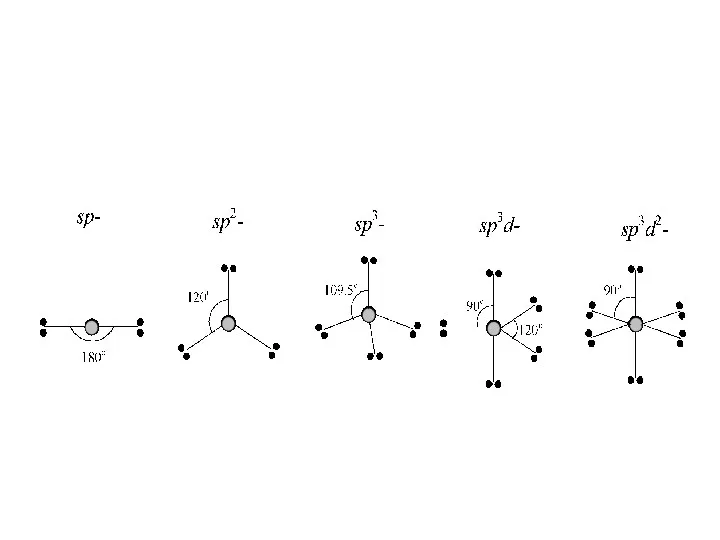
- 45. Для объяснения равноценности связей Be−Cl, используют концепцию о sp-гибридизации валентных атомных орбиталей бериллия. При гибридизации одна
- 46. sp-гибридизация Линейную форму имеют и все другие молекулы с sp-гибридизацией атомных орбиталей
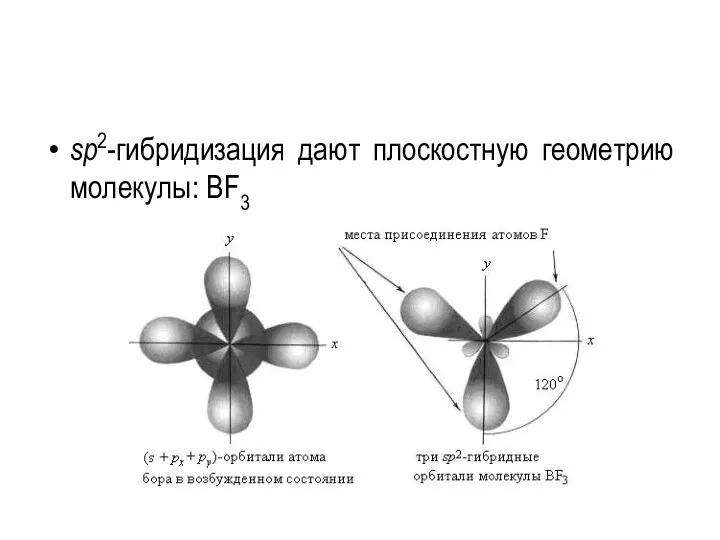
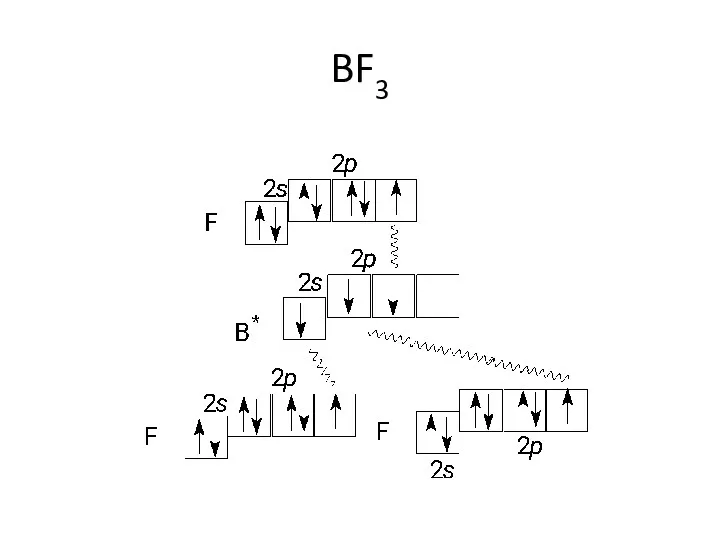
- 47. sp2-гибридизация дают плоскостную геометрию молекулы: BF3
- 48. BF3
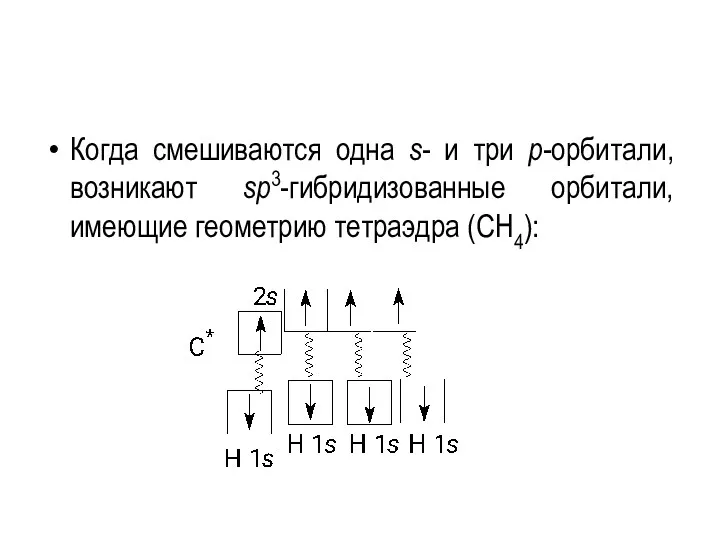
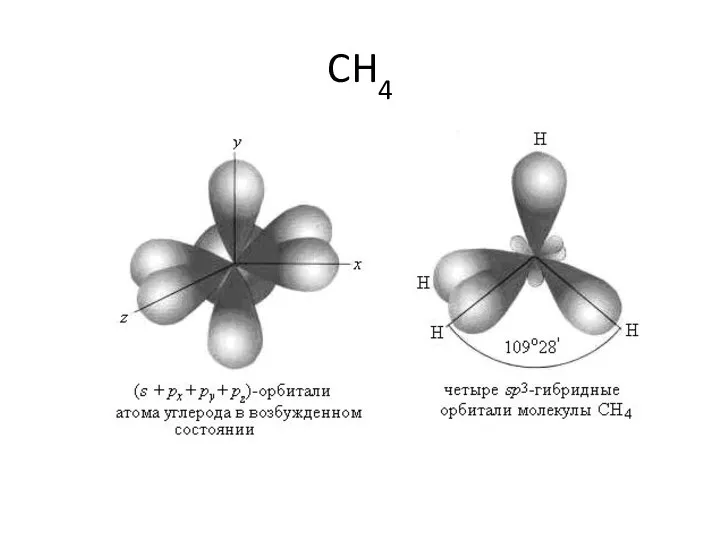
- 49. Когда смешиваются одна s- и три p-орбитали, возникают sp3-гибридизованные орбитали, имеющие геометрию тетраэдра (CH4):
- 50. CH4
- 51. Гибридизации могут подвергаться как орбитали с неспаренными электронами, так и орбитали, на которых находятся неподеленные электронные
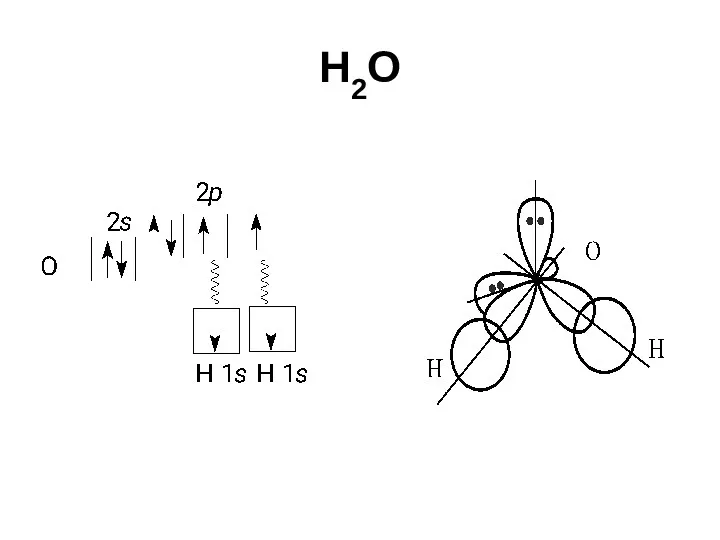
- 52. H2O
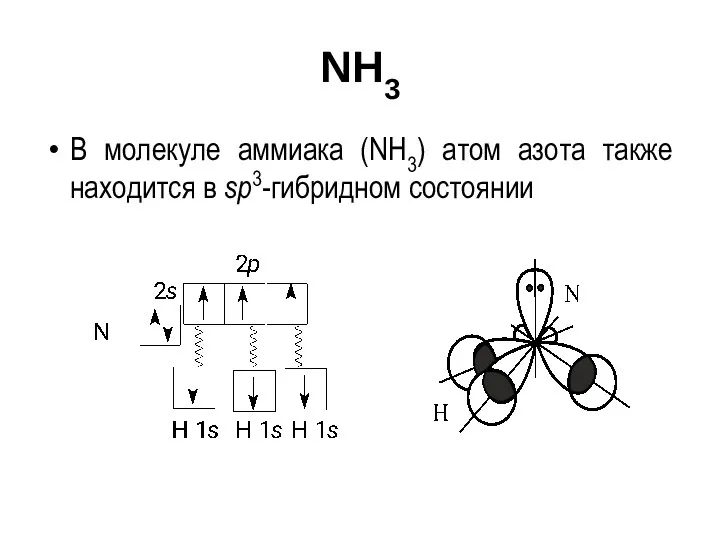
- 53. NH3 В молекуле аммиака (NH3) атом азота также находится в sp3-гибридном состоянии
- 55. Обобщением метода ВС для предсказания геометрии молекул является метод Гиллеспи. Основные положения метода Гиллеспи: 1. Все
- 57. 4. Строение молекулы определяется расположением в пространстве связывающих электронных пар. 5. Орбиталь кратной связи считается единичной,
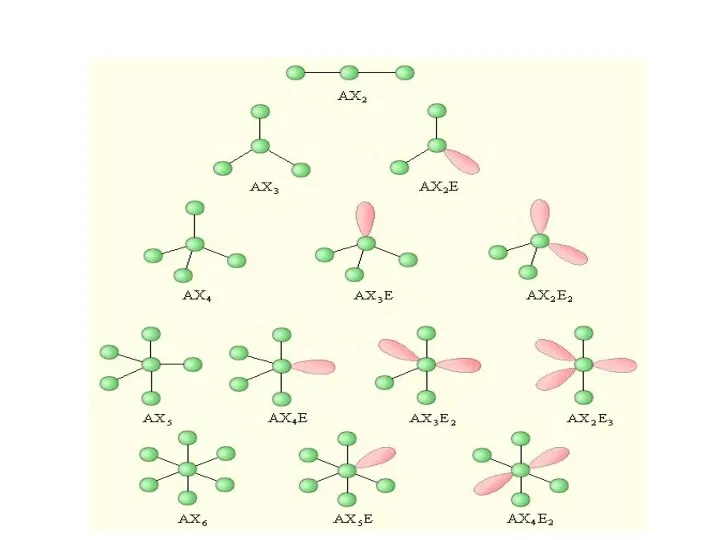
- 58. При рассмотрении геометрической формы молекулы методом Гиллеспи ее формула записывается в виде AХnEm, А – центральный
- 59. Число неподеленных электронных пар m определяют следующим образом: число валентных электронов центрального атома минус число электронов,
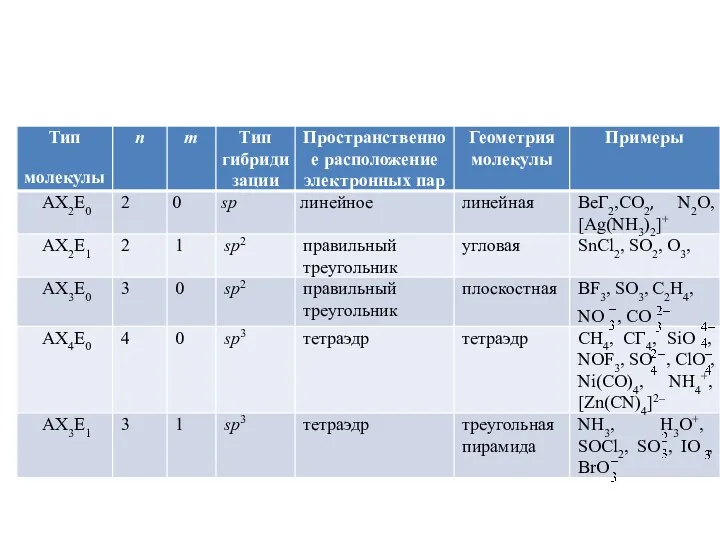
- 60. AX2E0 BeГ2,CO2, N2O, [Ag(NH3)2]+
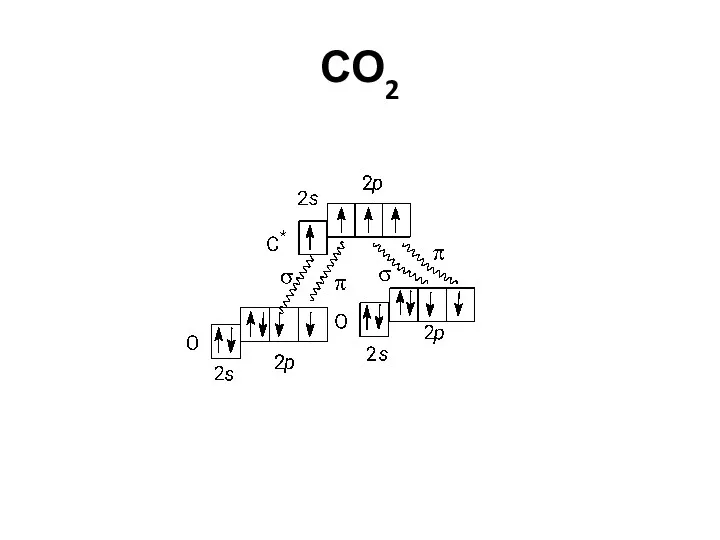
- 61. СО2
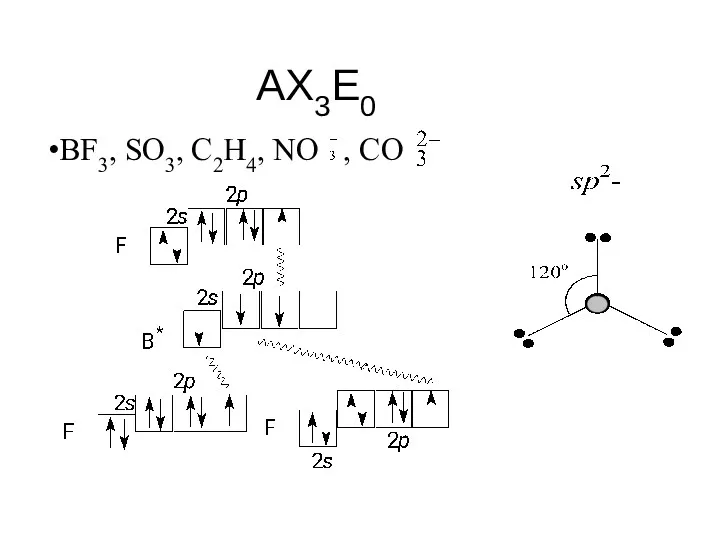
- 62. BF3, SO3, С2Н4, NO , CO AX3E0
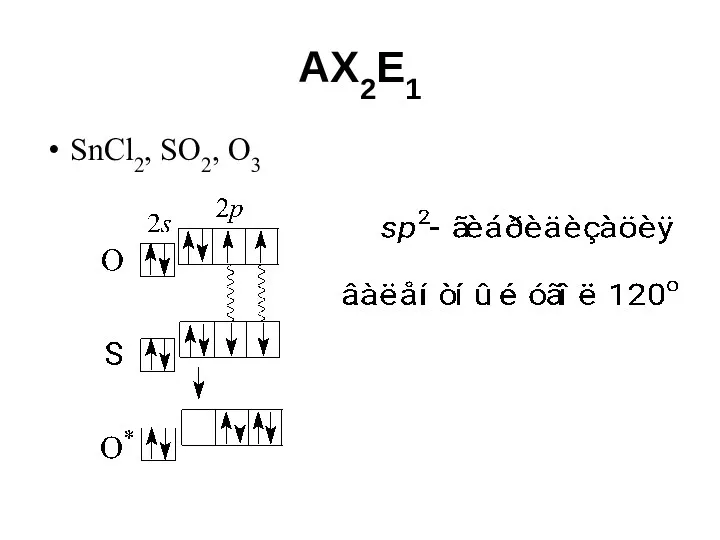
- 63. AX2E1 SnCl2, SO2, O3
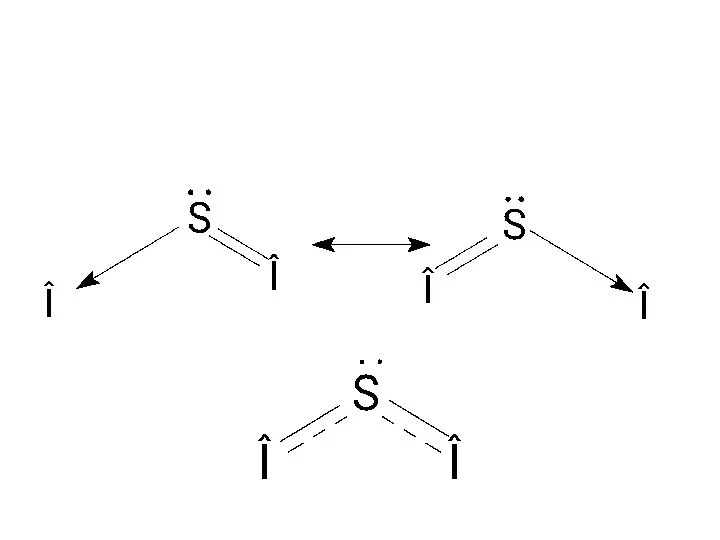
- 64. Строение многих молекул нельзя изобразить только одной схемой с локализованной π-связью. В таких случаях строение молекулы
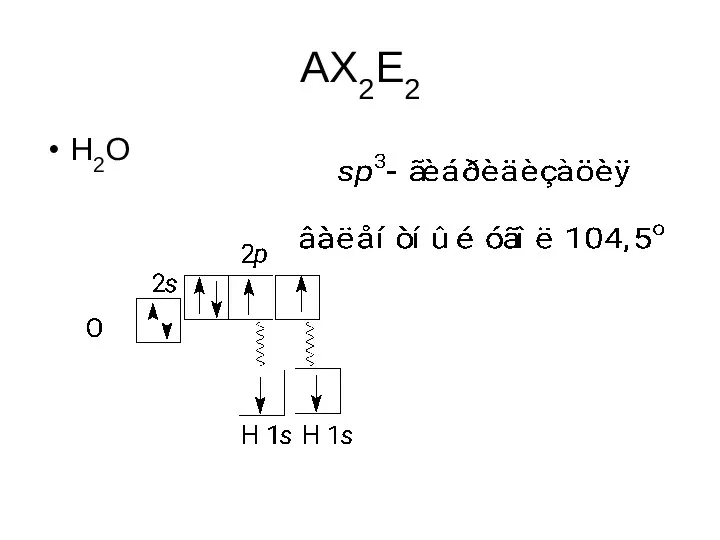
- 66. AX2E2 H2O
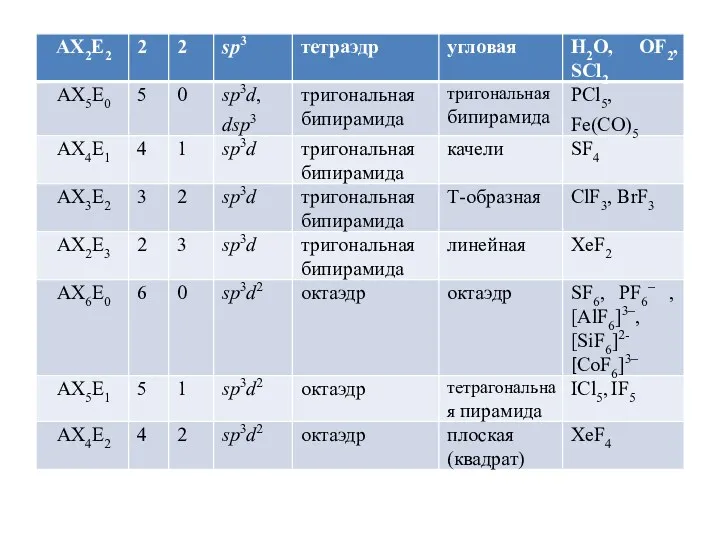
- 67. AX4E0 CH4, CГ4, SiO , NOF3, SO , ClO , Ni(CO)4, NH4+, [Zn(CN)4]2–
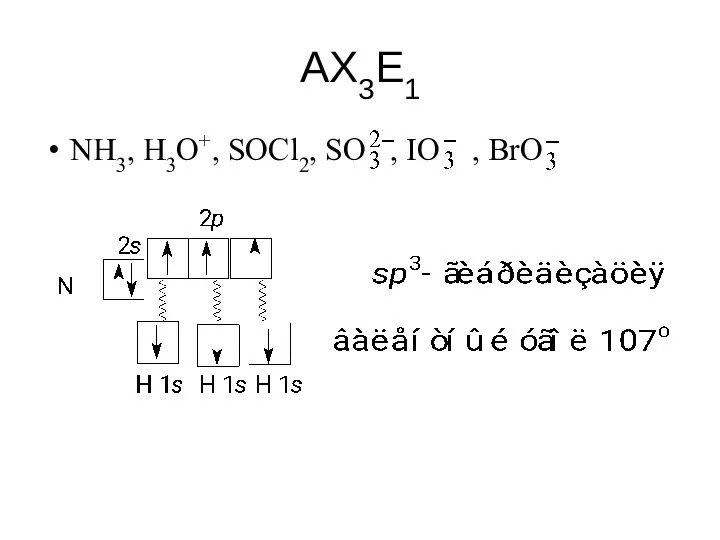
- 68. AX3E1 NH3, H3O+, SOCl2, SO , IO , BrO
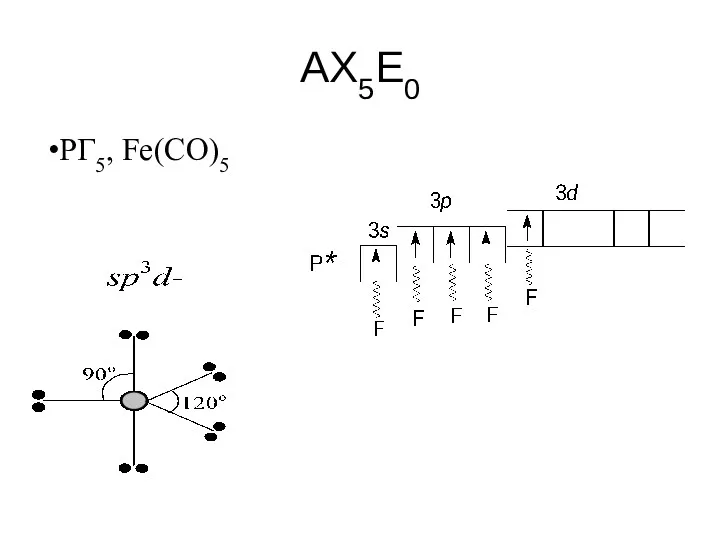
- 69. AX5E0 PГ5, Fe(CO)5
- 70. AX6E0 SF6, PF6– , [AlF6]3–, [SiF6]2- [CoF6]3–
- 72. Следует различать полярность связей и полярность молекул. Связи в молекуле могут быть полярными, а сами молекулы
- 73. Компенсация диполей в молекуле CO2 Электрический момент диполя молекулы СО2 (sp-гибридизация) равен нулю хотя связи С
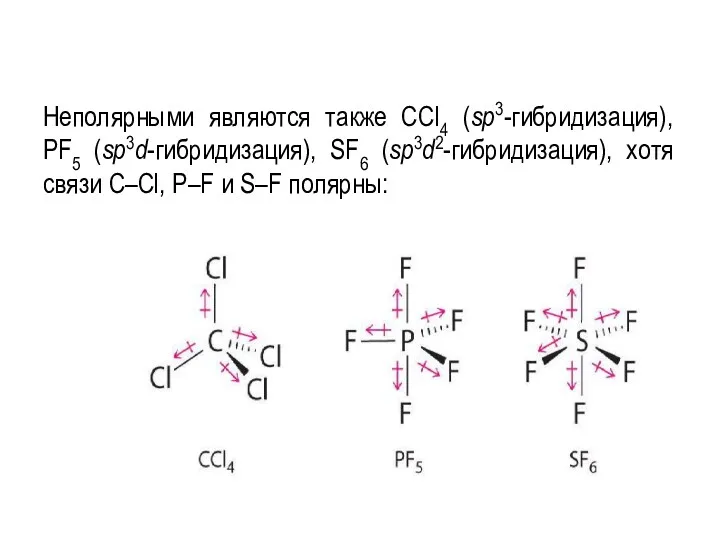
- 74. Неполярными являются также CCl4 (sp3-гибридизация), PF5 (sp3d-гибридизация), SF6 (sp3d2-гибридизация), хотя связи С–Cl, P–F и S–F полярны:
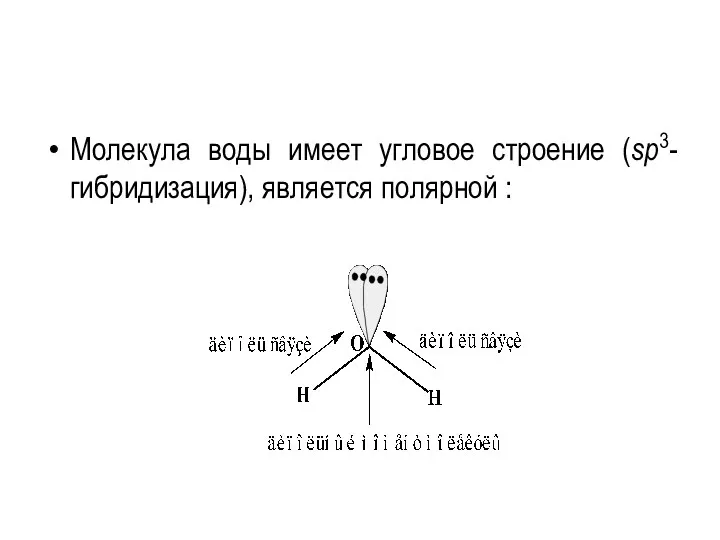
- 75. Молекула воды имеет угловое строение (sp3-гибридизация), является полярной :
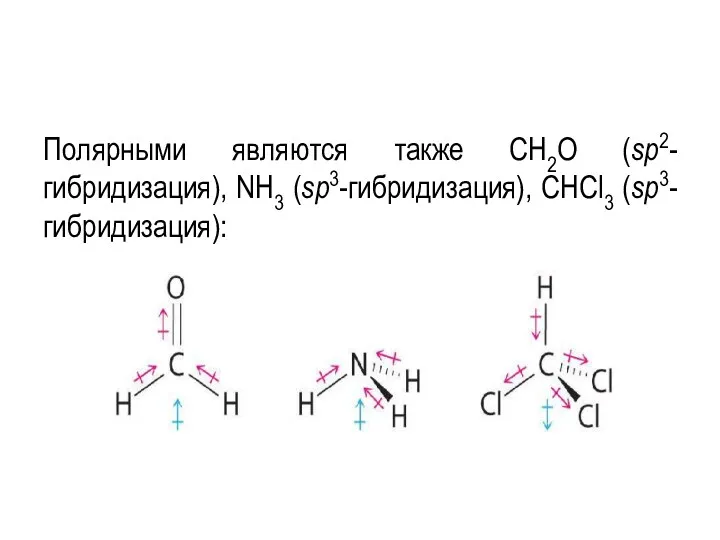
- 76. Полярными являются также CH2O (sp2-гибридизация), NH3 (sp3-гибридизация), CHCl3 (sp3-гибридизация):
- 77. Вследствие углового строения μ (SO2) = 1,79 D. Дипольные моменты NF3 и NH3 при одинаковой гибридизации
- 78. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ Идея метода молекулярных - все электроны находятся на молекулярных орбиталях, единых для всей
- 79. Основные положения метода МО – в образовании МО могут участвовать АО, имеющие сходную симметрию и близкую
- 80. По аналогии с атомными s-, p-, d-, f-орбиталями молекулярные орбитали обозначают греческими буквами σ-, π-, δ-,
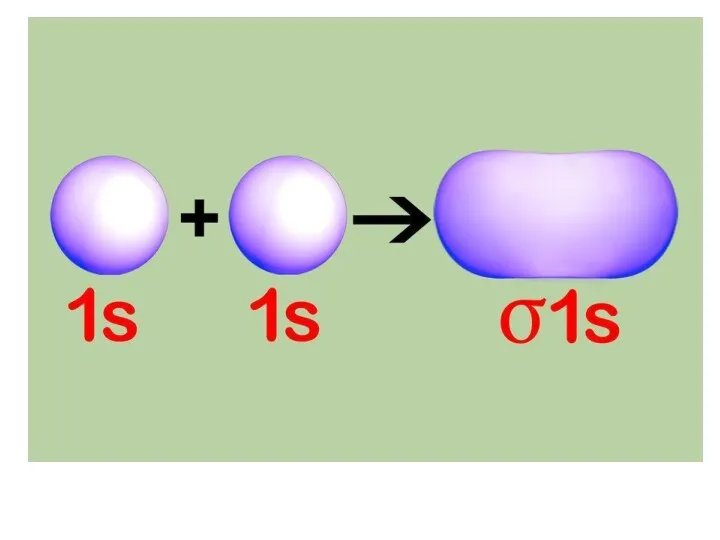
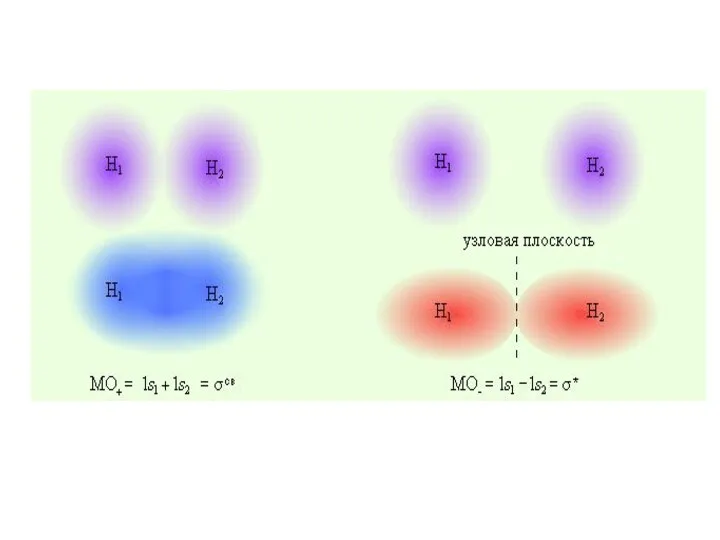
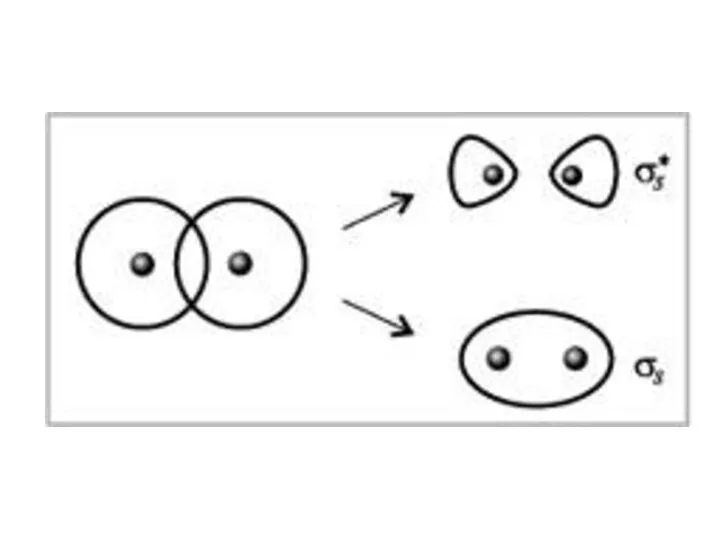
- 81. В методе МО образование молекулярных орбиталей рассматривается как результат сложения и вычитания комбинируемых АО. Молекулярная орбиталь,
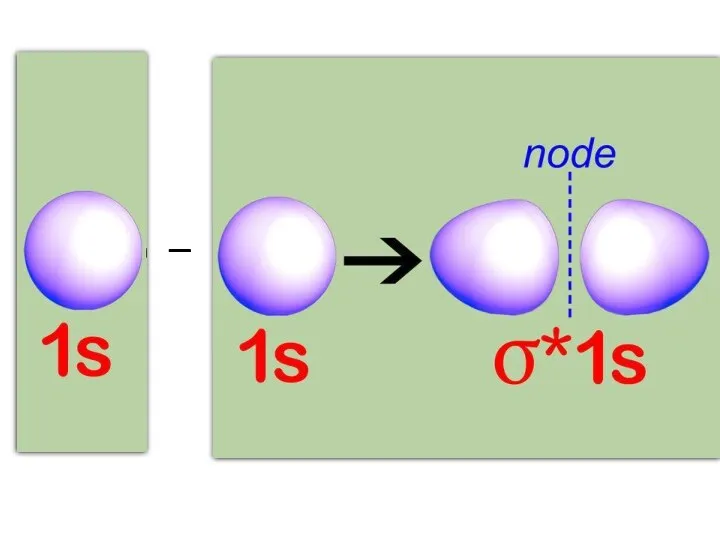
- 82. Молекулярная орбиталь, возникающая в результате вычитания АО, отвечает более высокому значению энергии, чем сумма энергий исходных
- 84. –
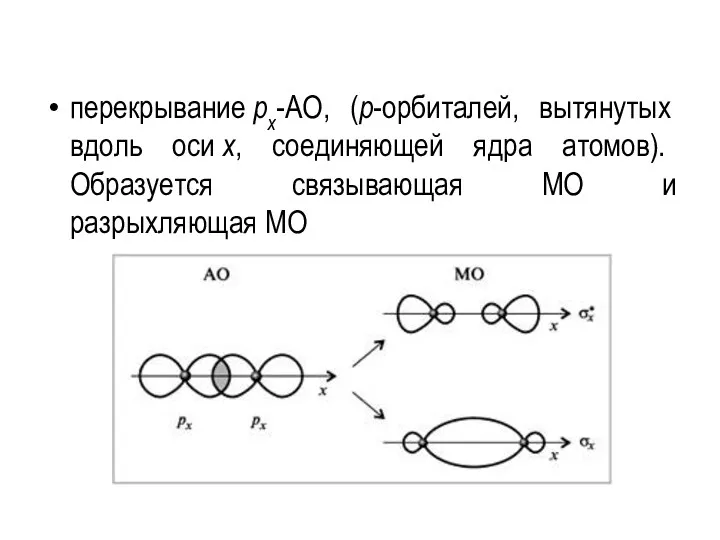
- 87. перекрывание рх-АО, (р-орбиталей, вытянутых вдоль оси х, соединяющей ядра атомов). Образуется связывающая МО и разрыхляющая МО
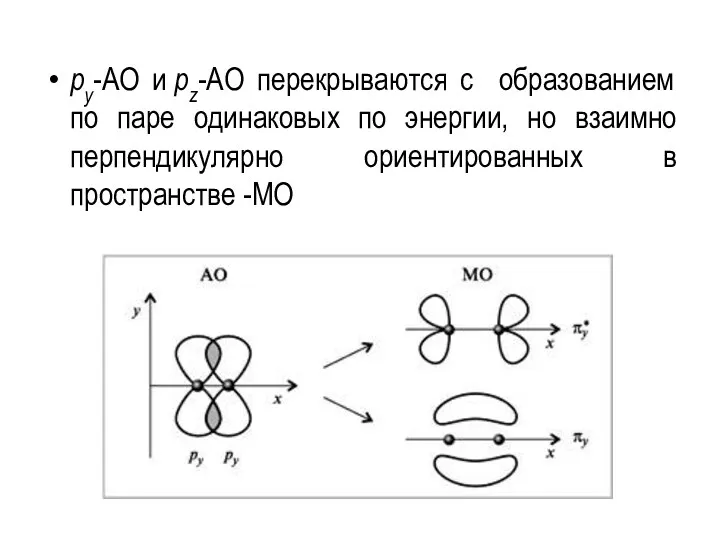
- 88. py-АО и pz-АО перекрываются с образованием по паре одинаковых по энергии, но взаимно перпендикулярно ориентированных в
- 89. Образование молекулярных орбиталей из атомных изображают схематически в виде энергетических диаграмм. Рассмотрим построение такой энергетической диаграммы
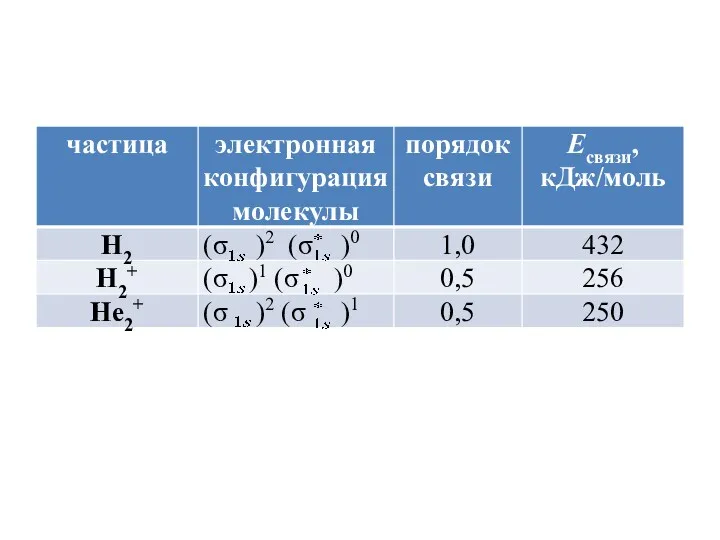
- 91. Устойчивая частица (молекула, ион) образуется в случае, если сумма электронов, расположенных на связывающих МО, превышает сумму
- 92. Если порядок связи = 0, то молекула не образуется. Порядок связи может принимать как целые, так
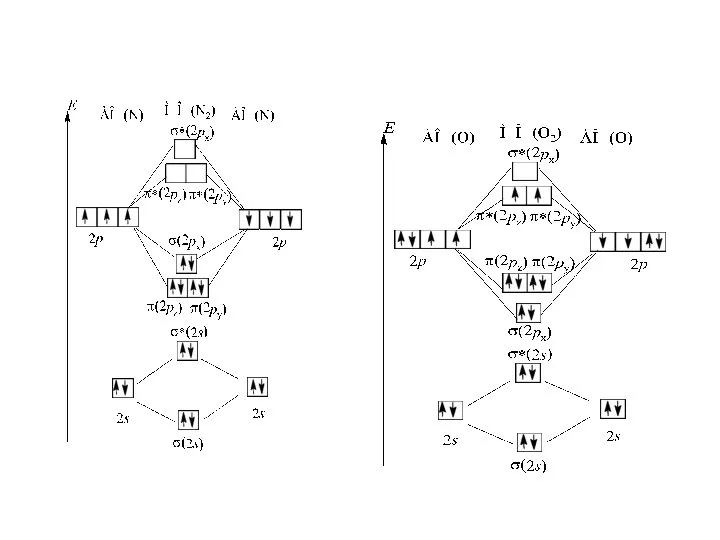
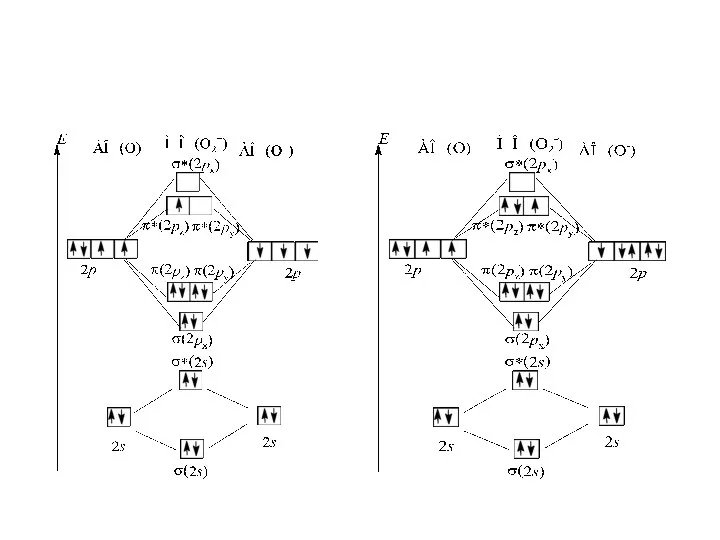
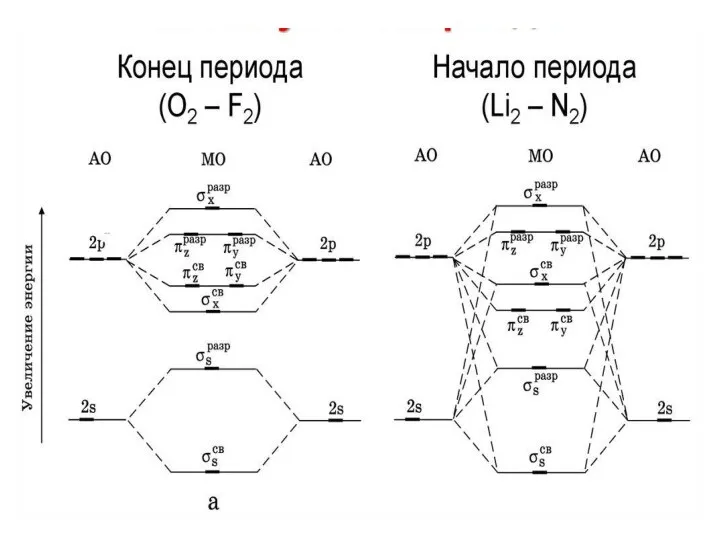
- 94. молекулярные орбитали двухатомных гомоядерных молекул элементов II периода по энергии располагаются следующим образом: а) для молекул
- 97. Электронная конфигурация молекулярного иона O : (σ )2 (σ )2 (σ )2(π )2(π )2 (π )0
- 98. Парамагнетизм кислорода
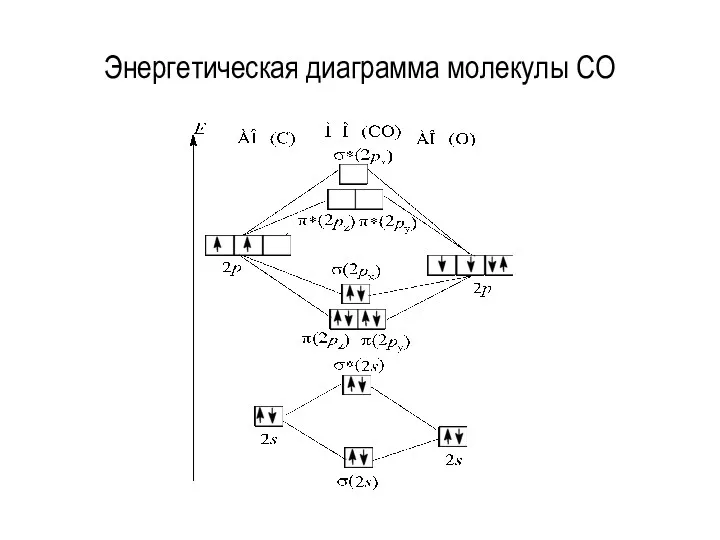
- 99. Энергетическая диаграмма молекулы CO
- 106. Пример 1. Молекула BF3. Число валентных электронов 3. Неподелённых электронных пар у атома бора нет (m
- 107. Пример 2. Молекула SnCl2. Число валентных электронов у атома олова = 4. Число неподеленных электронных пар:
- 108. Пример 3. Молекула XeF4. Число валентных электронов у атома ксенона = 8. Число неподелённых электронных пар:
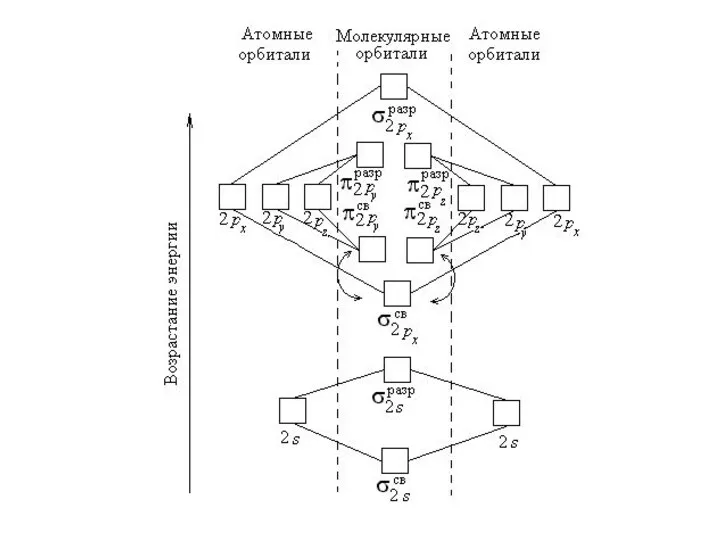
- 109. Пример 4. Молекула SO2. Число валентных электронов у атома серы = 6. Молекула содержит две π-связи.
- 110. Поскольку неподеленная электронная пара образует более размытое электронное облако, чем общая (обобществленная, связывающая), поэтому она занимает
- 112. Скачать презентацию
































![AX2E0 BeГ2,CO2, N2O, [Ag(NH3)2]+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/599825/slide-59.jpg)

![AX4E0 CH4, CГ4, SiO , NOF3, SO , ClO , Ni(CO)4, NH4+, [Zn(CN)4]2–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/599825/slide-66.jpg)
![AX6E0 SF6, PF6– , [AlF6]3–, [SiF6]2- [CoF6]3–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/599825/slide-69.jpg)



















 Состав, строение и свойства стекла и хрусталя
Состав, строение и свойства стекла и хрусталя IV группа главная подгруппа
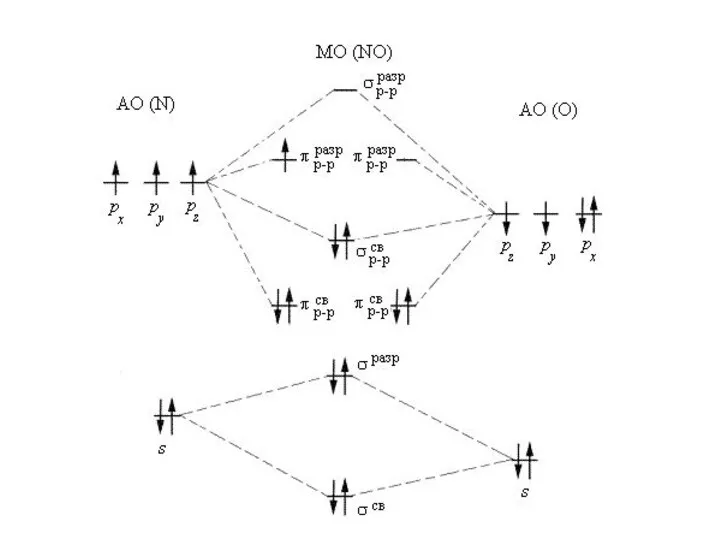
IV группа главная подгруппа Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості (10 клас)
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості (10 клас) Формирование системы знаний о веществе. Лекция 14-15
Формирование системы знаний о веществе. Лекция 14-15 Химическое равновесие
Химическое равновесие Қарапайым кристалдық құрылымдар
Қарапайым кристалдық құрылымдар Полусинтетическое масло
Полусинтетическое масло Химия и здоровье
Химия и здоровье Классификация химических веществ СГС
Классификация химических веществ СГС Химические свойства кислот
Химические свойства кислот Отримання кисню. Властивості кисню
Отримання кисню. Властивості кисню Составление формул химических соединений
Составление формул химических соединений Получение порошков автоклавным осаждением
Получение порошков автоклавным осаждением Інертні гази
Інертні гази Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан
Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан Ауыл шаруашылығындағы пестицидтер
Ауыл шаруашылығындағы пестицидтер Хлороводород и соляная кислота
Хлороводород и соляная кислота Карбонові кислоти. Хімія. 9 клас
Карбонові кислоти. Хімія. 9 клас Композиционные материалы: углепластик, стеклопластик
Композиционные материалы: углепластик, стеклопластик Степень окисления
Степень окисления Химическая взрывчатка
Химическая взрывчатка Вольфрам — химический элемент
Вольфрам — химический элемент Алкены – непредельные углеводороды. Получение, химические свойства и применение
Алкены – непредельные углеводороды. Получение, химические свойства и применение Алкалоиды и принципы их классификации
Алкалоиды и принципы их классификации Алкандар. (қаныққан көмірсутектер. Парафиндер.)
Алкандар. (қаныққан көмірсутектер. Парафиндер.) Технологии получения полимерных нанокомпозитов
Технологии получения полимерных нанокомпозитов Соляная кислота и её соли
Соляная кислота и её соли