Содержание
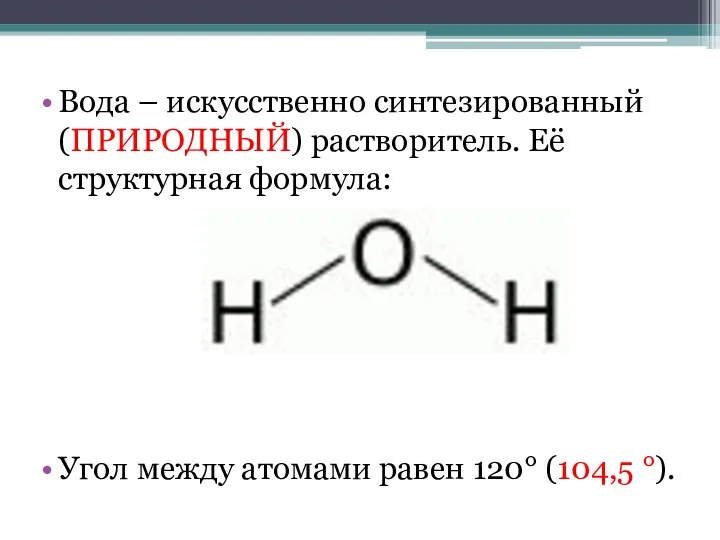
- 2. Вода – искусственно синтезированный (ПРИРОДНЫЙ) растворитель. Её структурная формула: Угол между атомами равен 120° (104,5 °).
- 3. Для воды характерна ковалентная неполярная (ПОЛЯРНАЯ) химическая связь, что обусловлено наличием на внешнем валентном уровне восьми
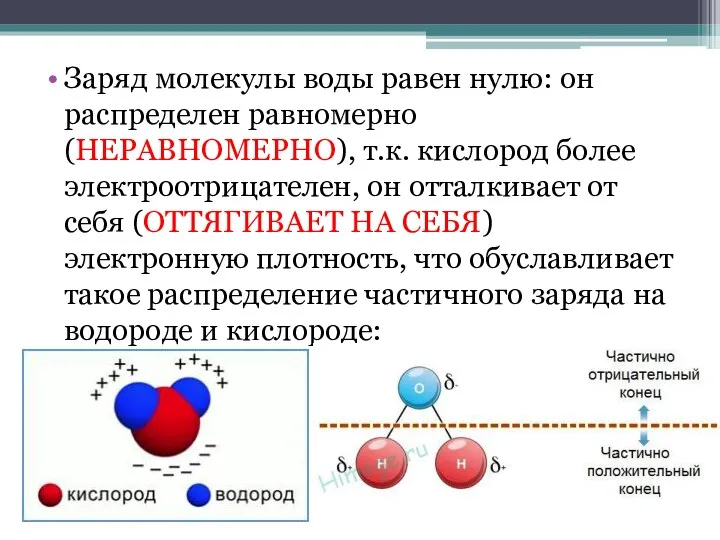
- 4. Заряд молекулы воды равен нулю: он распределен равномерно (НЕРАВНОМЕРНО), т.к. кислород более электроотрицателен, он отталкивает от
- 5. Вода – неполярный (ПОЛЯРНЫЙ) растворитель, она хорошо растворяет неполярные (ПОЛЯРНЫЕ) соединения по принципу «подобное растворяется в
- 6. Стоит также отметить, что при растворении веществ в воде происходит распад на составляющие части исходного соединения
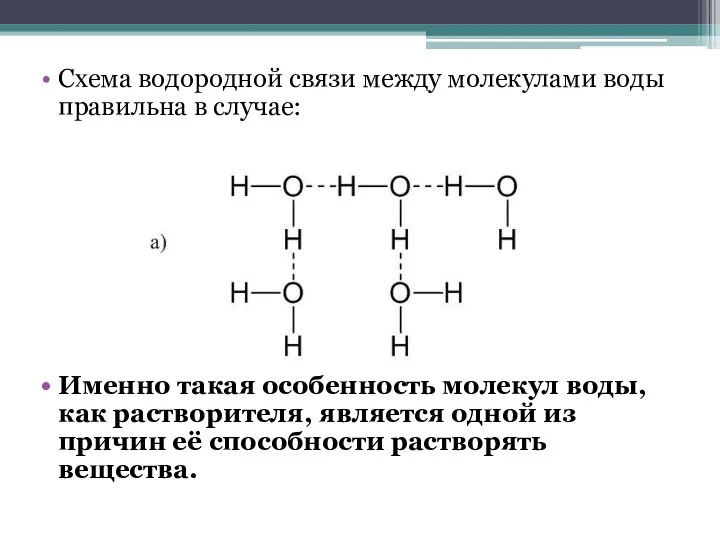
- 7. Схема водородной связи между молекулами воды правильна в случае: Именно такая особенность молекул воды, как растворителя,
- 8. Растворимость, её зависимость от разных факторов. Насыщенные и ненасыщенные растворы.
- 9. Не все вещества одинаково растворяются в воде:
- 10. Количественно способность растворяться в воде определяется физической величиной – растворимостью. Растворимость – это физическая величина, которая
- 11. По растворимости вещества делятся: Хорошо растворимые в 100г воды растворяется больше 1г вещества (щелочи, многие соли,
- 12. Абсолютно нерастворимых веществ не существует
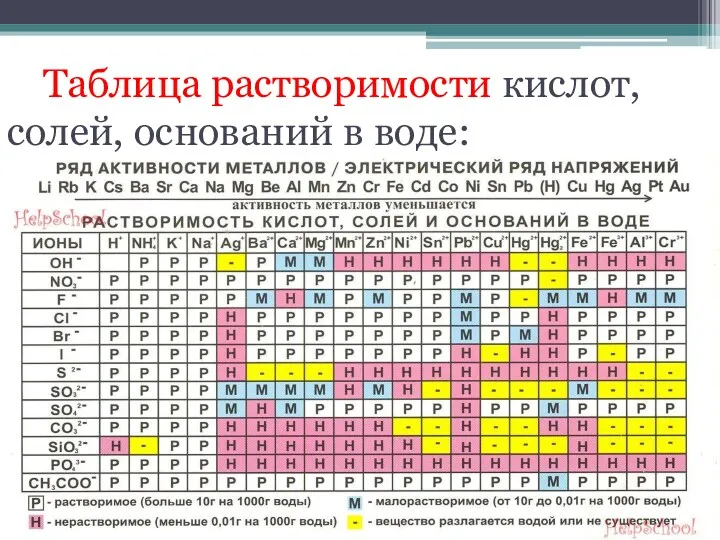
- 13. Таблица растворимости кислот, солей, оснований в воде:
- 14. Эмпирическое правило для определения качественной растворимости:
- 15. Факторы, влияющие на растворимость: Природа растворенного вещества Природа растворителя Температура Давление Физическое состояние, наличие в растворителе
- 16. Факторы, влияющие на растворимость: Механическое воздействие на компоненты раствора– измельчение, перемешивание.
- 17. Факторы, влияющие на растворимость: Хлорид кальция CaCl2 (в 100г H2O больше 1г вещества) Гидроксид кальция Ca(OH)2
- 18. Факторы, влияющие на растворимость: Растворимость веществ зависит от природы растворителя. Растворение медного купороса в спирте Растворение
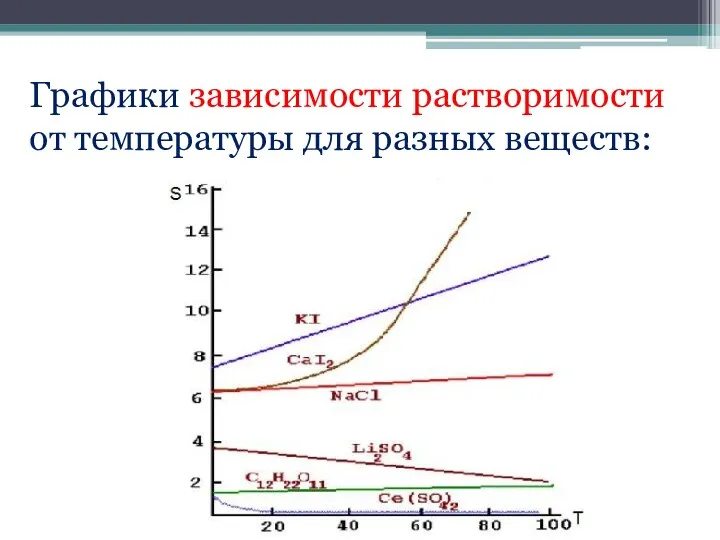
- 19. Факторы, влияющие на растворимость: Растворимость веществ зависит от температуры.
- 20. Факторы, влияющие на растворимость: Растворимость веществ зависит от давления.
- 21. Графики зависимости растворимости от температуры для разных веществ:
- 22. Раствор, в котором содержание растворённого вещества меньше растворимости при данной температуре, называется ненасыщенным. Раствор, в котором
- 23. Ненасыщенные растворы Концентриро-ванные растворы Разбавленные растворы
- 24. Раствор, в котором содержание растворённого вещества меньше растворимости при данной температуре, называется ненасыщенным. Раствор, в котором
- 25. Кристаллизация пересыщенного раствора:
- 26. Правильны ли утверждения: Количественная способность растворяться в воде определяется растворимостью. Растворимость всех веществ почти одинакова. Абсолютно
- 27. Как называется раствор если: при данной t° вещество больше не растворяется? при данной t° вещество ещё
- 29. Скачать презентацию




















 Ionimplantáció. Monolit technika előadás
Ionimplantáció. Monolit technika előadás Стоматологические материалы на основе полимеров
Стоматологические материалы на основе полимеров Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Теория электролитической диссоциации
Теория электролитической диссоциации Степень окисления – Условный заряд атомов химического элемента в соединении
Степень окисления – Условный заряд атомов химического элемента в соединении Химические свойства полимеров
Химические свойства полимеров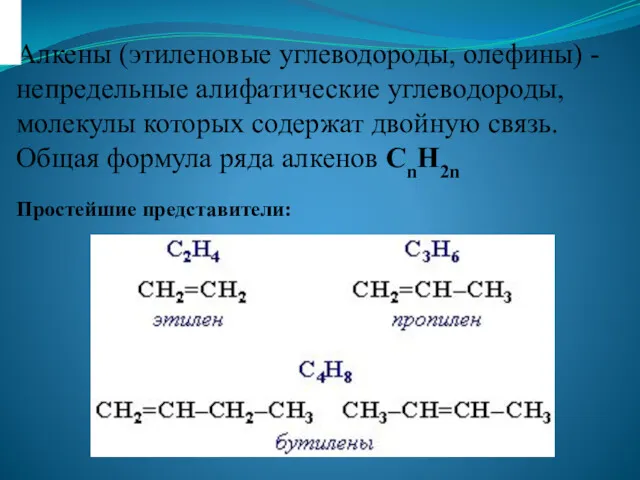 Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Кремний и его соединения для 11 класса
Кремний и его соединения для 11 класса Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена Галогены в Периодической системе Д.И. Менделеева
Галогены в Периодической системе Д.И. Менделеева Массовая доля растворенного вещества в растворе
Массовая доля растворенного вещества в растворе Механизмы органических реакций. (Лекция 2)
Механизмы органических реакций. (Лекция 2) Періодична система хімічних елементів
Періодична система хімічних елементів Коррозия металлов
Коррозия металлов Основные понятия органической химии. Лекция № 1
Основные понятия органической химии. Лекция № 1 Номенклатура алканов
Номенклатура алканов Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты
Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты Жёсткость воды
Жёсткость воды Күрделі эфирлер
Күрделі эфирлер Разбор заданий #ОВРновый, #реакционно и #соточка
Разбор заданий #ОВРновый, #реакционно и #соточка Боевые отравляющие вещества
Боевые отравляющие вещества Атом. Модели строения атома
Атом. Модели строения атома Металловедение. Классификация металлов
Металловедение. Классификация металлов Алотропні форми Карбону
Алотропні форми Карбону Промышленные катализаторы
Промышленные катализаторы Конструкционные полимеры: классификация, достижения и проблемы
Конструкционные полимеры: классификация, достижения и проблемы Периодический закон и периодическая система элементов Д.И. Менделеева
Периодический закон и периодическая система элементов Д.И. Менделеева Соли аммония
Соли аммония