Содержание
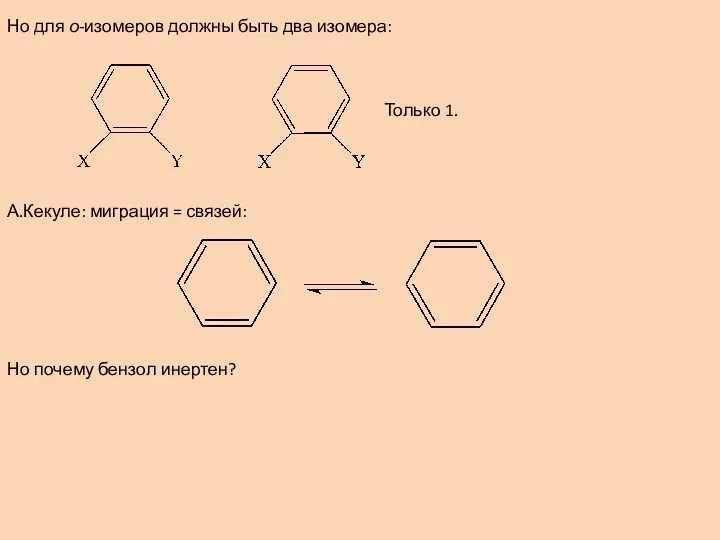
- 2. Но для о-изомеров должны быть два изомера: Только 1. А.Кекуле: миграция = связей: Но почему бензол
- 3. Появились варианты структур: Призман Ладенбурга Центрический бензол Клауса Бицикло [2.2.0] гексадиен 2,5 (Дьюар) Современный подход –
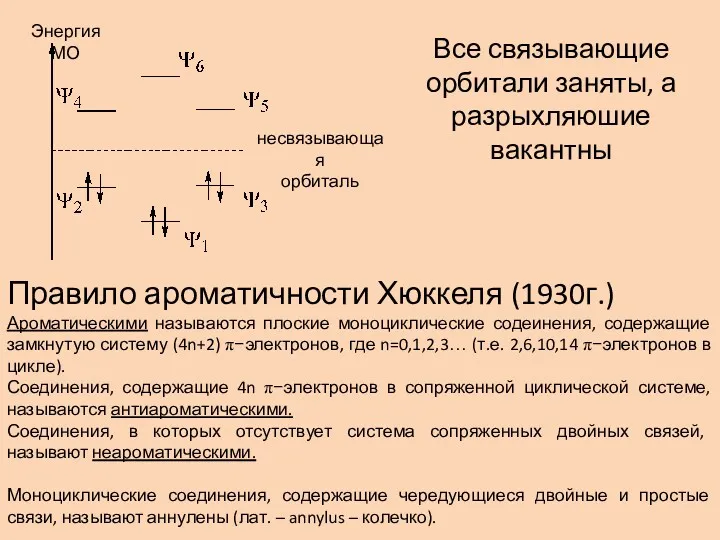
- 4. Энергия МО несвязывающая орбиталь Все связывающие орбитали заняты, а разрыхляюшие вакантны Правило ароматичности Хюккеля (1930г.) Ароматическими
- 5. [6]аннулен Циклогексатриен Ароматичен 6 π−электронов [8]аннулен Циклооктатриен антиароматичен 8π−электронов [4]аннулен Циклобутадиен антиароматичен 4π−электрона Ароматическими являются плоские
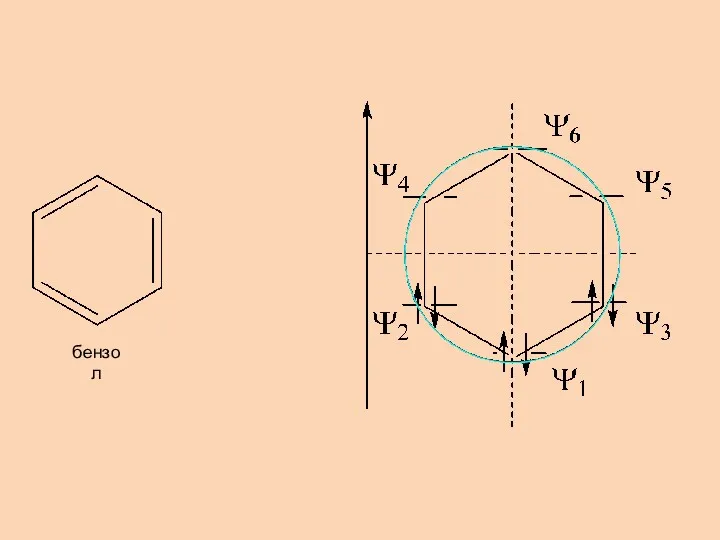
- 6. бензол
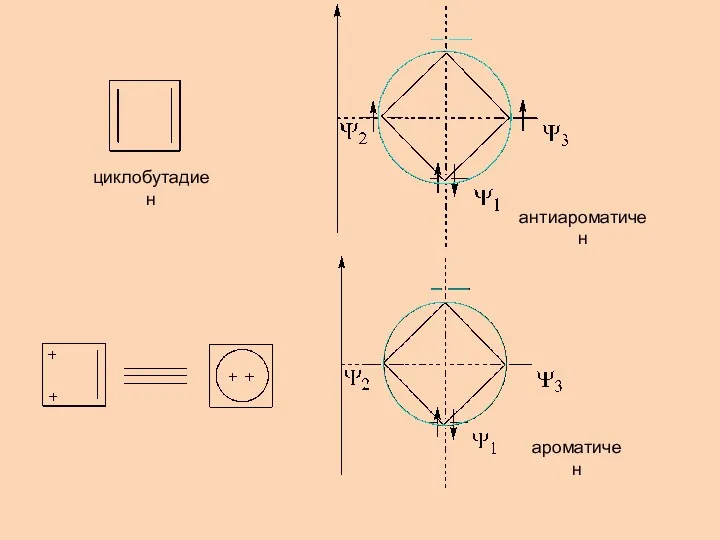
- 7. циклобутадиен антиароматичен ароматичен
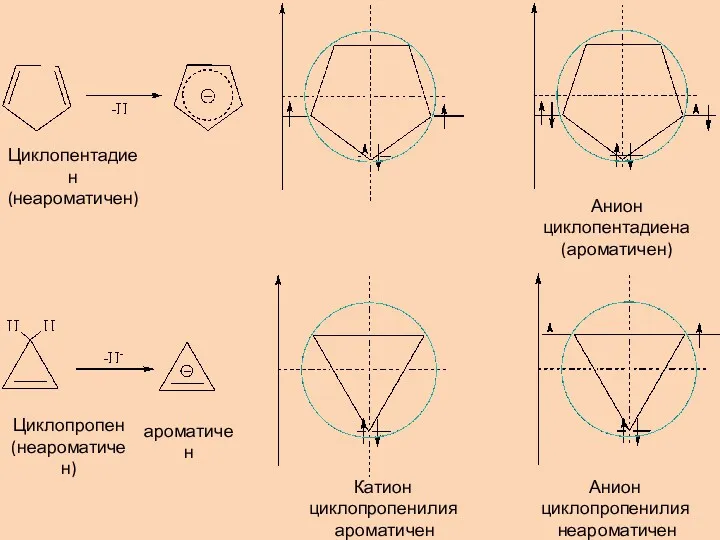
- 8. Циклопентадиен (неароматичен) Анион циклопентадиена (ароматичен) Циклопропен (неароматичен) ароматичен Катион циклопропенилия ароматичен Анион циклопропенилия неароматичен
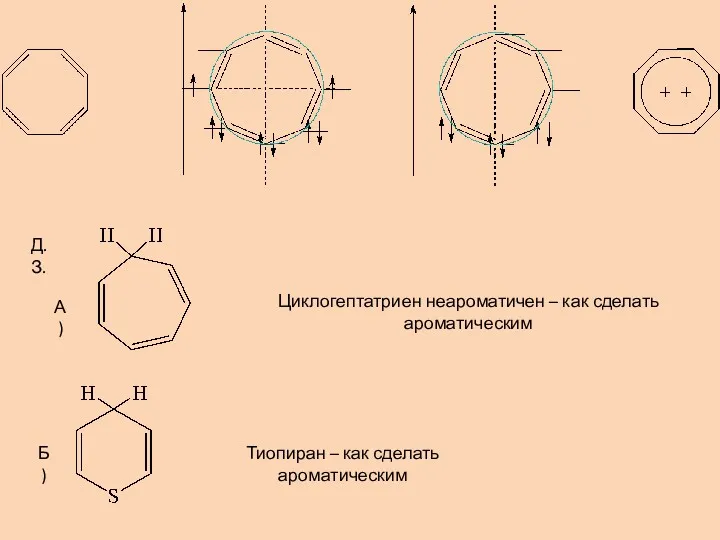
- 9. Д.З. Циклогептатриен неароматичен – как сделать ароматическим Тиопиран – как сделать ароматическим А) Б)
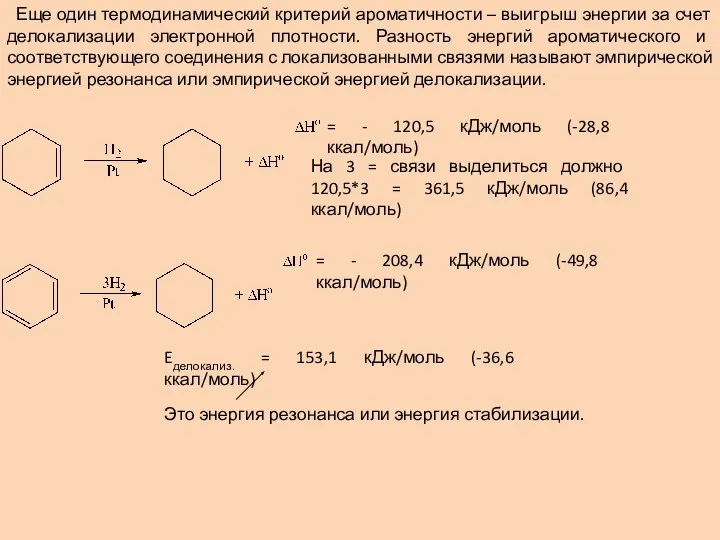
- 10. Еще один термодинамический критерий ароматичности – выигрыш энергии за счет делокализации электронной плотности. Разность энергий ароматического
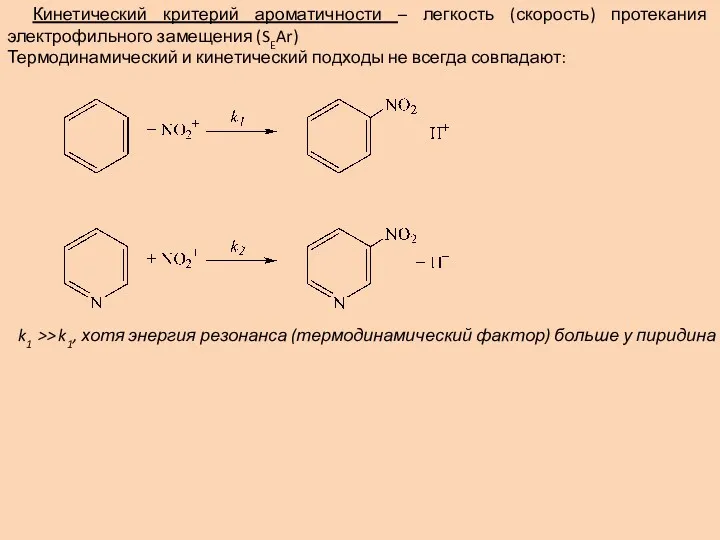
- 11. Кинетический критерий ароматичности – легкость (скорость) протекания электрофильного замещения (SEAr) Термодинамический и кинетический подходы не всегда
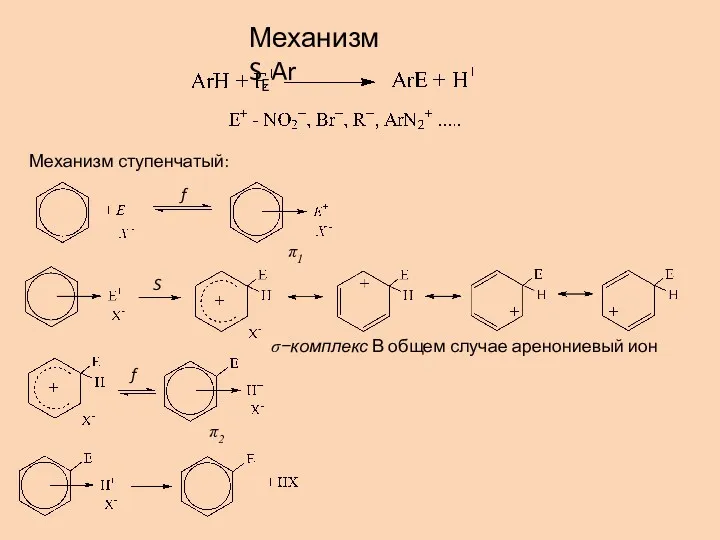
- 12. Механизм ступенчатый: Механизм SEAr В общем случае аренониевый ион f f S π1 π2 σ−комплекс
- 13. Энергетическая диаграмма реакции: На приведенной диаграмме стадия образования σ−комплекса является лимитирующей Координата реакции E Для веществ,
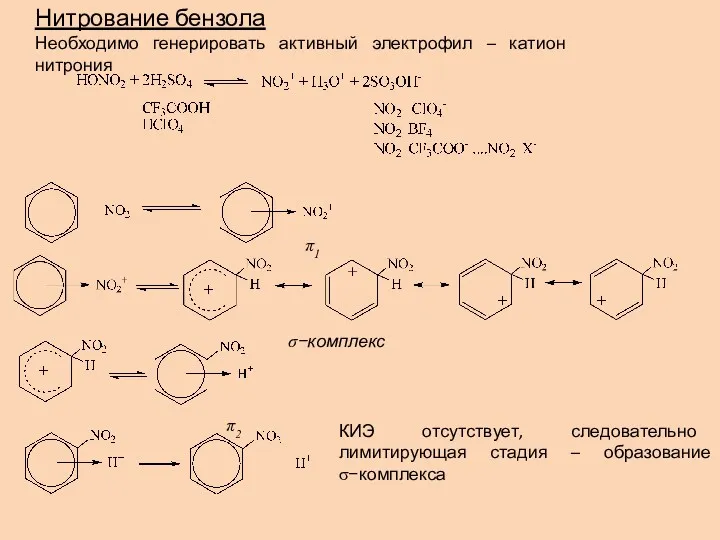
- 14. Нитрование бензола Необходимо генерировать активный электрофил – катион нитрония КИЭ отсутствует, следовательно лимитирующая стадия – образование
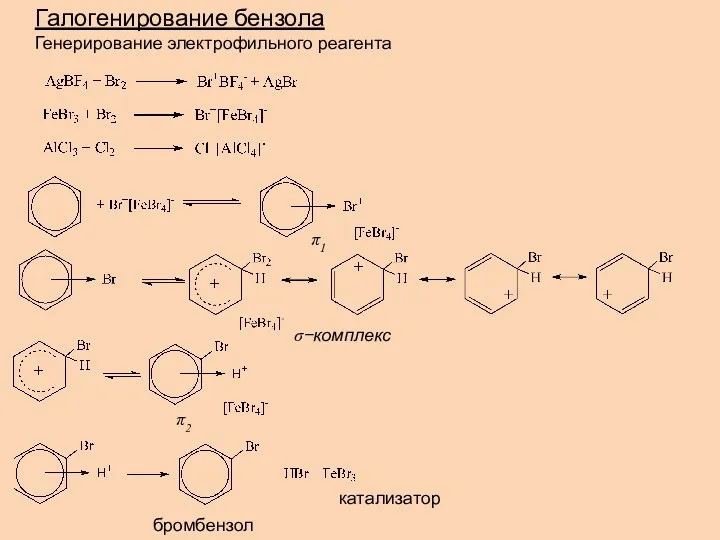
- 15. Галогенирование бензола Генерирование электрофильного реагента катализатор бромбензол π1 π2 σ−комплекс
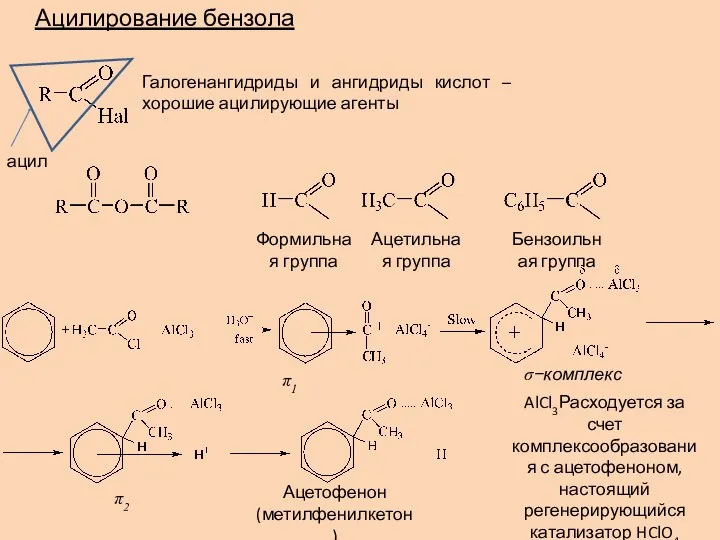
- 16. Ацилирование бензола Галогенангидриды и ангидриды кислот – хорошие ацилирующие агенты Формильная группа Ацетильная группа Бензоильная группа
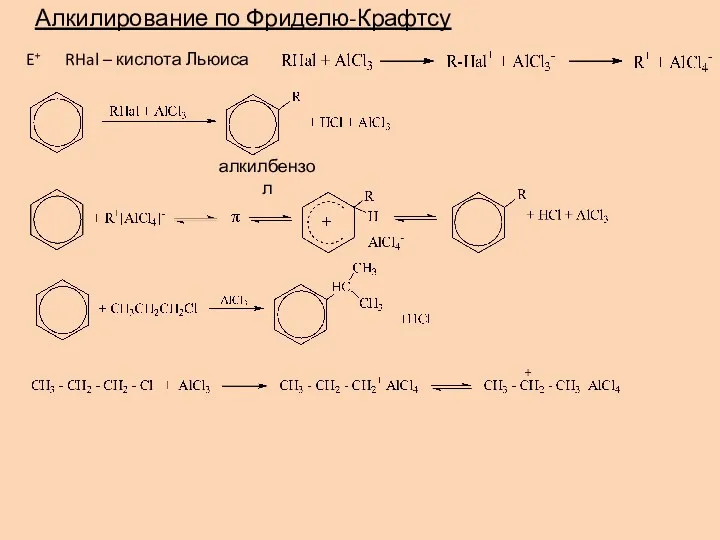
- 17. Алкилирование по Фриделю-Крафтсу E+ RHal – кислота Льюиса алкилбензол
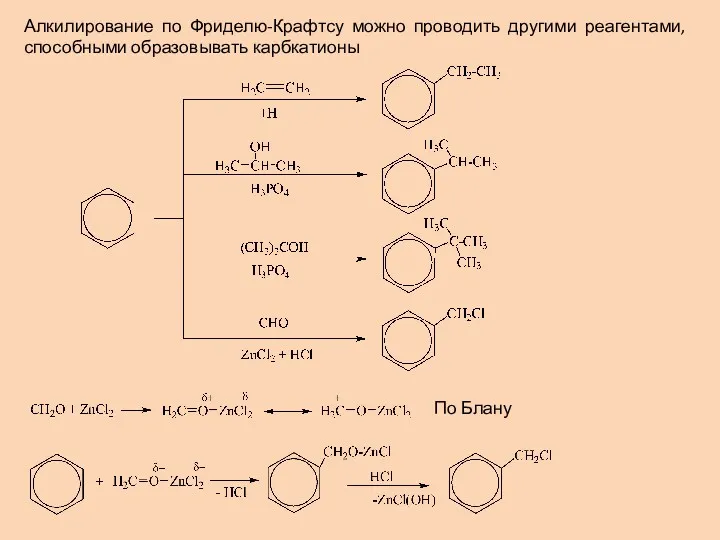
- 18. Алкилирование по Фриделю-Крафтсу можно проводить другими реагентами, способными образовывать карбкатионы По Блану
- 20. Скачать презентацию
![Появились варианты структур: Призман Ладенбурга Центрический бензол Клауса Бицикло [2.2.0]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291992/slide-2.jpg)
![[6]аннулен Циклогексатриен Ароматичен 6 π−электронов [8]аннулен Циклооктатриен антиароматичен 8π−электронов [4]аннулен](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291992/slide-4.jpg)

 Химическая наука и промышленность в годы ВОВ
Химическая наука и промышленность в годы ВОВ Полимерные материалы, пластмассы и изделия из них
Полимерные материалы, пластмассы и изделия из них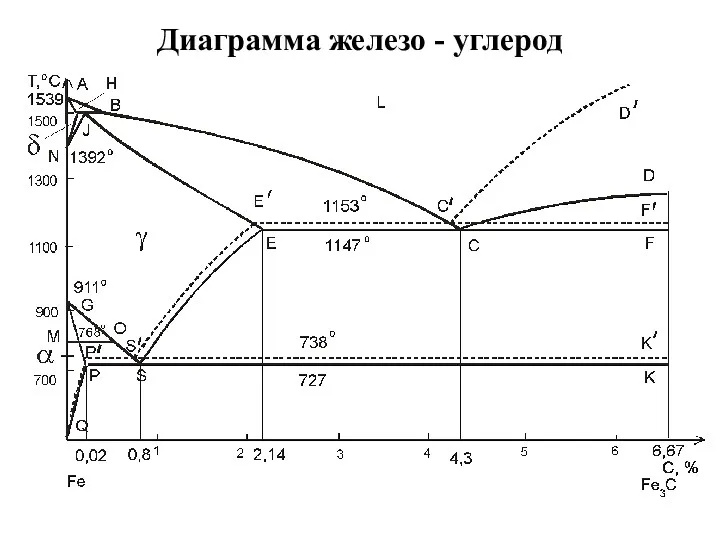 Диаграмма железо - углерод
Диаграмма железо - углерод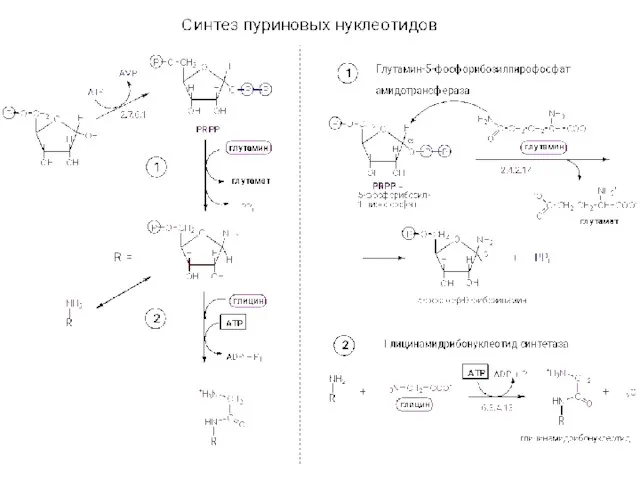 Синтез нуклеотидов
Синтез нуклеотидов Щелочные металлы
Щелочные металлы Зерттеу әдістері
Зерттеу әдістері ЕГЭ по химии. Анализ результатов решения (часть 2)
ЕГЭ по химии. Анализ результатов решения (часть 2) Хром. Физические и химические свойства
Хром. Физические и химические свойства Кислые породы повышенной щелочности и щелочные
Кислые породы повышенной щелочности и щелочные Классификация химических реакций по механизму реакции
Классификация химических реакций по механизму реакции Оксиди
Оксиди Щелочные металлы
Щелочные металлы Электролит және бейэлектролит ерітінділердің коллигативті қасие
Электролит және бейэлектролит ерітінділердің коллигативті қасие Беломорская соль, проектная работа
Беломорская соль, проектная работа Показатели жесткости воды
Показатели жесткости воды Химическая технология органических веществ
Химическая технология органических веществ Нахождение металлов в природе. Общие способы получения металлов. 9 класс
Нахождение металлов в природе. Общие способы получения металлов. 9 класс Генетическая связь между классами веществ
Генетическая связь между классами веществ Изомеры и гомологи
Изомеры и гомологи Кремний және оның қосылыстары
Кремний және оның қосылыстары Химическая связь в твердых веществах и жидкостях
Химическая связь в твердых веществах и жидкостях Фосфор и его соединения (9 класс)
Фосфор и его соединения (9 класс) Органические соединения амины
Органические соединения амины Классификация веществ
Классификация веществ История открытия периодической системы химических элементов Д.И. Менделеева
История открытия периодической системы химических элементов Д.И. Менделеева Жуғыш заттар және жуғыш әсері. 2 Лекция
Жуғыш заттар және жуғыш әсері. 2 Лекция Рідкі кристали та їх властивості
Рідкі кристали та їх властивості Валентність хімічних елементів
Валентність хімічних елементів