Содержание
- 2. Отрывок из произведения Артура Конан Дойля «Собака Баскервилей». «…Да. Это была собака, огромная, черная, как смоль.
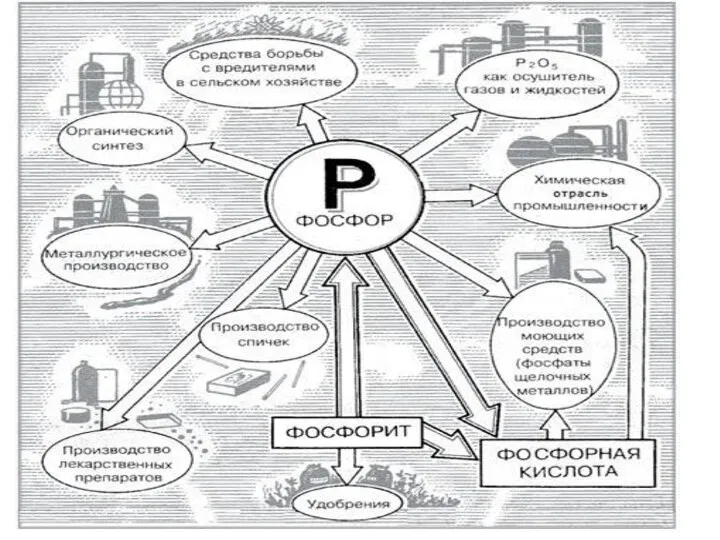
- 3. «Фосфор и его соединения».
- 4. Девиз нашего урока «Фосфор-элемент жизни и мысли» (академик А.Е.Ферсман)
- 5. Охарактеризуйте фосфор как химический элемент по его положению в периодической системе химических элементов Д.И. Менделеева по
- 6. Элемент VA группы Электронная формула 1s22s22p63s23p3. Валентность: максимальная V. Минимальная III. Наиболее характерные степени окисления: +5,
- 7. Фосфор в свободном состоянии в природе не встречается. Он находится не менее чем в 190 минералах,
- 8. Получение. В промышленности : Фосфор получают из апатитов и фосфоритов, нагревая их в электрической печи без
- 9. Аллотропия - способность атома одного химического элемента образовывать простые вещества разного состава или разного строения Что
- 10. Аллотропные модификации фосфора 560 °C 500 °C В атм. СО 10 8,3·10 Па t без доступа
- 11. Химические свойства фосфора:
- 12. Химические свойства. Как окислитель Взаимодействует с металлами с образованием ________: Р + Са → P +
- 13. Химические свойства. Как окислитель Взаимодействует с металлами с образованием фосфидов: 2Р + 3Са → Са3Р2 (фосфид
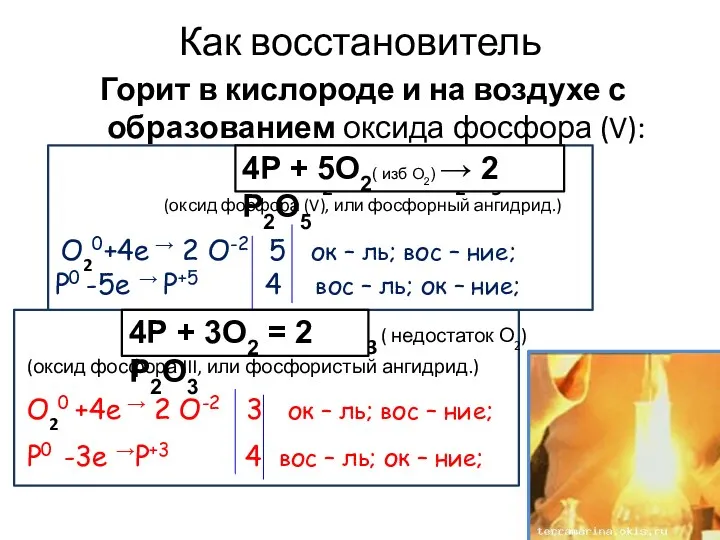
- 14. Как восстановитель Горит в кислороде и на воздухе с образованием оксида фосфора (V): Р + О2(
- 15. Видеофрагмент «сравнение температур воспламенения фосфора»
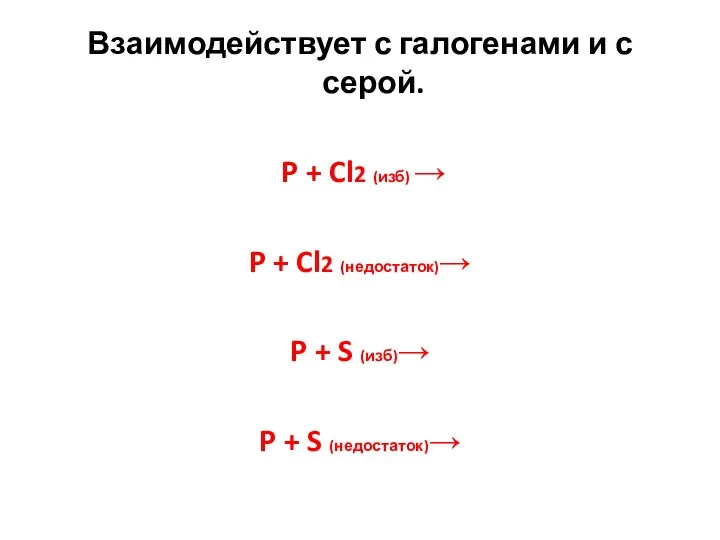
- 16. Взаимодействует с галогенами и с серой. P + Cl2 (изб) → P + Cl2 (недостаток)→ P
- 17. Взаимодействует с галогенами и с серой. 2P + 5Cl2 (изб) → 2PCl5 2P + 3Cl2 (недостаток)→
- 18. С водородом фосфор не соединяется.
- 19. Взаимодействие со сложными веществами
- 20. Взаимодействие со щелочами В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования: P4 + KOH
- 21. Сильные окислители превращают фосфор в фосфорную кислоту: P + HNO3 (конц) → H3PO4 + NO2 ↑
- 22. Сильные окислители превращают фосфор в фосфорную кислоту: 3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO
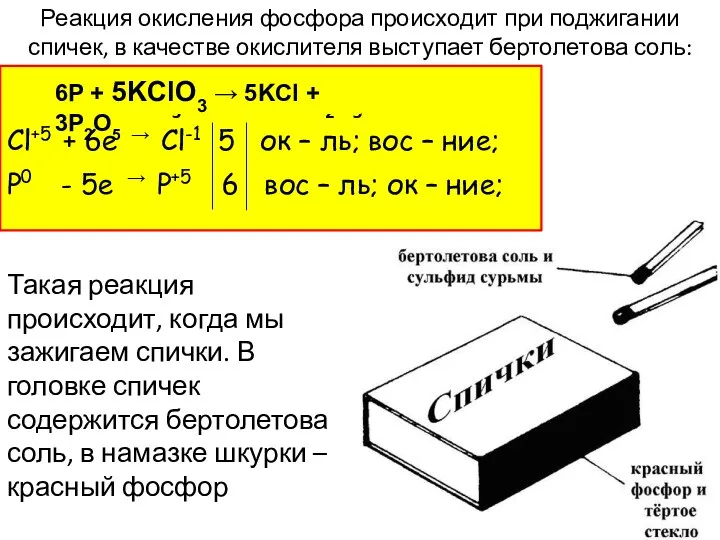
- 23. P + KClO3 → KCl + P2O5 Реакция окисления фосфора происходит при поджигании спичек, в качестве
- 24. Соединения фосфора РН3 – фосфин. Бесцветный, Ядовитый газ, С чесночным запахом, Легко самовоспламеняется на воздухе. Получение:
- 25. Химические свойства PH3 : Фосфин при температуре около 150 ºС самовоспламеняется на воздухе. 2PH3 + 4O2
- 26. Р2О5 – оксид фосфора (V), или фосфорный ангидрид. Белый порошок, Без запаха, Хорошо растворяется в воде,
- 27. С чем кислотный оксид Р2О5 будет взаимодействовать :
- 28. С основными оксидами Р2О5 + 3 СаО = Са3 (РО4)2 Со щелочами Р2О5 + 6 Nа
- 29. При взаимодействии в избытке Р2О5 со щелочами могут образовываться не только средние, но и кислые соли:
- 30. Н3РО4
- 31. 1. Водный раствор кислоты изменяет окраску индикаторов. Диссоциация происходит ступенчато: Н3РО4———>Н++Н2РО4- Н2РО-4———> Н++НРО42- НРО42- ———> Н++РО43-
- 32. 2. Реагирует с металлами, расположенными в вытеснительном ряду до водорода: 6Nа+2Н3РО4 ———>2Nа3РО4+ЗН2 3. Реагирует с основными
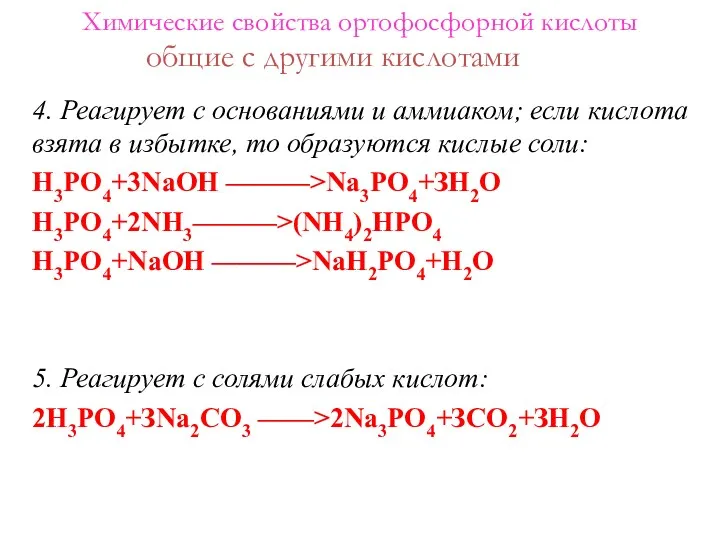
- 33. 4. Реагирует с основаниями и аммиаком; если кислота взята в избытке, то образуются кислые соли: Н3РО4+3NaОН
- 34. специфические Химические свойства ортофосфорной кислоты 1.При нагревании постепенно превращается в метафосфорную кислоту: 2Н3Р04 ———>Н4Р207+Н20 (двуфосфорная кислота)
- 35. Качественная реакция на фосфат-ион РО43- Н3РО4+ЗАgNО3———> Ag3P04+3HN03 желтый осадок РО43- + 3 Ag+ = Ag3РО4 ↓
- 36. Соли фосфорной кислоты 3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O Фосфаты являются хорошими удобрениями, которые повышают
- 37. Применение
- 39. Скачать презентацию































 Чистые вещества и смеси
Чистые вещества и смеси Мыло и синтетические моющие средства
Мыло и синтетические моющие средства Материаловедение. Лекция 1
Материаловедение. Лекция 1 Залізо. Фізичні та хімічні властивості
Залізо. Фізичні та хімічні властивості Почему мыло пенится
Почему мыло пенится Алюминий
Алюминий Гидрогеохимия урана и тория
Гидрогеохимия урана и тория Природные источники углеводородов
Природные источники углеводородов Химические волокна (7 класс)
Химические волокна (7 класс) Аргентум, или серебро
Аргентум, или серебро Алкины. Физические и химические свойства
Алкины. Физические и химические свойства Спирты: общая характеристика
Спирты: общая характеристика Бескислородные керамические материалы
Бескислородные керамические материалы Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Процессы, проходящие в растворах (продолжение темы)
Процессы, проходящие в растворах (продолжение темы) The Molecules of Life
The Molecules of Life Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья
Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья Электродные процессы
Электродные процессы Физические и химические свойства алмаза. Алмазная промышленность в России
Физические и химические свойства алмаза. Алмазная промышленность в России Кислоты
Кислоты Вклад ученых-химиков в победу в Великой Отечественной войне
Вклад ученых-химиков в победу в Великой Отечественной войне Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Основні класи неорганічних сполук
Основні класи неорганічних сполук Совершенствование урока химии в условиях ФГОС
Совершенствование урока химии в условиях ФГОС Игра Химические элементы (формулы и названия)
Игра Химические элементы (формулы и названия) Химическая кинетика и катализ
Химическая кинетика и катализ Органічні сполуки. 3D моделі органічних сполук
Органічні сполуки. 3D моделі органічних сполук