Содержание
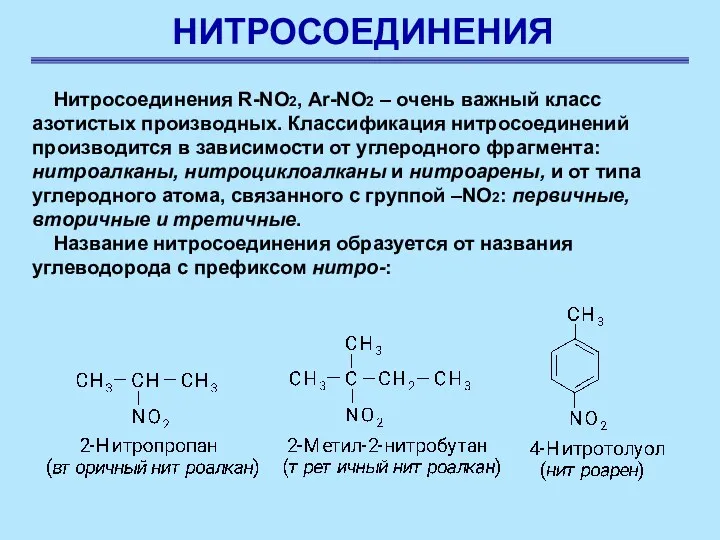
- 2. НИТРОСОЕДИНЕНИЯ Нитросоединения R-NO2, Ar-NO2 – очень важный класс азотистых производных. Классификация нитросоединений производится в зависимости от
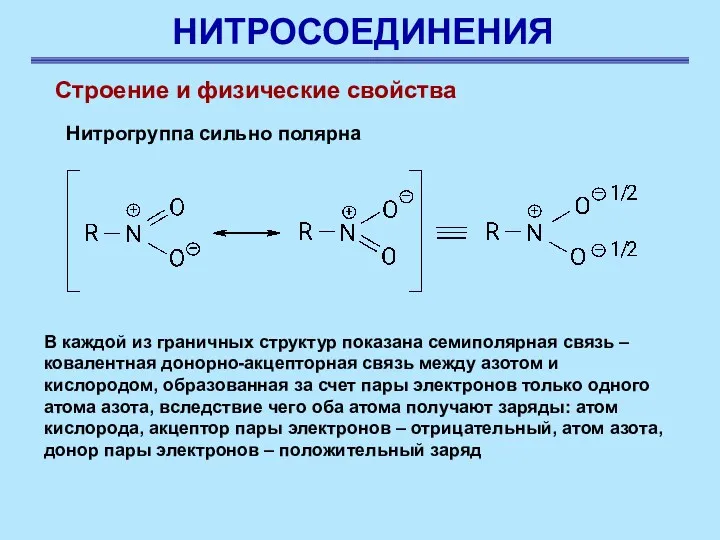
- 3. НИТРОСОЕДИНЕНИЯ Строение и физические свойства Нитрогруппа сильно полярна В каждой из граничных структур показана семиполярная связь
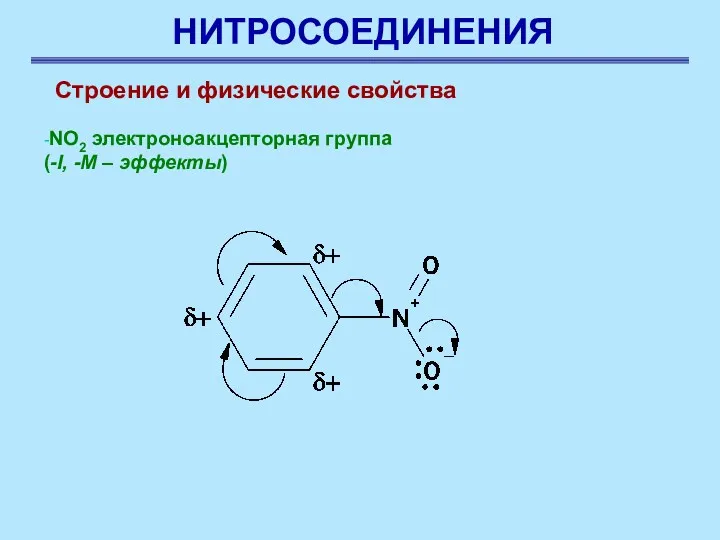
- 4. НИТРОСОЕДИНЕНИЯ Строение и физические свойства -NO2 электроноакцепторная группа (-I, -M – эффекты)
- 5. НИТРОСОЕДИНЕНИЯ Строение и физические свойства Нитроалканы представляют собой бесцветные жидкости с высокими для их молекулярных масс
- 6. НИТРОСОЕДИНЕНИЯ Химические свойства Термодинамическая неустойчивость нитросоединений Молярная теплота разложения нитрометана около 270 кДж/моль СН3NO2→ 1/2 N2
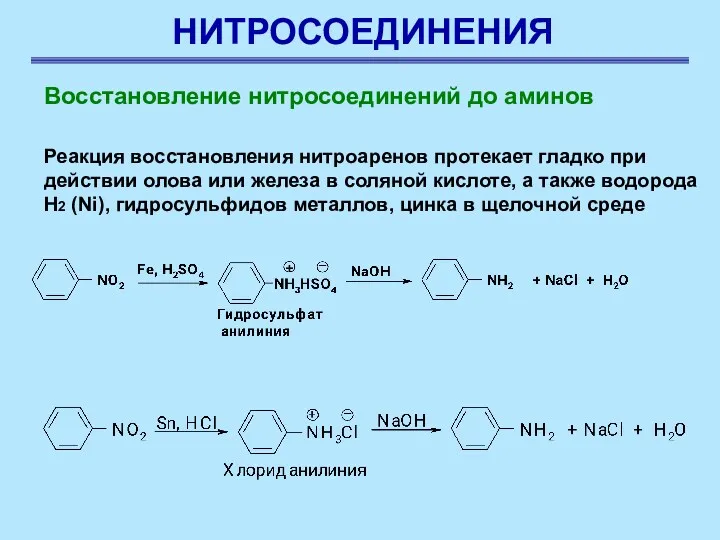
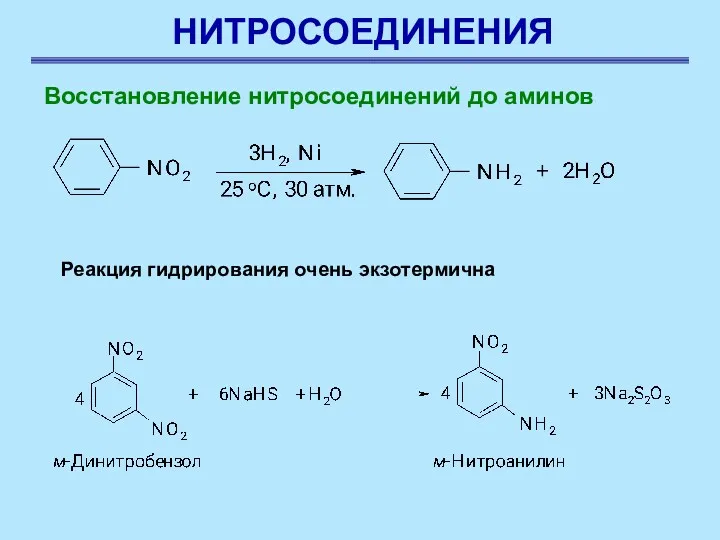
- 7. НИТРОСОЕДИНЕНИЯ Восстановление нитросоединений до аминов Восстановление нитросоединений до аминов – наиболее важная реакция для синтеза азотсодержащих
- 8. НИТРОСОЕДИНЕНИЯ Восстановление нитросоединений до аминов Реакция восстановления нитроаренов протекает гладко при действии олова или железа в
- 9. НИТРОСОЕДИНЕНИЯ Восстановление нитросоединений до аминов Реакция гидрирования очень экзотермична
- 10. НИТРОСОЕДИНЕНИЯ ЗИНИН Николай Николаевич (25.VIII.1812–18.II.1880) академик, возглавлял кафедру общей химии Медико-хирургической академии в Петербурге, организатор и
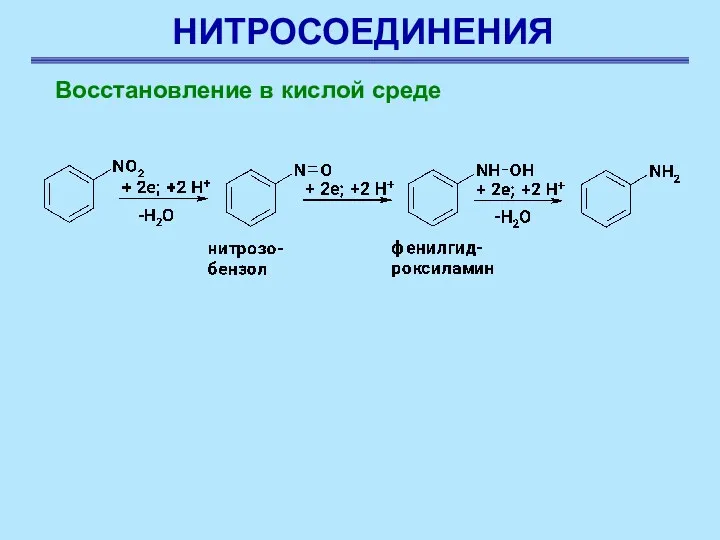
- 11. НИТРОСОЕДИНЕНИЯ Восстановление в кислой среде
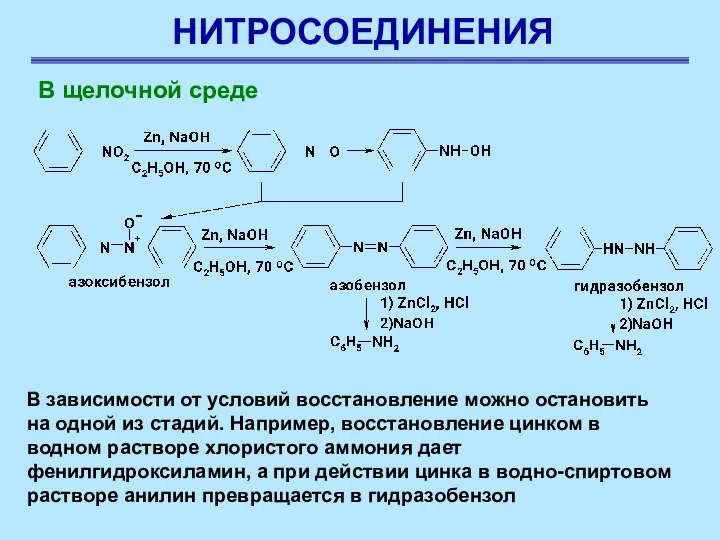
- 12. НИТРОСОЕДИНЕНИЯ В щелочной среде В зависимости от условий восстановление можно остановить на одной из стадий. Например,
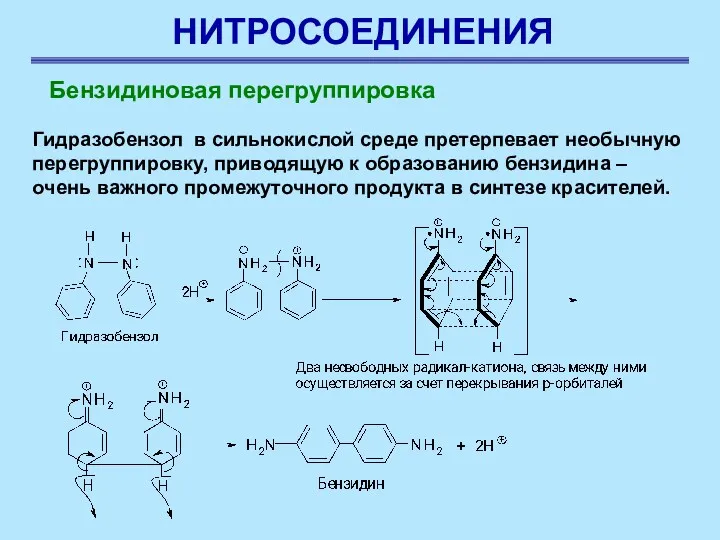
- 13. НИТРОСОЕДИНЕНИЯ Гидразобензол в сильнокислой среде претерпевает необычную перегруппировку, приводящую к образованию бензидина – очень важного промежуточного
- 14. НИТРОСОЕДИНЕНИЯ Реакции с участием α-водородных атомов Нитрометан обладает настолько сильными кислотными свойствами, что способен растворяться в
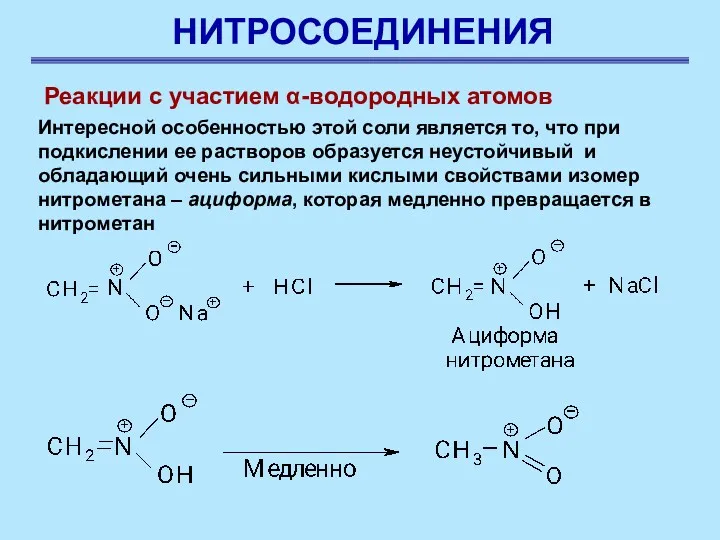
- 15. НИТРОСОЕДИНЕНИЯ Реакции с участием α-водородных атомов Интересной особенностью этой соли является то, что при подкислении ее
- 16. НИТРОСОЕДИНЕНИЯ Реакции с участием α-водородных атомов Первичные и вторичные нитросоединения вступают с карбонильными соединениями в реакции
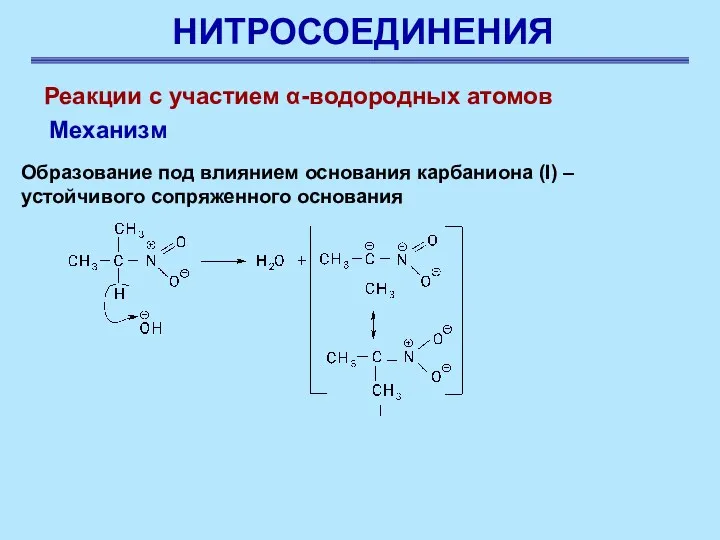
- 17. НИТРОСОЕДИНЕНИЯ Реакции с участием α-водородных атомов Механизм Образование под влиянием основания карбаниона (I) – устойчивого сопряженного
- 18. НИТРОСОЕДИНЕНИЯ Реакции с участием α-водородных атомов Далее происходит взаимодействие муравьиного альдегида с нуклеофилом (I) и образование
- 19. НИТРОСОЕДИНЕНИЯ Реакции с участием α-водородных атомов Механизм Стабилизация промежуточного продукта (II) осуществляется за счет переноса протона
- 20. НИТРОСОЕДИНЕНИЯ Нитрование алканов. Реакция Коновалова Известно несколько способов нитрования алканов. По жидкофазному способу алканы нитруют разбавленной
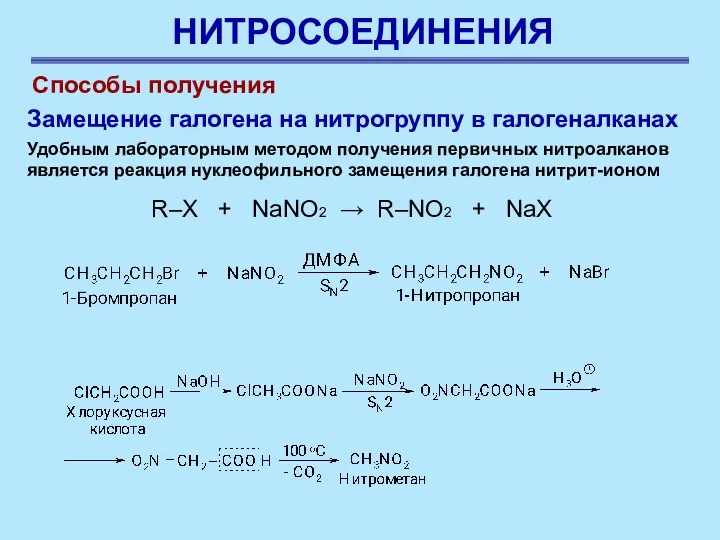
- 21. НИТРОСОЕДИНЕНИЯ R–X + NaNO2 → R–NO2 + NaX Способы получения Замещение галогена на нитрогруппу в галогеналканах
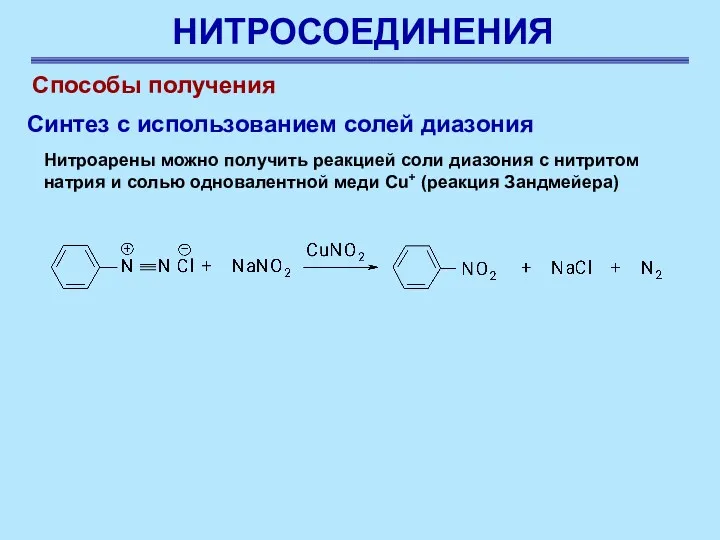
- 22. НИТРОСОЕДИНЕНИЯ Способы получения Нитроарены можно получить реакцией соли диазония с нитритом натрия и солью одновалентной меди
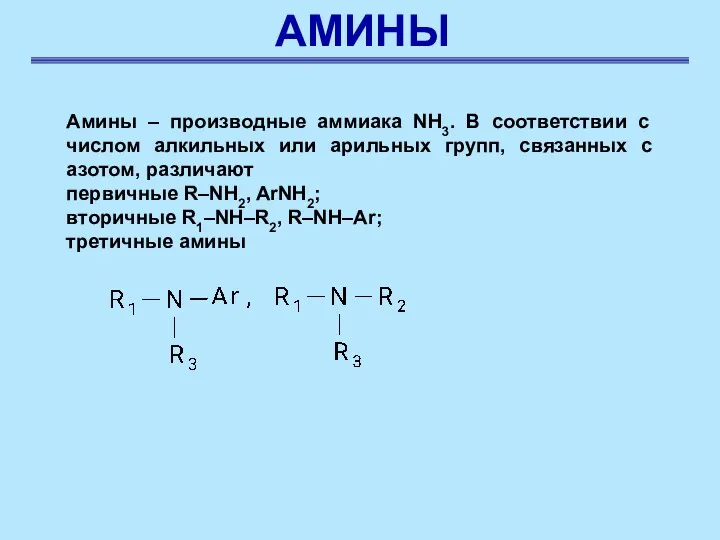
- 23. АМИНЫ Амины – производные аммиака NH3. В соответствии с числом алкильных или арильных групп, связанных с
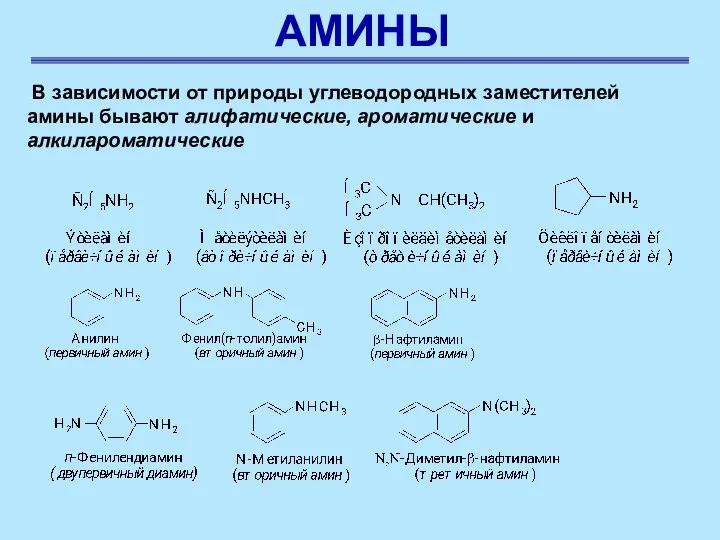
- 24. АМИНЫ .В зависимости от природы углеводородных заместителей амины бывают алифатические, ароматические и алкилароматические
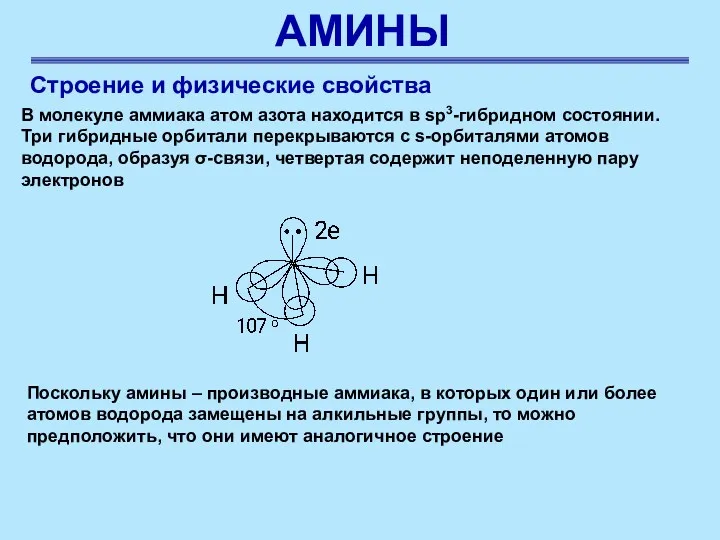
- 25. АМИНЫ Строение и физические свойства В молекуле аммиака атом азота находится в sp3-гибридном состоянии. Три гибридные
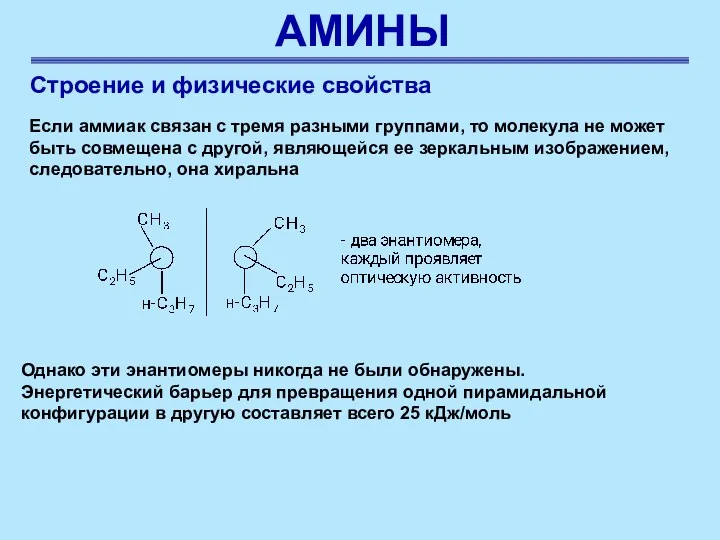
- 26. АМИНЫ Строение и физические свойства Если аммиак связан с тремя разными группами, то молекула не может
- 27. АМИНЫ Строение и физические свойства Простейшие алифатические амины – метиламин, диметиламин и триметиламин – газы, хорошо
- 28. АМИНЫ Химические свойства Многие химические свойства аминов обусловлены стремлением аминов обобществить неподеленную пару электронов азота с
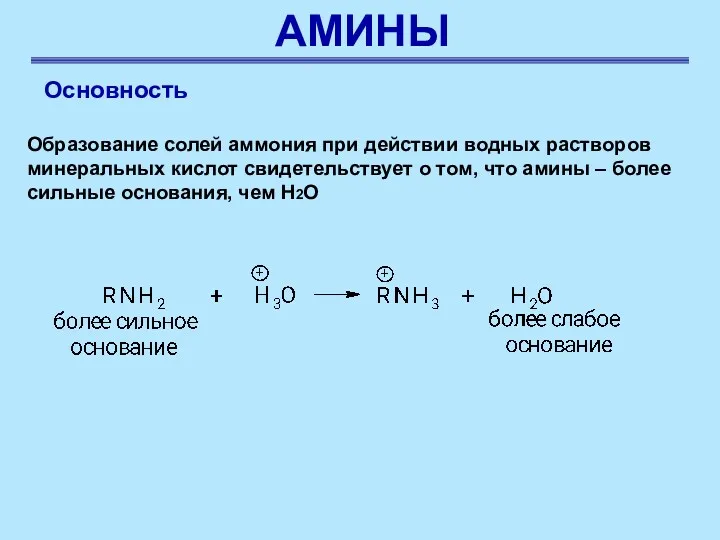
- 29. АМИНЫ Основность Образование солей аммония при действии водных растворов минеральных кислот свидетельствует о том, что амины
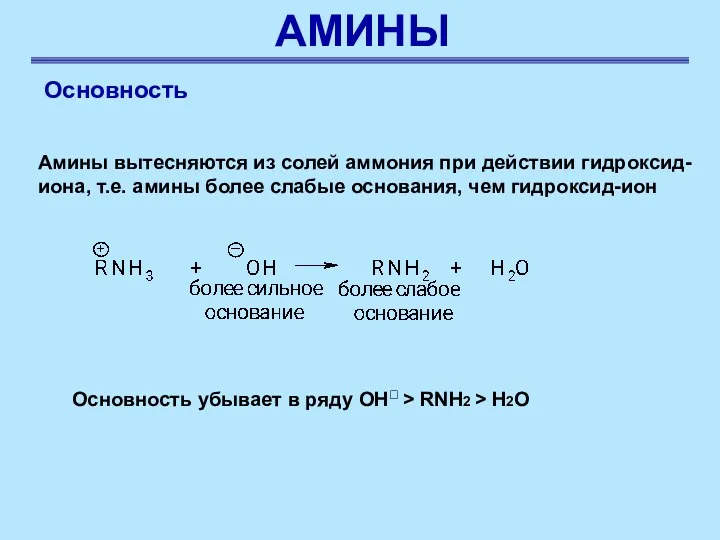
- 30. АМИНЫ Основность Амины вытесняются из солей аммония при действии гидроксид-иона, т.е. амины более слабые основания, чем
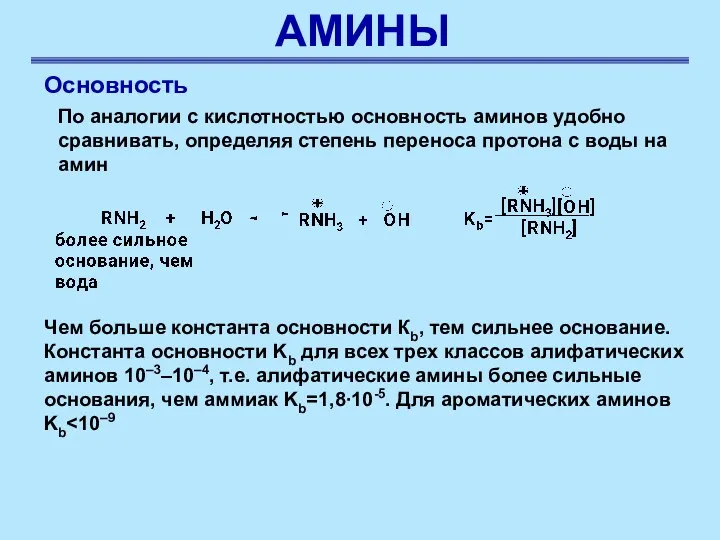
- 31. АМИНЫ Основность По аналогии с кислотностью основность аминов удобно сравнивать, определяя степень переноса протона с воды
- 32. АМИНЫ Структура и основность Наличие заместителей оказывает сильное влияние на основность. Алифатические амины – более сильные
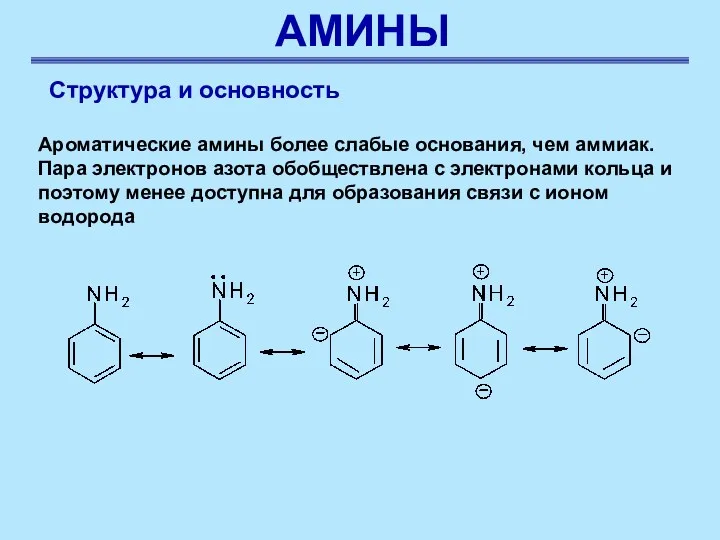
- 33. АМИНЫ Структура и основность Ароматические амины более слабые основания, чем аммиак. Пара электронов азота обобществлена с
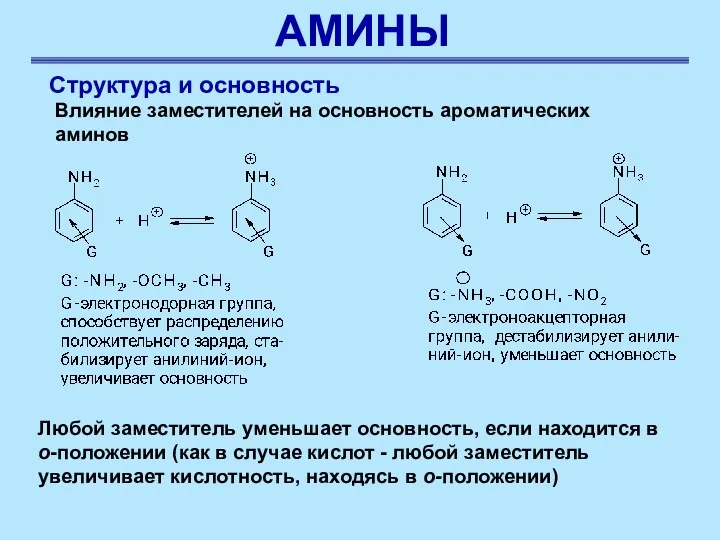
- 34. АМИНЫ Структура и основность Влияние заместителей на основность ароматических аминов Любой заместитель уменьшает основность, если находится
- 35. АМИНЫ Структура и основность Наиболее характерная реакция аминов - образование солей при взаимодействии с кислотами Различие
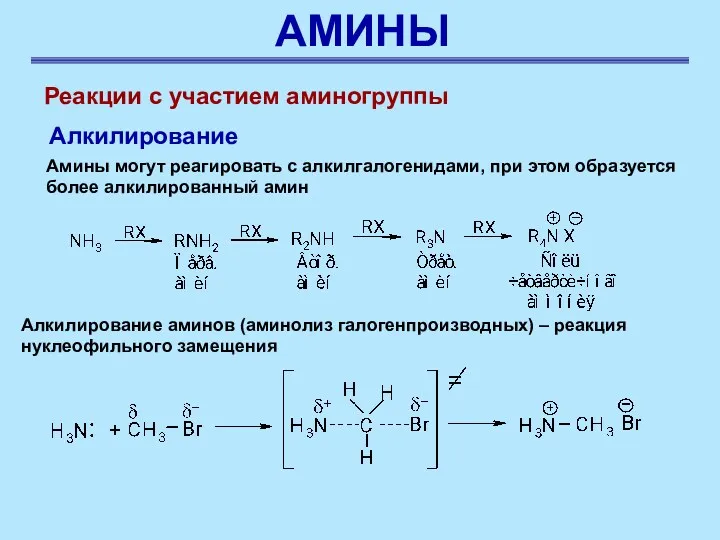
- 36. АМИНЫ Реакции с участием аминогруппы Алкилирование Амины могут реагировать с алкилгалогенидами, при этом образуется более алкилированный
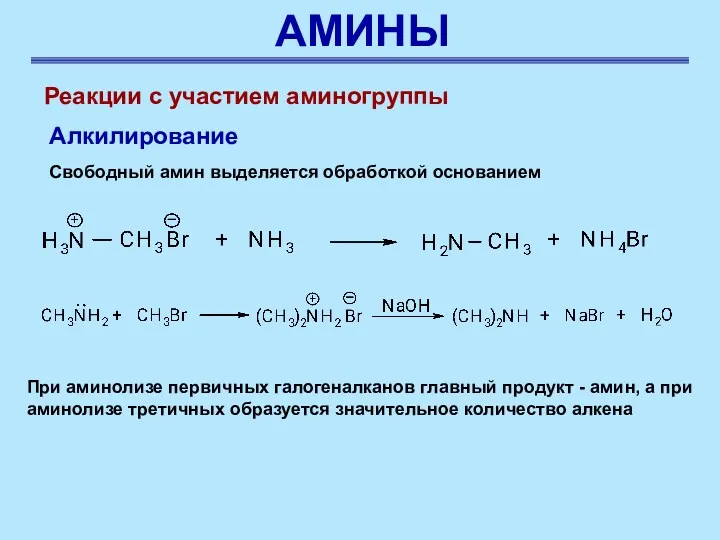
- 37. АМИНЫ Реакции с участием аминогруппы Алкилирование Свободный амин выделяется обработкой основанием При аминолизе первичных галогеналканов главный
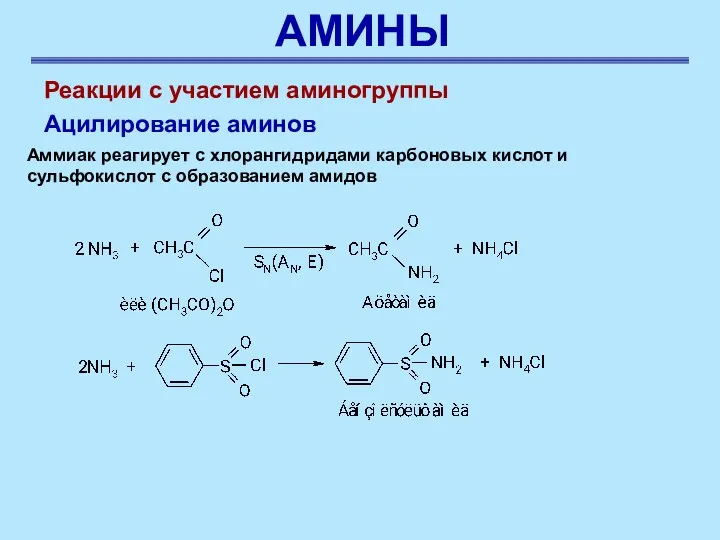
- 38. АМИНЫ Аммиак реагирует с хлорангидридами карбоновых кислот и сульфокислот с образованием амидов Реакции с участием аминогруппы
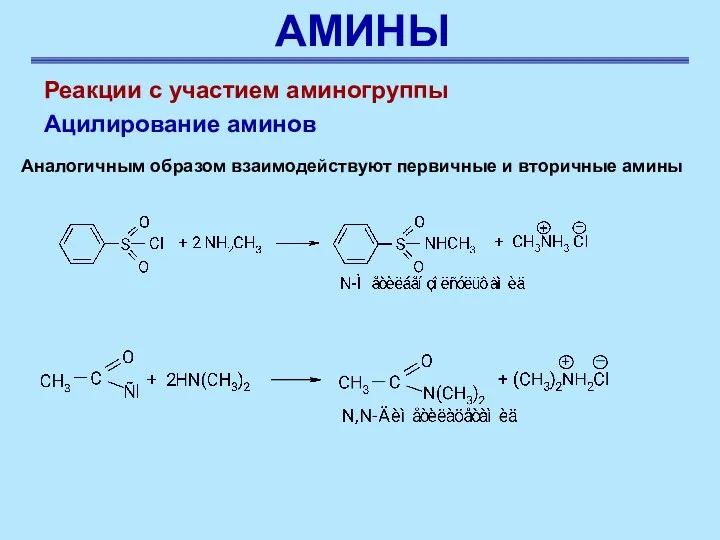
- 39. АМИНЫ Реакции с участием аминогруппы Ацилирование аминов Аналогичным образом взаимодействуют первичные и вторичные амины
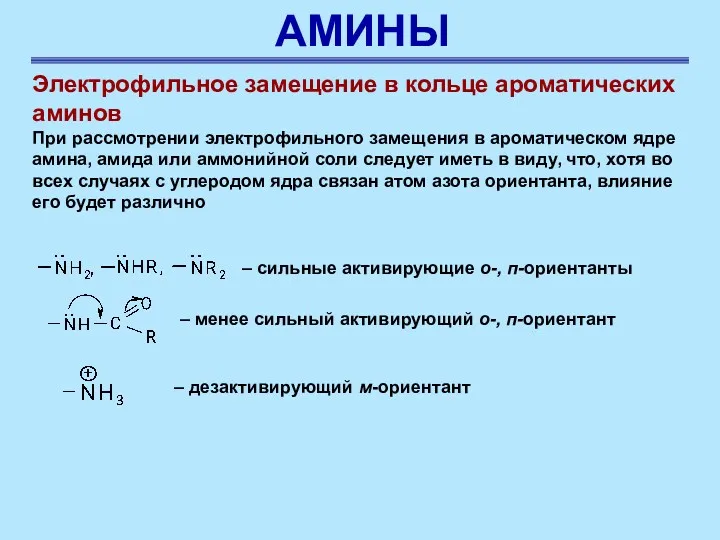
- 40. АМИНЫ Электрофильное замещение в кольце ароматических аминов При рассмотрении электрофильного замещения в ароматическом ядре амина, амида
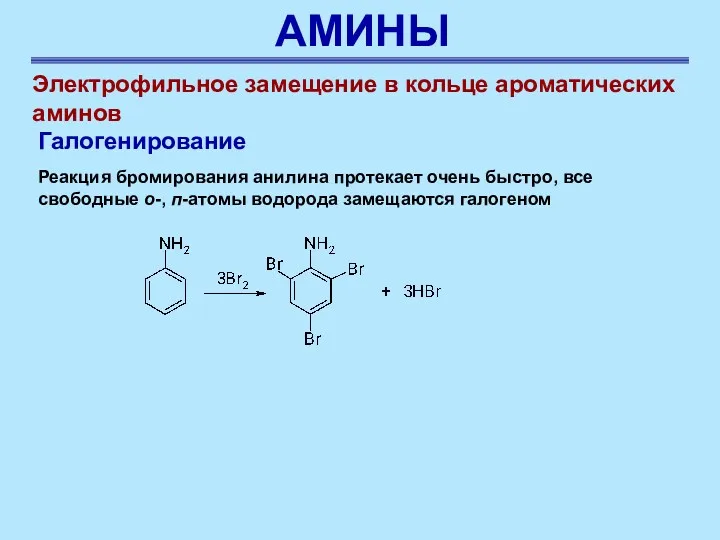
- 41. АМИНЫ Реакция бромирования анилина протекает очень быстро, все свободные о-, п-атомы водорода замещаются галогеном Электрофильное замещение
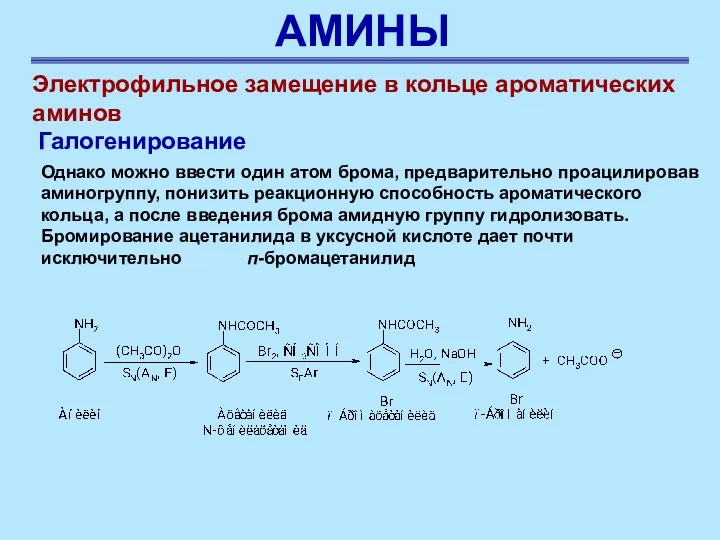
- 42. АМИНЫ Электрофильное замещение в кольце ароматических аминов Галогенирование Однако можно ввести один атом брома, предварительно проацилировав
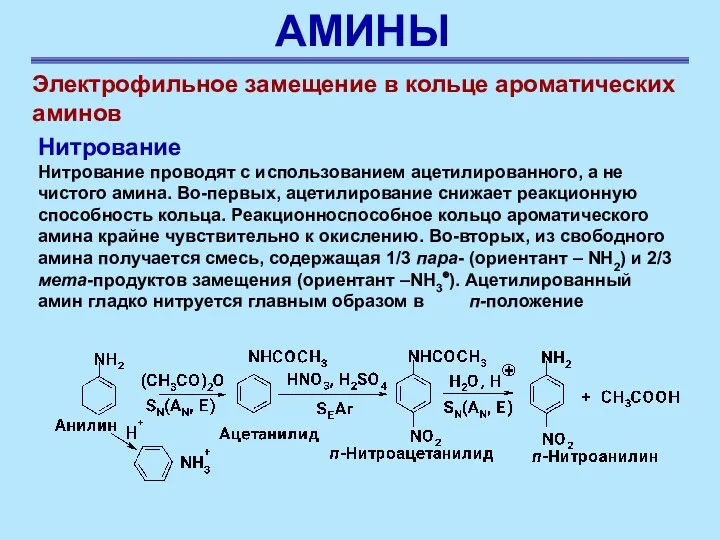
- 43. АМИНЫ Электрофильное замещение в кольце ароматических аминов Нитрование Нитрование проводят с использованием ацетилированного, а не чистого
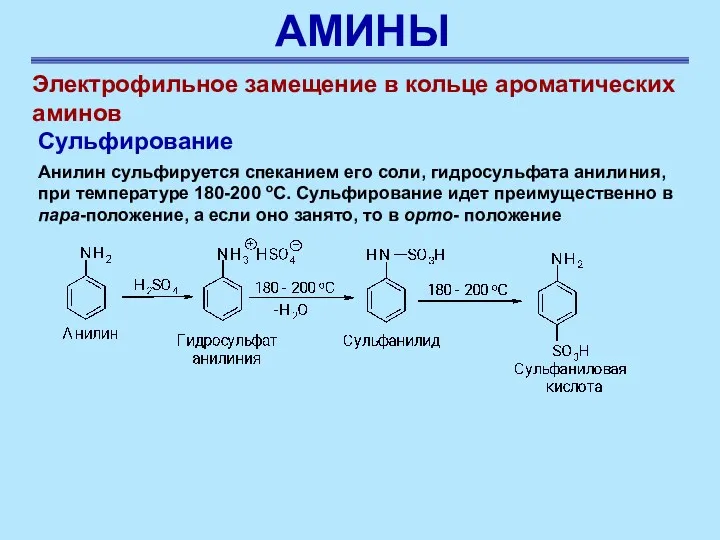
- 44. АМИНЫ Электрофильное замещение в кольце ароматических аминов Сульфирование Анилин сульфируется спеканием его соли, гидросульфата анилиния, при
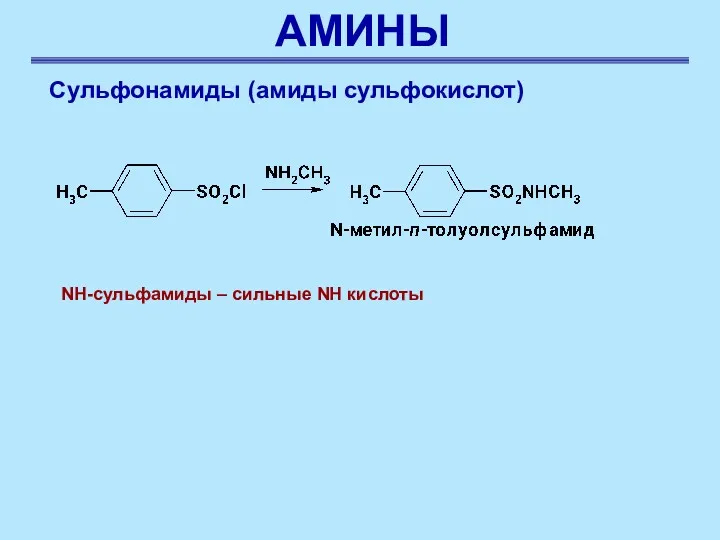
- 45. АМИНЫ Сульфонамиды (амиды сульфокислот) NH-сульфамиды – сильные NH кислоты
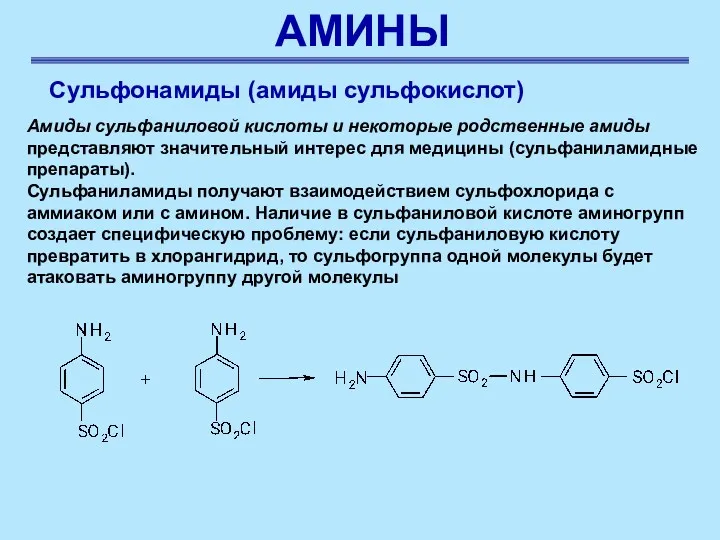
- 46. АМИНЫ Сульфонамиды (амиды сульфокислот) Амиды сульфаниловой кислоты и некоторые родственные амиды представляют значительный интерес для медицины
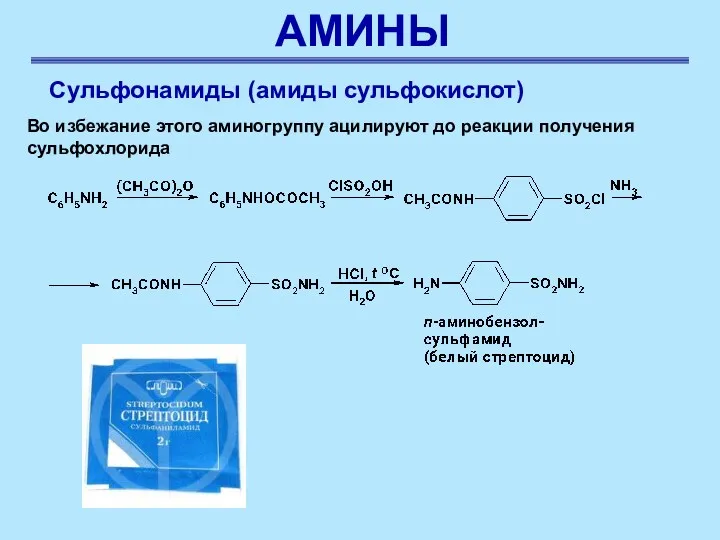
- 47. АМИНЫ Сульфонамиды (амиды сульфокислот) Во избежание этого аминогруппу ацилируют до реакции получения сульфохлорида
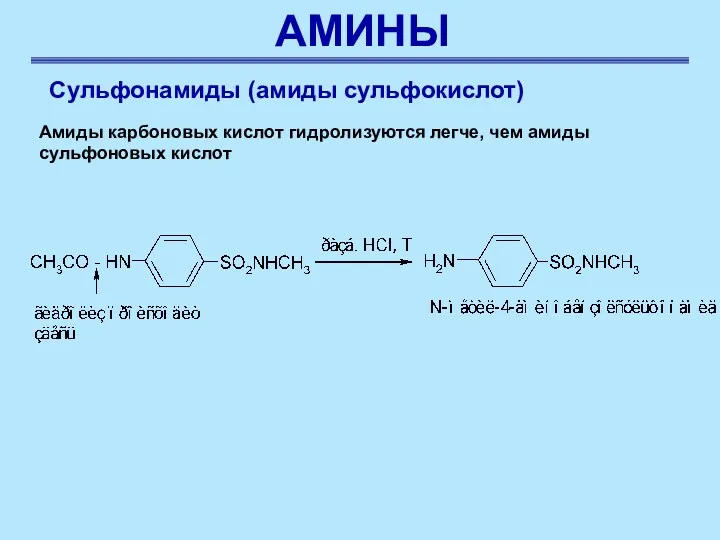
- 48. АМИНЫ Сульфонамиды (амиды сульфокислот) Амиды карбоновых кислот гидролизуются легче, чем амиды сульфоновых кислот
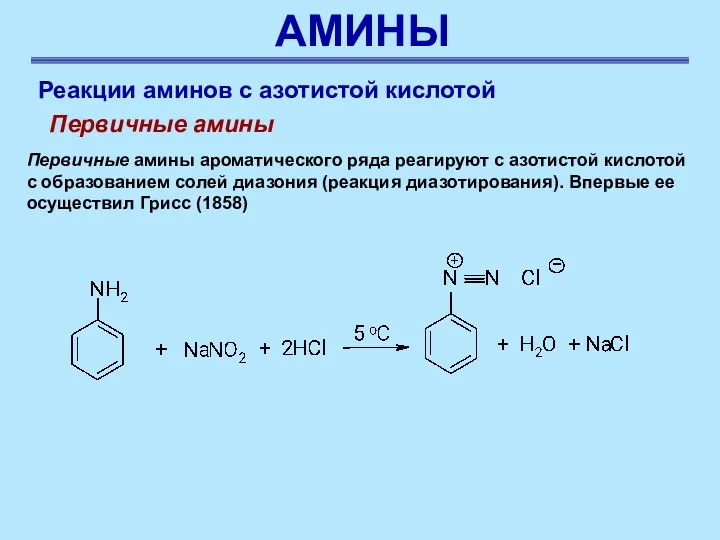
- 49. АМИНЫ Реакции аминов с азотистой кислотой Первичные амины ароматического ряда реагируют с азотистой кислотой с образованием
- 50. АМИНЫ Реакции аминов с азотистой кислотой Первичные амины На первой стадии при взаимодействии нитрита натрия с
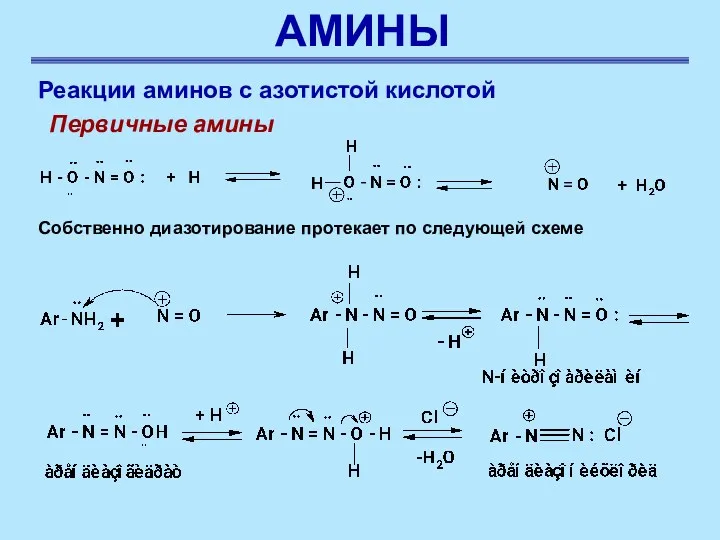
- 51. АМИНЫ Реакции аминов с азотистой кислотой Первичные амины Собственно диазотирование протекает по следующей схеме
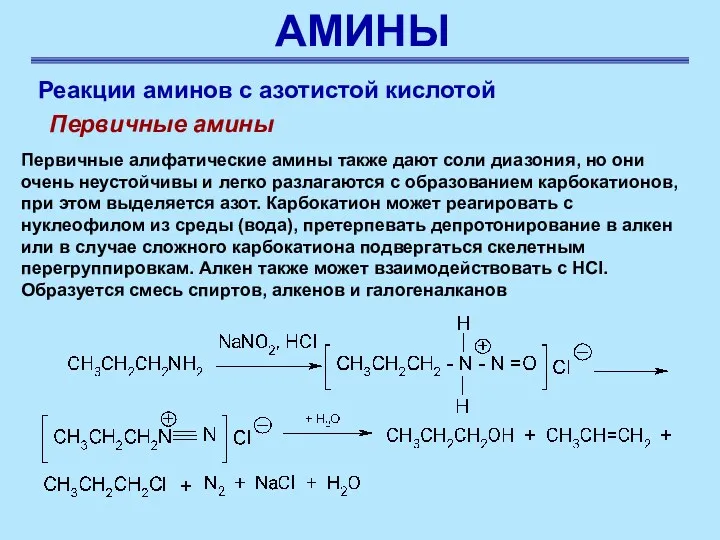
- 52. АМИНЫ Реакции аминов с азотистой кислотой Первичные амины Первичные алифатические амины также дают соли диазония, но
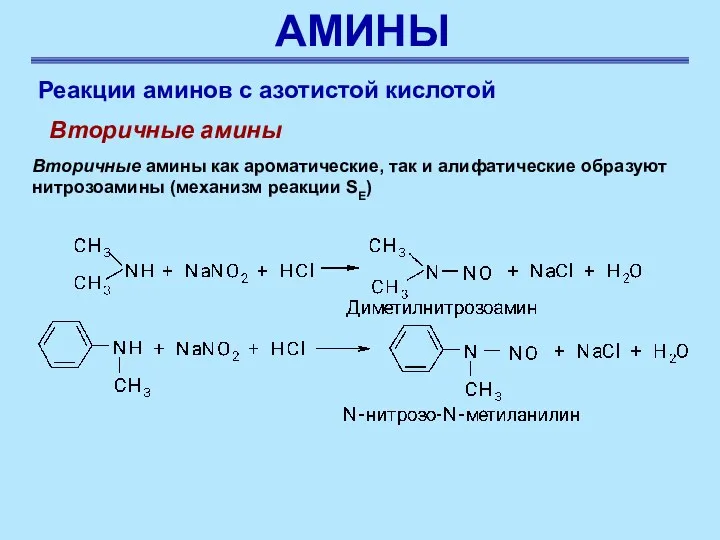
- 53. АМИНЫ Реакции аминов с азотистой кислотой Вторичные амины Вторичные амины как ароматические, так и алифатические образуют
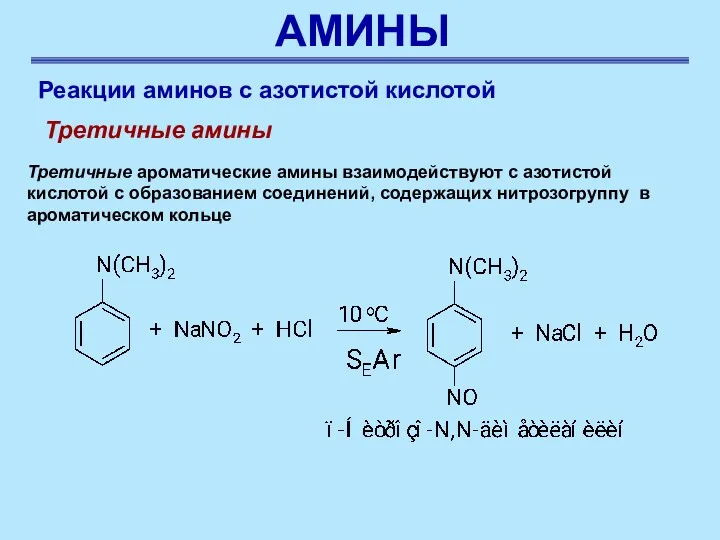
- 54. АМИНЫ Реакции аминов с азотистой кислотой Третичные амины Третичные ароматические амины взаимодействуют с азотистой кислотой с
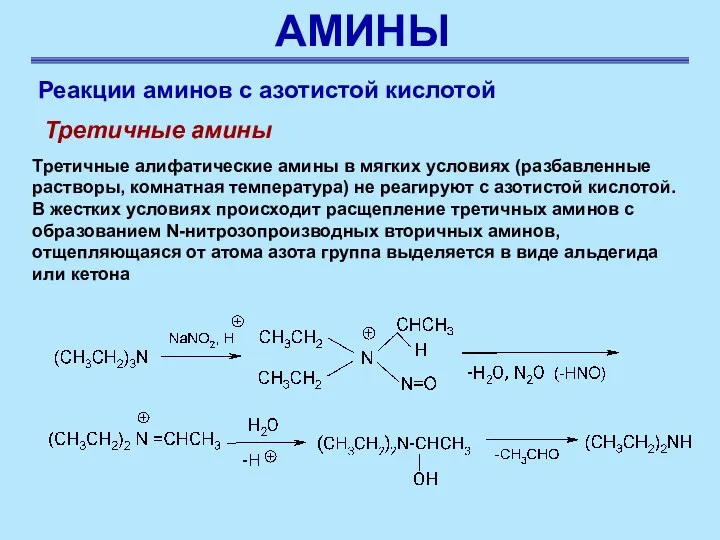
- 55. АМИНЫ Реакции аминов с азотистой кислотой Третичные амины Третичные алифатические амины в мягких условиях (разбавленные растворы,
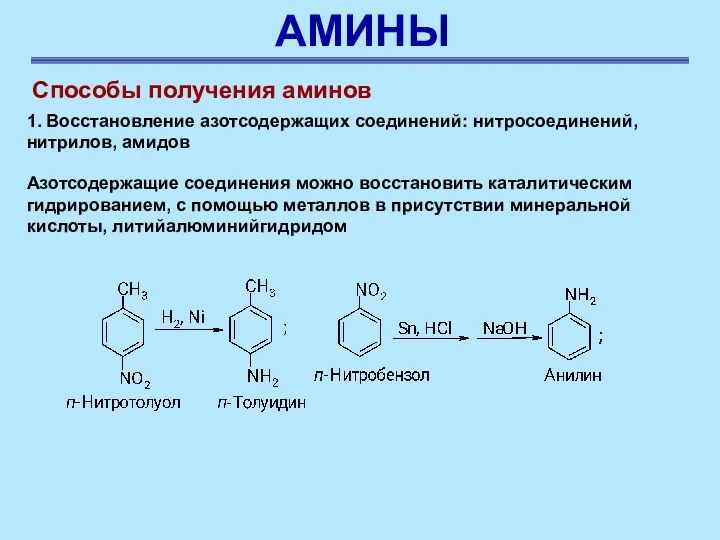
- 56. АМИНЫ Способы получения аминов 1. Восстановление азотсодержащих соединений: нитросоединений, нитрилов, амидов Азотсодержащие соединения можно восстановить каталитическим
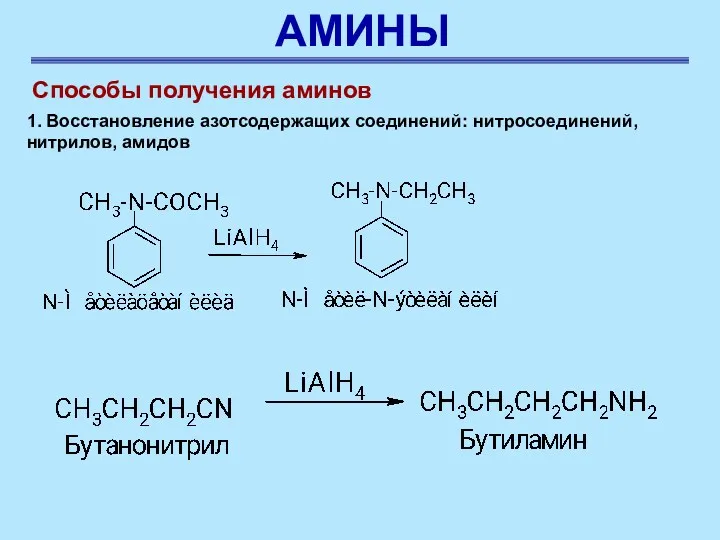
- 57. АМИНЫ Способы получения аминов 1. Восстановление азотсодержащих соединений: нитросоединений, нитрилов, амидов
- 58. АМИНЫ Способы получения аминов 2. Взаимодействие галогенпроизводных и спиртов с аммиаком
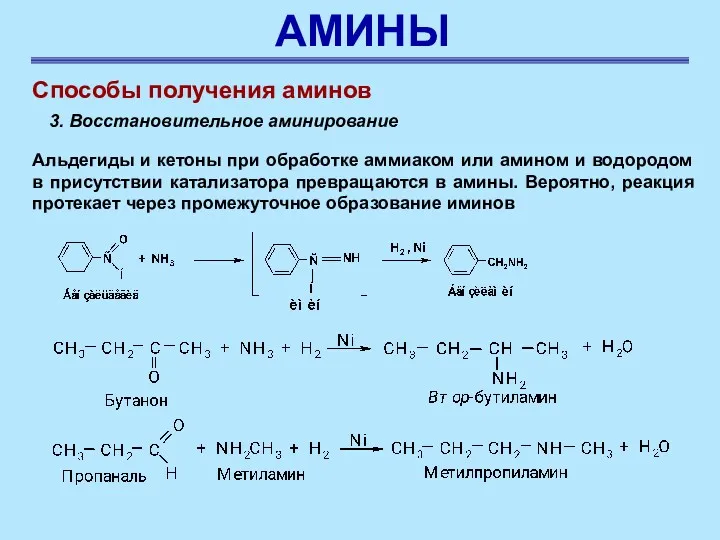
- 59. АМИНЫ Способы получения аминов 3. Восстановительное аминирование Альдегиды и кетоны при обработке аммиаком или амином и
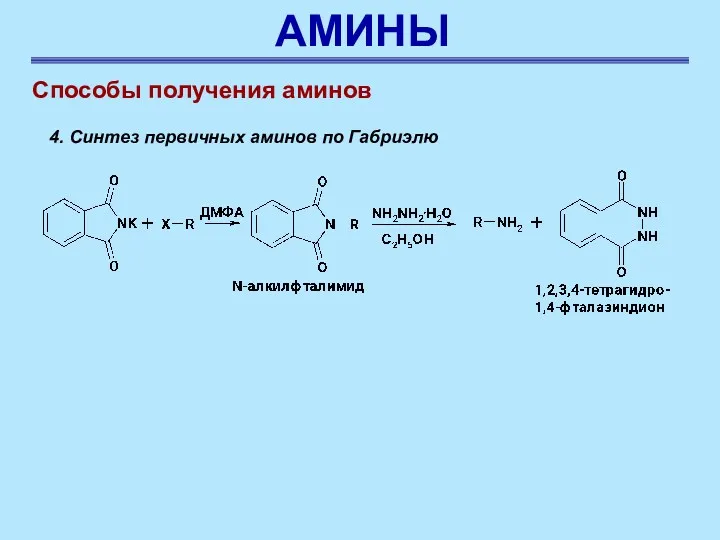
- 60. АМИНЫ Способы получения аминов 4. Синтез первичных аминов по Габриэлю
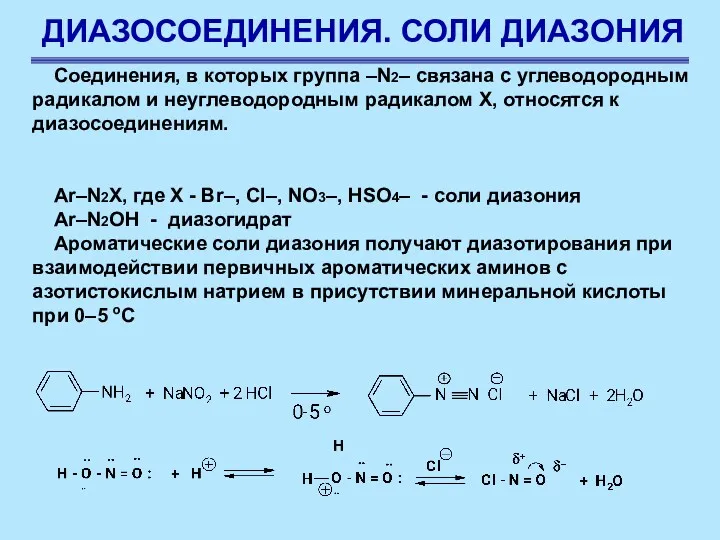
- 61. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Соединения, в которых группа –N2– связана с углеводородным радикалом и неуглеводородным радикалом Х,
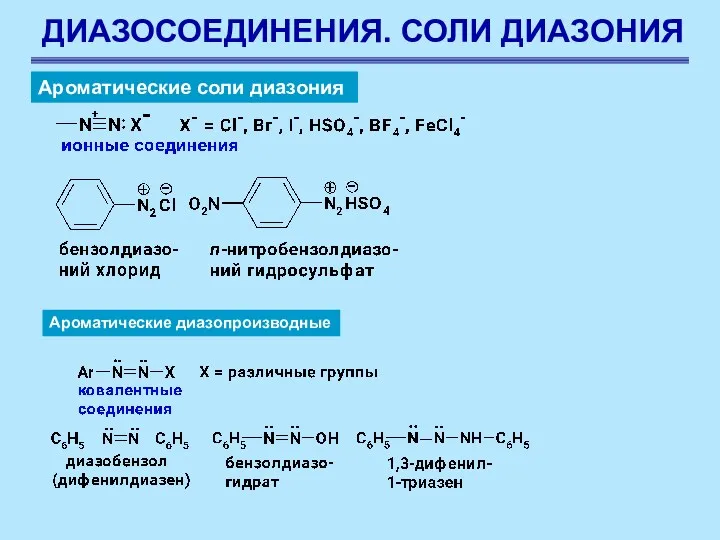
- 62. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Ароматические соли диазония Ароматические диазопроизводные
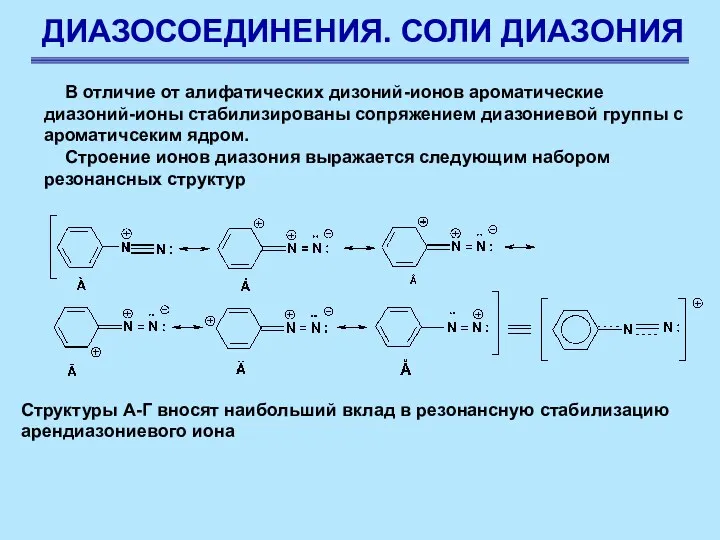
- 63. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ В отличие от алифатических дизоний-ионов ароматические диазоний-ионы стабилизированы сопряжением диазониевой группы с ароматичсеким
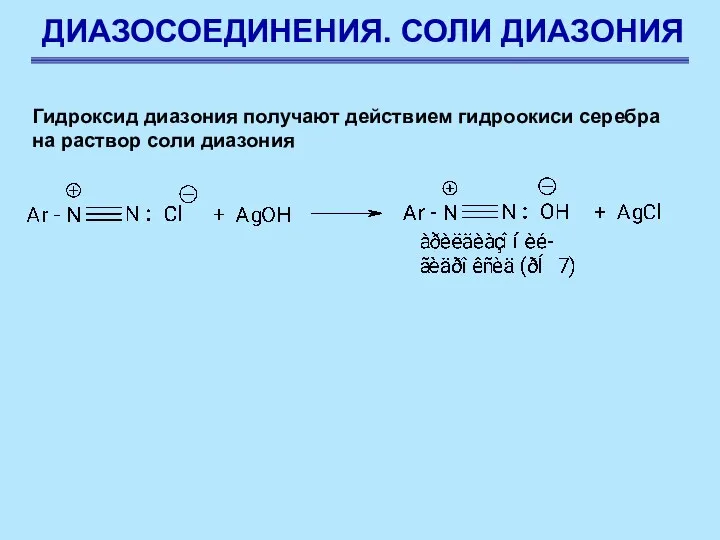
- 64. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Гидроксид диазония получают действием гидроокиси серебра на раствор соли диазония
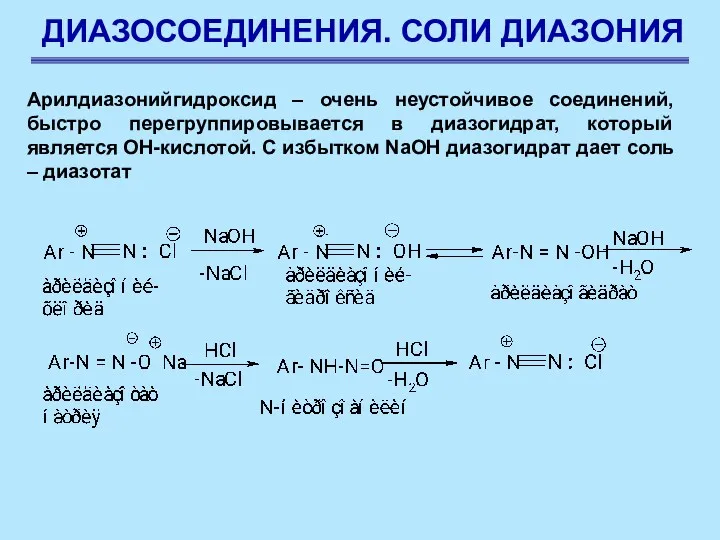
- 65. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Арилдиазонийгидроксид – очень неустойчивое соединений, быстро перегруппировывается в диазогидрат, который является ОН-кислотой. С
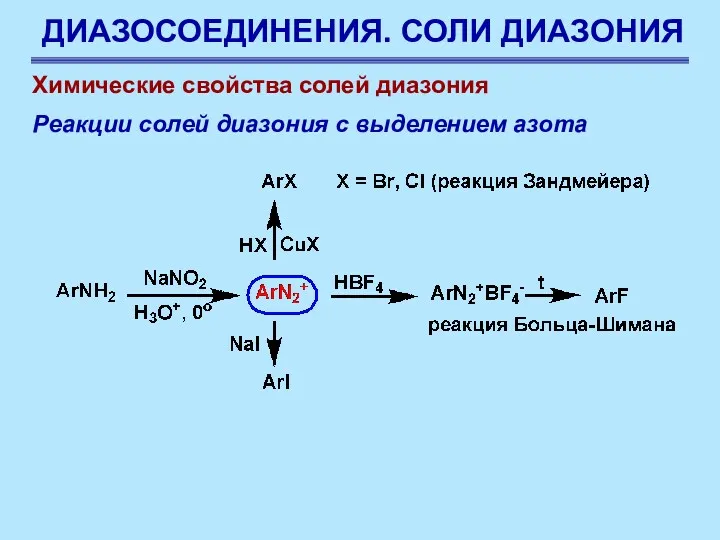
- 66. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Химические свойства солей диазония Реакции солей диазония с выделением азота Соли диазония ценны
- 67. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Химические свойства солей диазония Реакции солей диазония с выделением азота
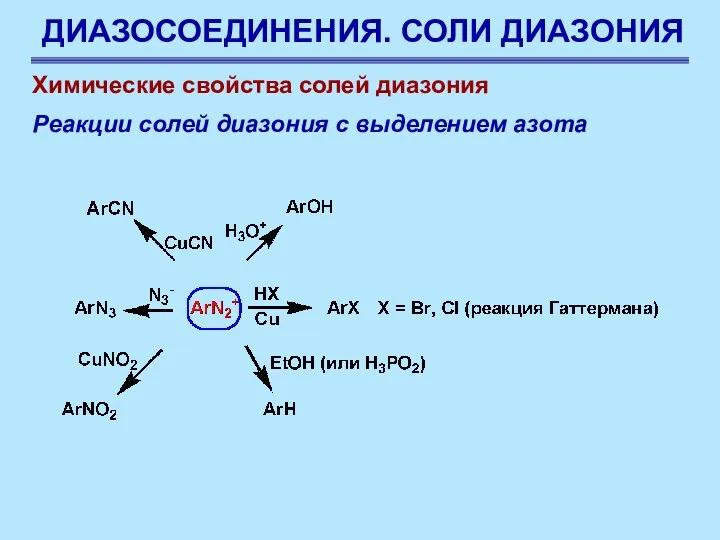
- 68. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Химические свойства солей диазония Реакции солей диазония с выделением азота
- 69. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Химические свойства солей диазония Реакции солей диазония с выделением азота
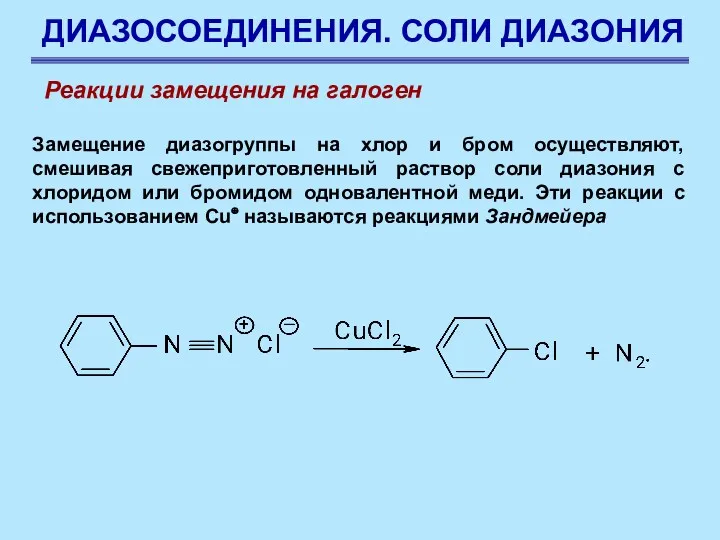
- 70. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Замещение диазогруппы на хлор и бром осуществляют, смешивая свежеприготовленный раствор соли диазония с
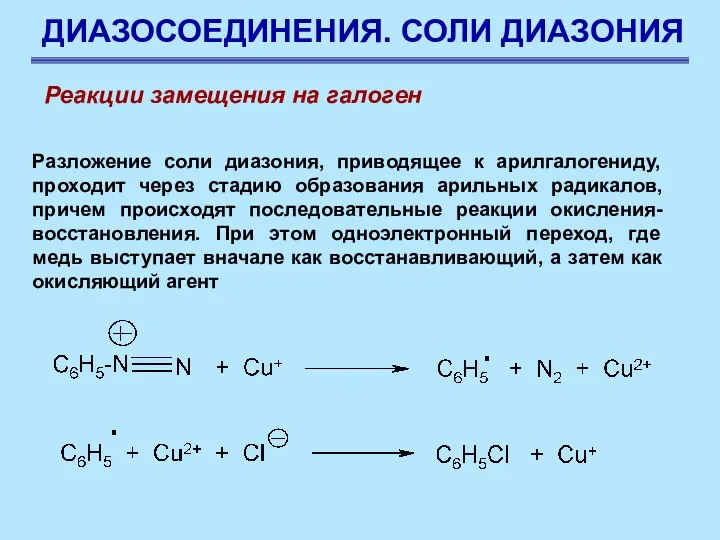
- 71. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Разложение соли диазония, приводящее к арилгалогениду, проходит через стадию образования арильных радикалов, причем
- 72. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Характер действия металлической меди аналогичен, поскольку на ее поверхности всегда имеется некоторое количество
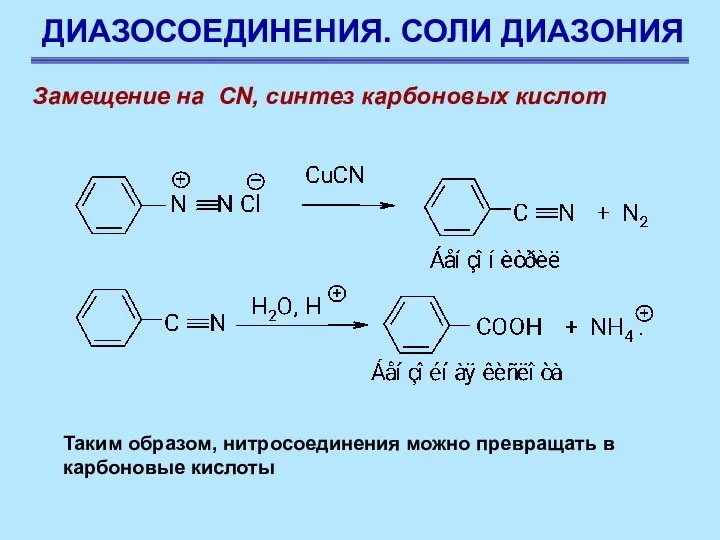
- 73. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Замещение на CN, синтез карбоновых кислот Таким образом, нитросоединения можно превращать в карбоновые
- 74. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Замещение на ОН Эта реакция медленно протекает даже в ледяном растворе, и это
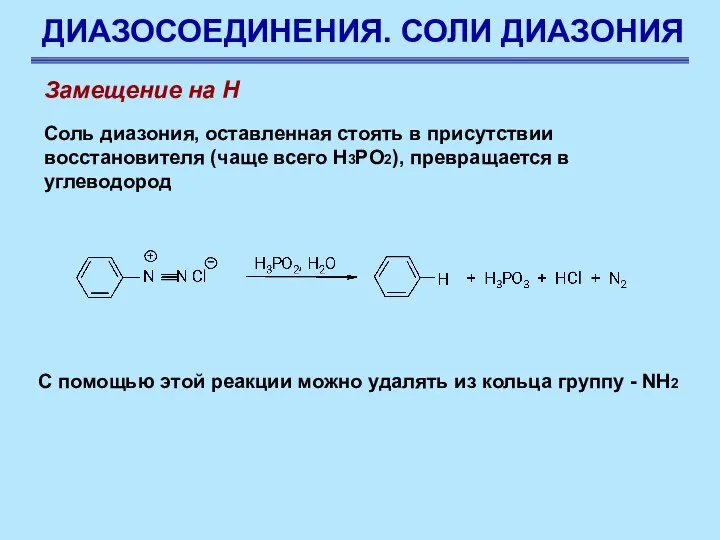
- 75. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Замещение на Н Соль диазония, оставленная стоять в присутствии восстановителя (чаще всего Н3РО2),
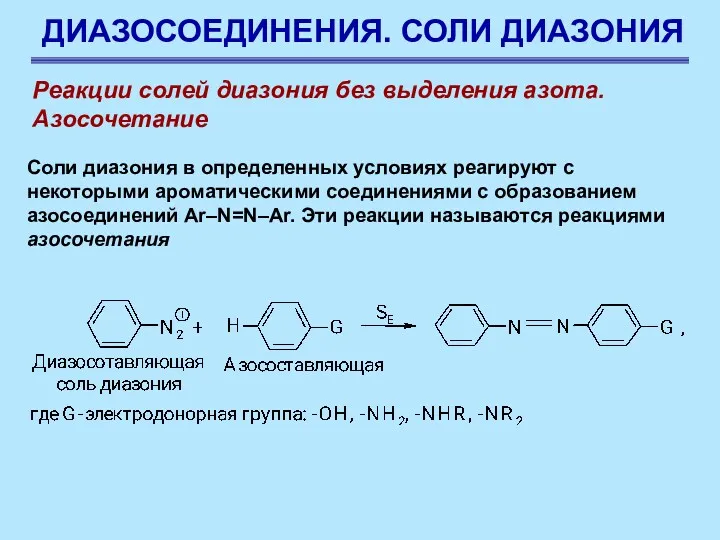
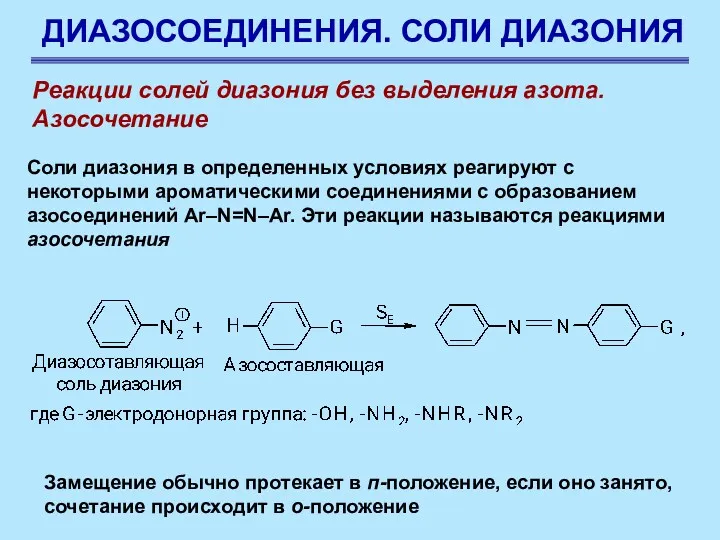
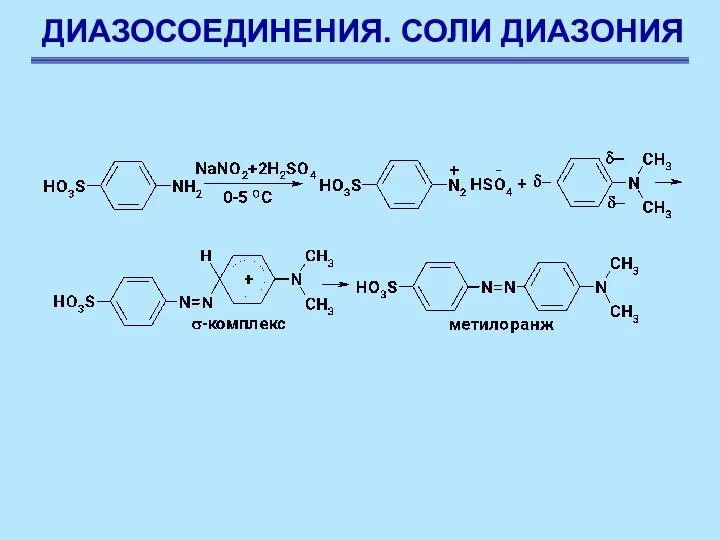
- 76. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Реакции солей диазония без выделения азота. Азосочетание Соли диазония в определенных условиях реагируют
- 77. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Реакции солей диазония без выделения азота. Азосочетание Соли диазония в определенных условиях реагируют
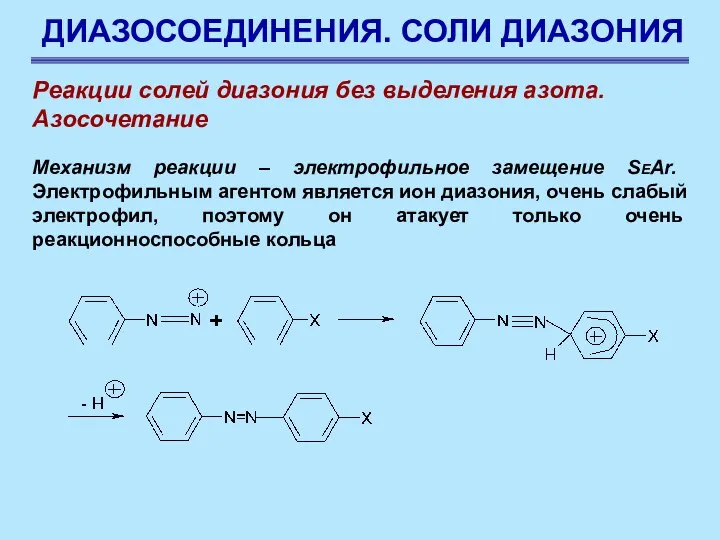
- 78. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Реакции солей диазония без выделения азота. Азосочетание Механизм реакции – электрофильное замещение SEAr.
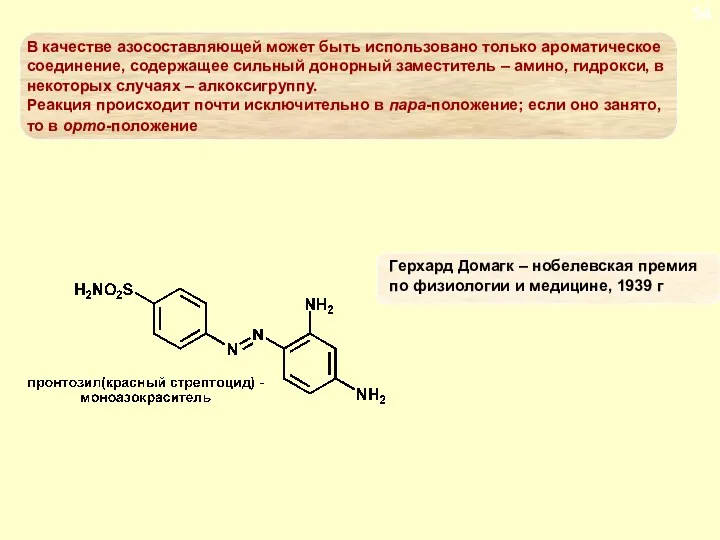
- 79. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Реакции солей диазония без выделения азота. Азосочетание Поскольку положительнфй заряд в арендиазониевом ионе
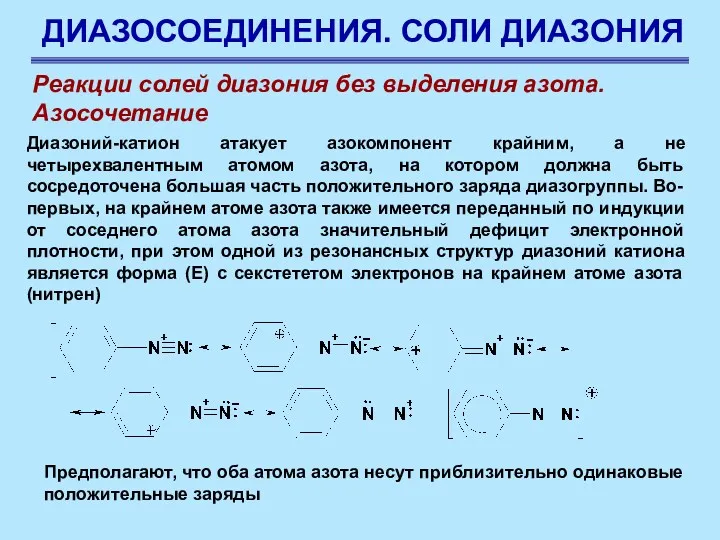
- 80. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Реакции солей диазония без выделения азота. Азосочетание Диазоний-катион атакует азокомпонент крайним, а не
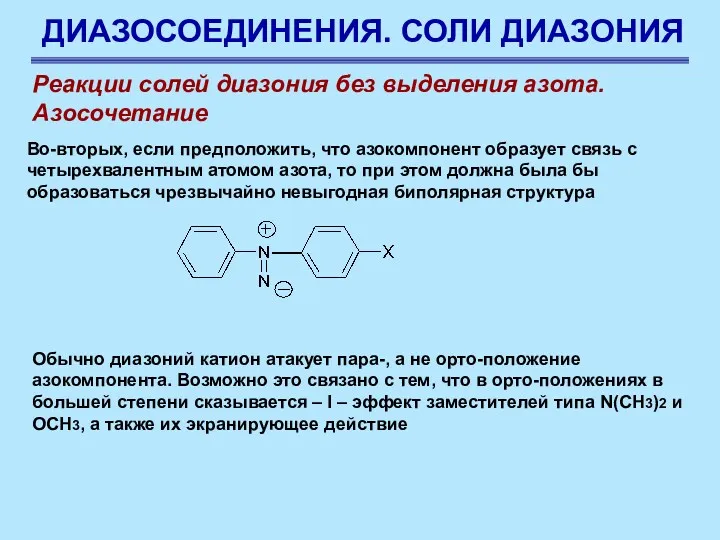
- 81. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Реакции солей диазония без выделения азота. Азосочетание Во-вторых, если предположить, что азокомпонент образует
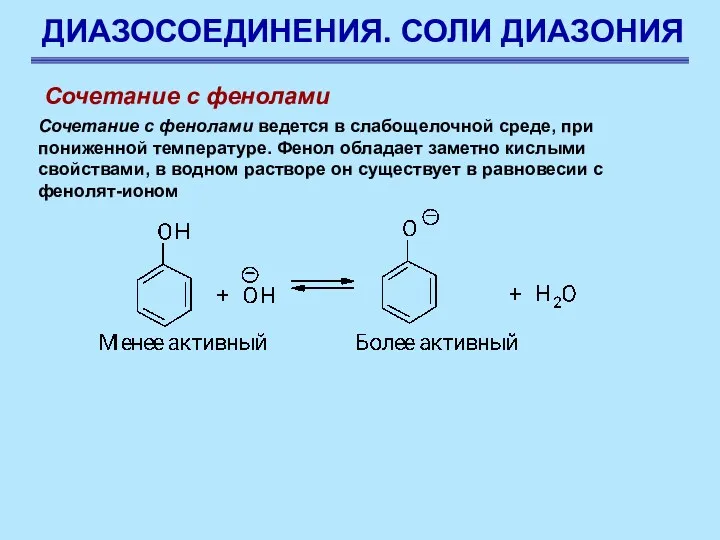
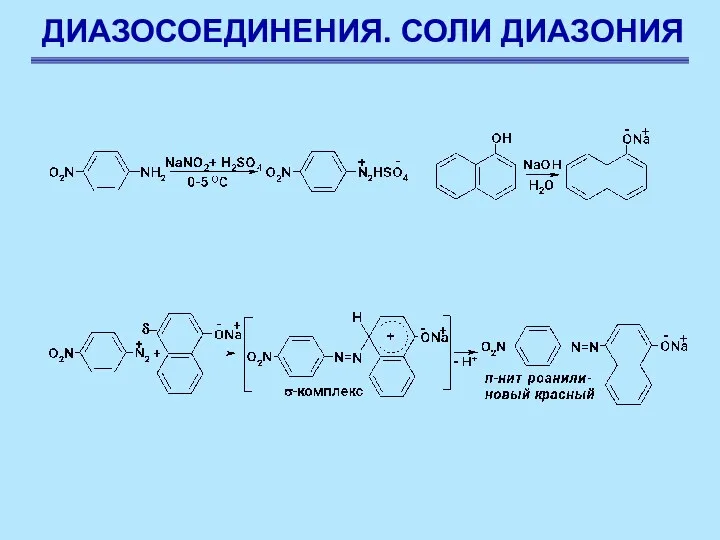
- 82. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Сочетание с фенолами Сочетание с фенолами ведется в слабощелочной среде, при пониженной температуре.
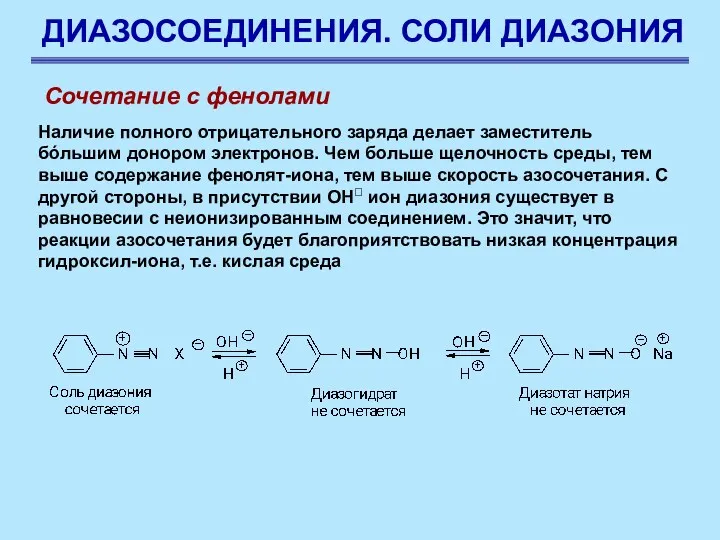
- 83. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Сочетание с фенолами Наличие полного отрицательного заряда делает заместитель бóльшим донором электронов. Чем
- 84. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Сочетание с фенолами Условия, при которых протекает реакция сочетания с фенолами являются компромиссными:
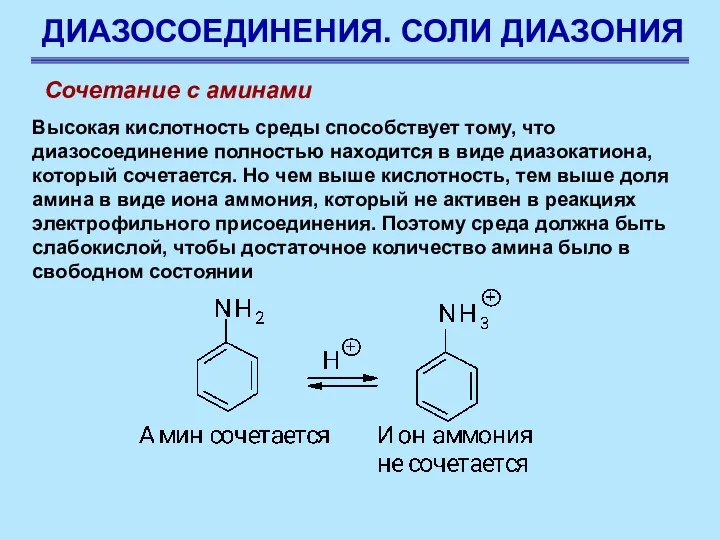
- 85. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Сочетание с аминами Высокая кислотность среды способствует тому, что диазосоединение полностью находится в
- 86. 54
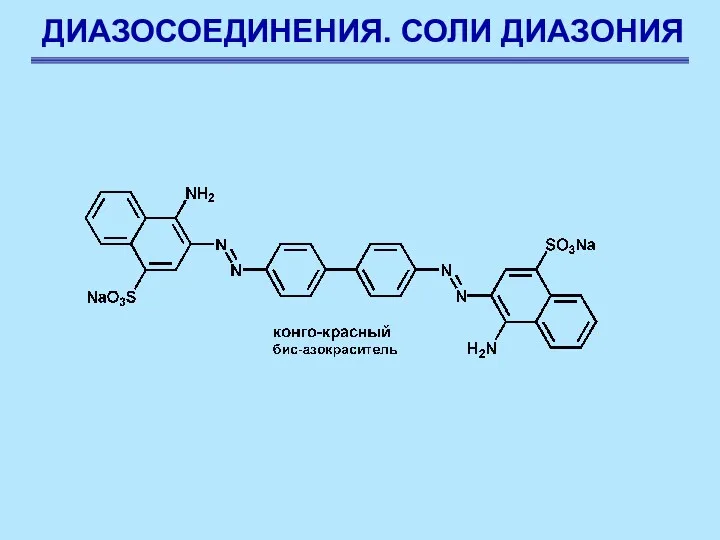
- 87. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- 88. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- 89. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
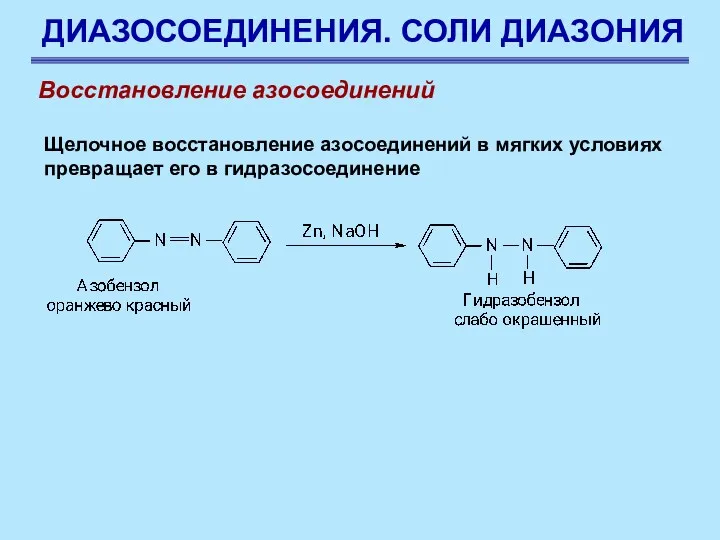
- 90. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Восстановление азосоединений Щелочное восстановление азосоединений в мягких условиях превращает его в гидразосоединение
- 92. Скачать презентацию





















 Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Виды коррозии
Виды коррозии Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Нуклеин қышқылдары
Нуклеин қышқылдары Ртуть. Использование ртути
Ртуть. Использование ртути Художественная обработка камня
Художественная обработка камня Introduction to effective permeability and relative permeability
Introduction to effective permeability and relative permeability Кристаллическое состояние вещества
Кристаллическое состояние вещества Биохимия нуклеиновых кислот
Биохимия нуклеиновых кислот Химические чистящие средства
Химические чистящие средства Химические вещества как строительные и поделочные материалы
Химические вещества как строительные и поделочные материалы Вода - уникальнейшая структура жизни. Способы ее очистки
Вода - уникальнейшая структура жизни. Способы ее очистки Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9
Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9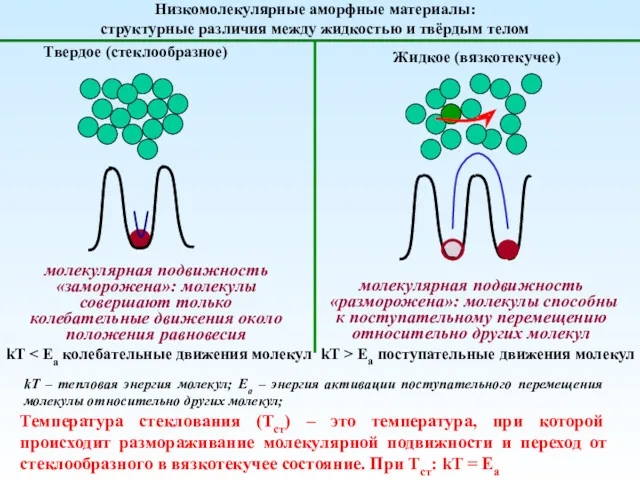 Механика полимеров
Механика полимеров Карбоновые кислоты. (10 класс)
Карбоновые кислоты. (10 класс) Химические реакции. Условия необходимые для протекания химических реакций?
Химические реакции. Условия необходимые для протекания химических реакций? Петрография
Петрография Смоги и их влияние на человека
Смоги и их влияние на человека Валентные возможности атомов. Степень окисления
Валентные возможности атомов. Степень окисления Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Алюминий (лат. Aluminium)
Алюминий (лат. Aluminium) Качественные реакции на функциональные группы. Классификация функциональных групп
Качественные реакции на функциональные группы. Классификация функциональных групп Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Металлы. Общая характеристика
Металлы. Общая характеристика Минералогия литофильных редких элементов. Бор
Минералогия литофильных редких элементов. Бор Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД)