Слайд 2

Цели:
Обучающие
Повторить и расширить знания учащихся о ОВР. Важнейшие окислители и восстановители.
Ознакомить с методом составления уравнений окислительно-восстановительных реакций. (Метод электронного баланс.) Влияние среды на протекание окислительно-восстановительных процессов.
Воспитательные
Создать положительный настрой к обучению и готовность к активной мыслительной деятельности, используя видеоматериалы и метод демонстрационного эксперимента; воспитывать культуру речи и труда.
Развивающие
Развивать у учащихся познавательный интерес к изучению химии, умение анализировать, сравнивать, делать выводы, самостоятельность учащихся. (ОК 3.: Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность)
Слайд 3

План лекции
Понятие о ОВР
Важнейшие окислители и восстановители
Классификация ОВР
Метод электронного баланса
Влияние
среды на протекание ОВР
Слайд 4

Zn + 2HCL → ZnCl2 + H2
CuSO4 +2NaOH →
Cu(OH)2↓ + Na2SO4
Слайд 5

Окислительно восстановительные реакции (ОВР) — это реакции, протекающие с изменением степени
окисления атомов, входящих в состав реагирующих веществ.
Слайд 6
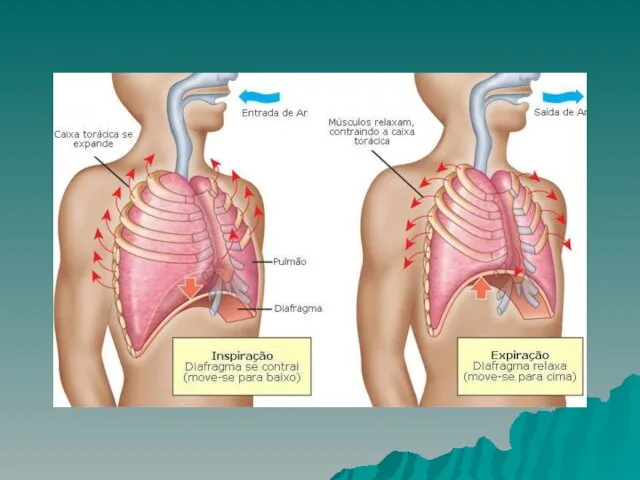
Слайд 7
Слайд 8

Слайд 9
Слайд 10

Слайд 11

Слайд 12

Слайд 13
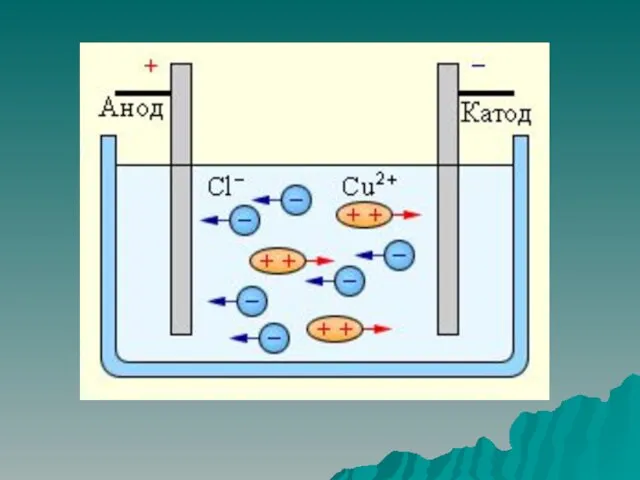
Слайд 14

Степень окисления.
Элементы с постоянной степенью окисления
Элементы с переменной степенью окисления.
Слайд 15

Определите степень окисления для магния и алюминия.
Какие степени окисления возможны для
серы?
Какие степени окисления возможны для хрома?
Слайд 16

Слайд 17
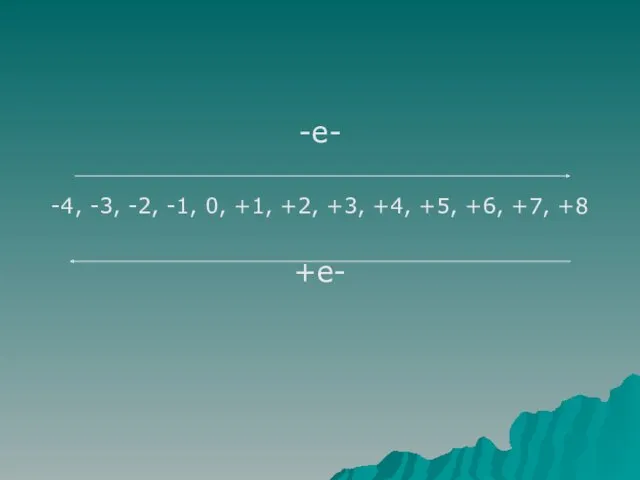
-е-
-4, -3, -2, -1, 0, +1, +2, +3, +4, +5, +6,
+7, +8
+е-
Слайд 18

Восстановитель
-элемент, который отдает электроны.
Восстановитель окисляется, повышая свою степень окисления.
Окисление - процесс
отдачи электронов
Слайд 19

Окислитель
элемент, который присоединяет электроны.
Окислитель восстанавливается, понижая свою степень окисления.
Восстановление – процесс
принятия электронов
Слайд 20

Слайд 21

Влияние степени окисления на окислительные и восстановительные свойства элементов.
В высшей
положительной степени окисления элемент проявляет только окислительные свойства
В промежуточной степени окисления и окислительные и восстановительные свойства.
В высшей отрицательной степени окисления только восстановительные степени окисления.
Слайд 22

Классификация окислительно-восстановительных реакций
Слайд 23

Слайд 24

Слайд 25

Слайд 26

1. Межмолекулярные
Fe + CuSO4 → Cu + FeSO4
2. Внутримолекулярные
(NH4)2Cr2O7 = Cr2O3
+ N2 + 4H2O
3. Самоокисления-самовосстановления (диспропорционирования)
Cl2 + H2O ↔ HCl + HClO
Слайд 27

Слайд 28

Слайд 29

Слайд 30





























 Материаловедение. Контрольная работа
Материаловедение. Контрольная работа Квантово-механический подход к описанию строения атомов
Квантово-механический подход к описанию строения атомов Нанотехнологии и Наноматериалы
Нанотехнологии и Наноматериалы Основания. 8 класс
Основания. 8 класс Фенолы
Фенолы Типы химических реакций. Тепловой эффект (11 класс)
Типы химических реакций. Тепловой эффект (11 класс) Аминокислоты. Гетерофункциональные соединения, молекулы
Аминокислоты. Гетерофункциональные соединения, молекулы Бордың адам ағзасына әсері
Бордың адам ағзасына әсері Залізо. Фізичні та хімічні властивості
Залізо. Фізичні та хімічні властивості Періодична система
Періодична система Применение уксусной кислоты
Применение уксусной кислоты Введение в кристаллографию
Введение в кристаллографию Обмоточные провода
Обмоточные провода Максимально очищенные фитопрепараты. Технология и стандартизация
Максимально очищенные фитопрепараты. Технология и стандартизация Предмет органической химии
Предмет органической химии Химические элементы IV группы главной подгруппы
Химические элементы IV группы главной подгруппы Получение и свойства кислорода
Получение и свойства кислорода Химическая связь. Лекция 5
Химическая связь. Лекция 5 Азотные удобрения
Азотные удобрения Титриметрический метод анализа
Титриметрический метод анализа ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов
ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов Простые вещества – неметаллы
Простые вещества – неметаллы Борорганические соединения и их применение
Борорганические соединения и их применение Chemical kinetics
Chemical kinetics Гидролиз органических и неорганических веществ
Гидролиз органических и неорганических веществ Получение металлов. (9 класс)
Получение металлов. (9 класс) Жиры
Жиры Строение и свойства циклоалканов
Строение и свойства циклоалканов