Содержание
- 2. С чего начинается химия? С оксидов, кислот, щелочей. С пробирок, спиртовок и колбочек, Стоящих на парте
- 3. Утром встал я спозаранку. Чай налил, нашёл баранку. Подмешал я сахарку, Ложку, две и три –
- 4. ТЕМА: Растворение. Растворимость веществ в воде.
- 5. Растворы играют важную роль в природе, науке и технике. Особую роль на нашей планете играет вода.
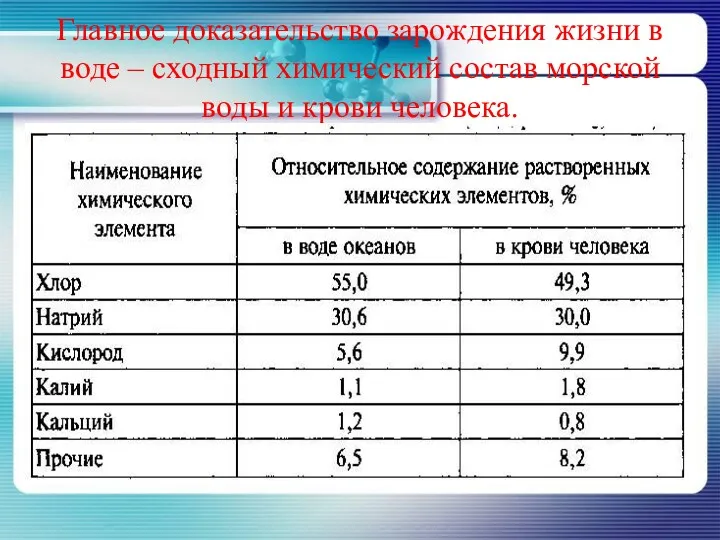
- 6. Главное доказательство зарождения жизни в воде – сходный химический состав морской воды и крови человека.
- 7. А знаете ли вы, что в 1м3 морской воды растворено 0,01мг золота. Общее количество золота в
- 8. Какие растворы Вам известны?
- 9. Растворы Вода Лекарственные настойки Ацетон Золотые украшения
- 10. Что же такое раствор?
- 11. Раствор – однородная система, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия.
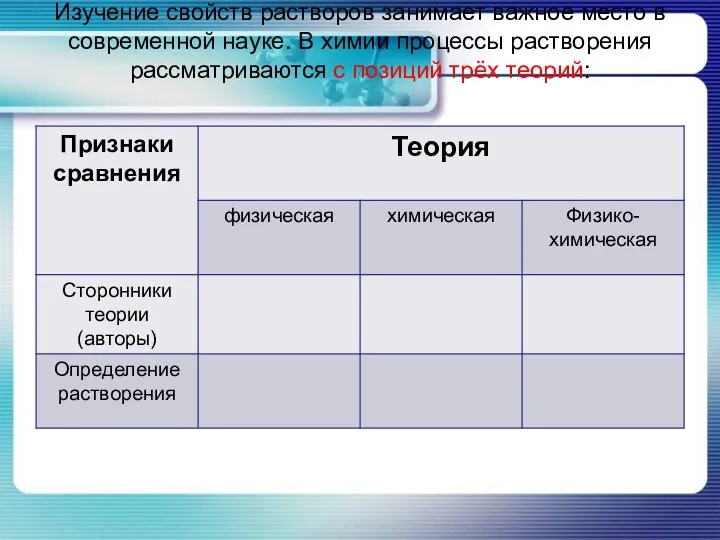
- 12. Изучение свойств растворов занимает важное место в современной науке. В химии процессы растворения рассматриваются с позиций
- 13. Изучение свойств растворов занимает важное место в современной науке. В химии процессы растворения рассматриваются с позиций
- 14. Гидраты – соединения, образованные взаимодействием вещества с водой. Кристаллогидраты – соли, в состав которых входит вода.
- 15. Какие признаки химических реакций Вы знаете?
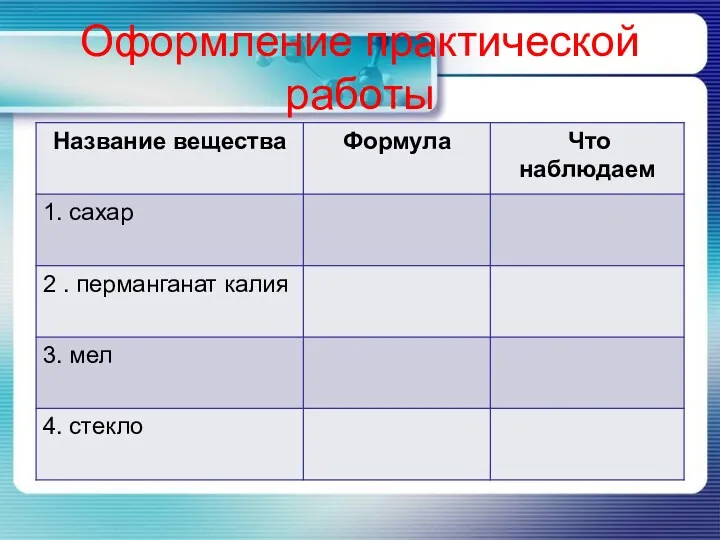
- 16. Практическая часть 1опыт. Растворение сахара. 2 опыт. Растворение перманганата калия. 3 опыт. Растворение мела. 4 опыт.
- 17. Оформление практической работы
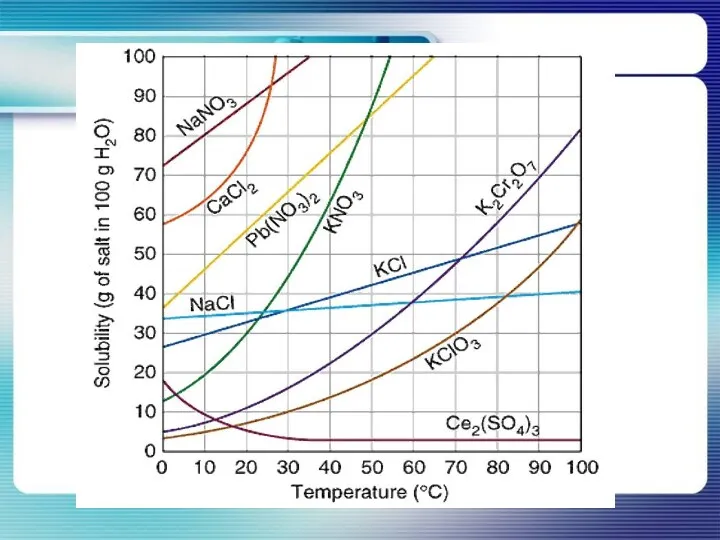
- 18. От чего зависит растворимость веществ?
- 19. Растворимость веществ зависит от: Природы вещества Природы растворителя Температуры
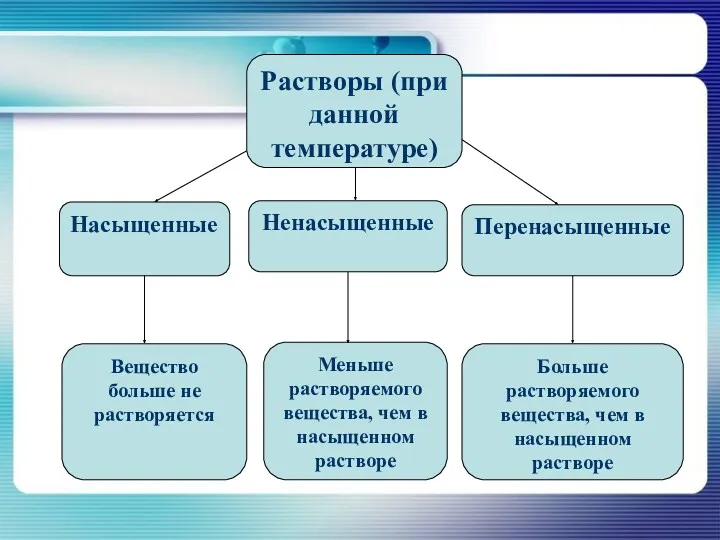
- 20. Растворы (при данной температуре) Насыщенные Ненасыщенные Перенасыщенные Вещество больше не растворяется Меньше растворяемого вещества, чем в
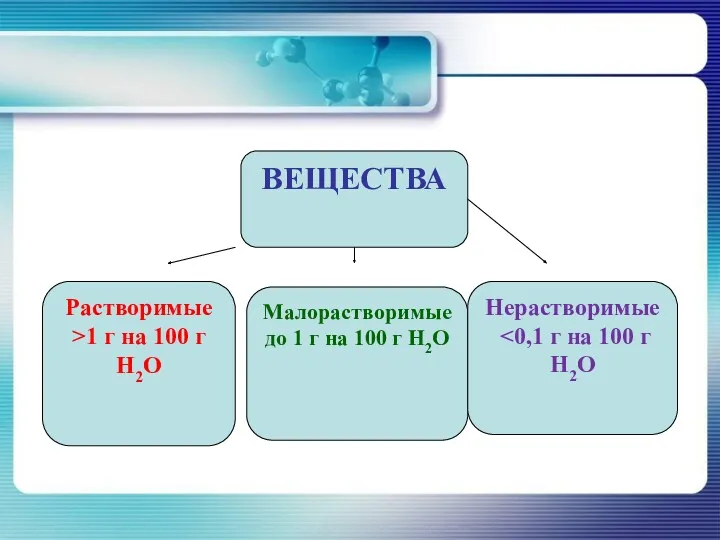
- 22. ВЕЩЕСТВА Растворимые >1 г на 100 г H2O Малорастворимые до 1 г на 100 г H2O
- 24. Решение задач Задача 1. Запишите химическое уравнение взаимодействия серной кислоты с хлоридом бария и определите (пользуясь
- 25. Тест на закрепление 1. Растворимость веществ не зависит от: А) природы растворителя Б) температуры В) давления
- 26. ответы 1. В 2. Б 3. А 4. Г 5. А
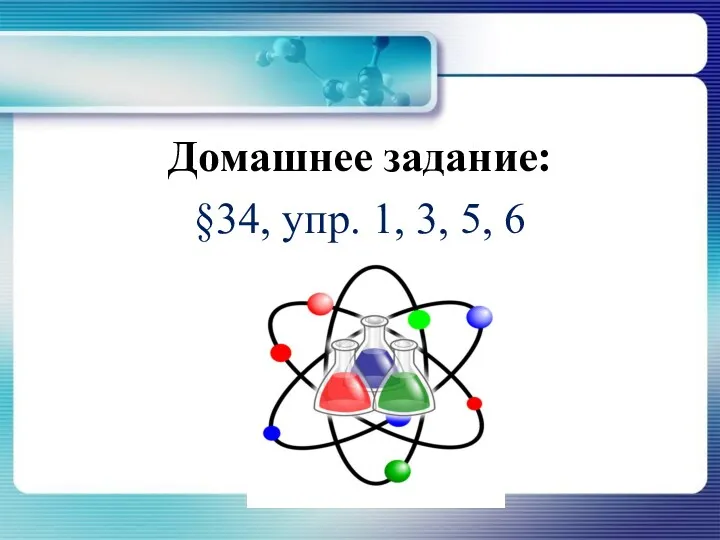
- 27. Домашнее задание: §34, упр. 1, 3, 5, 6
- 30. Скачать презентацию




















 Алмаз. Алмаз дегеніміз не
Алмаз. Алмаз дегеніміз не Аммиак: состав, строение, свойства, применение
Аммиак: состав, строение, свойства, применение Охрана труда в кабинете (лаборатории) химии образовательного учреждения
Охрана труда в кабинете (лаборатории) химии образовательного учреждения Железо и его соединения
Железо и его соединения Водневий показник ph
Водневий показник ph Повітря, його склад
Повітря, його склад Дизельное топливо
Дизельное топливо Химический состав и пищевая ценность продовольственных товаров
Химический состав и пищевая ценность продовольственных товаров Пластмаси. Класифікація пластмас
Пластмаси. Класифікація пластмас Химические свойства легкоплавких металлов
Химические свойства легкоплавких металлов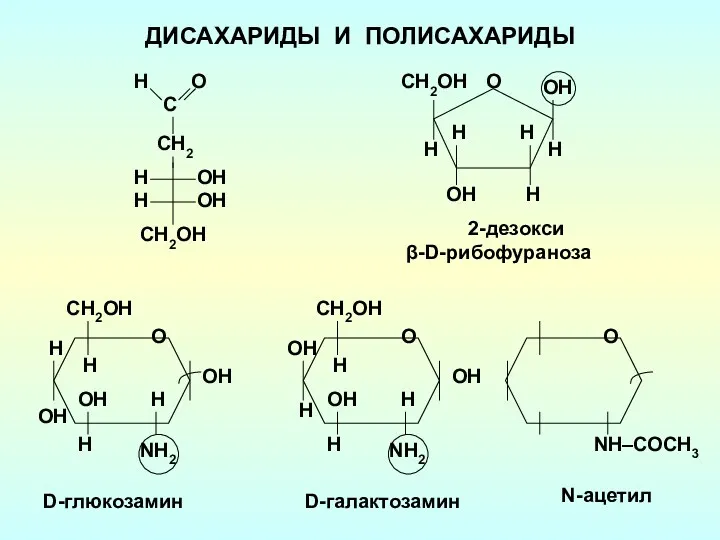 Дисахариды и полисахариды
Дисахариды и полисахариды Тема Сплавы. Чугун
Тема Сплавы. Чугун Строение и свойства материалов
Строение и свойства материалов Установка производства олефинов для синтеза линейных алкилбензолов
Установка производства олефинов для синтеза линейных алкилбензолов Амины. Анилин
Амины. Анилин Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Интеллектуальная физико-химическая игра
Интеллектуальная физико-химическая игра Алюминий и его соединения
Алюминий и его соединения Карбон қышқылдары
Карбон қышқылдары Железо и его соединения
Железо и его соединения Генетические ряды металлов, образующих нерастворимый гидроксид
Генетические ряды металлов, образующих нерастворимый гидроксид Качественное определение химических элементов в почве
Качественное определение химических элементов в почве Нанотехнологии. Отдельные представители наночастиц
Нанотехнологии. Отдельные представители наночастиц Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции ОВР – окислительно-восстановительные реакции. Тема 4
ОВР – окислительно-восстановительные реакции. Тема 4 Методика изучения растворов и основ электролитической диссоциации в школьном курсе химии
Методика изучения растворов и основ электролитической диссоциации в школьном курсе химии Простые вещества. Игра Счастливый случай
Простые вещества. Игра Счастливый случай