Методика изучения растворов и основ электролитической диссоциации в школьном курсе химии презентация
Содержание
- 2. План лекции 1. Место и значение учебного материала о растворах и ТЭД в школьном курсе химии
- 3. В курсе химии учащиеся углубляют и расширяют знания о воде и растворах сначала в теме «Вода.
- 4. Процесс растворения Для подтверждения физической стороны процесса растворения демонстрируется опыт по диффузии, который объясняется с точки
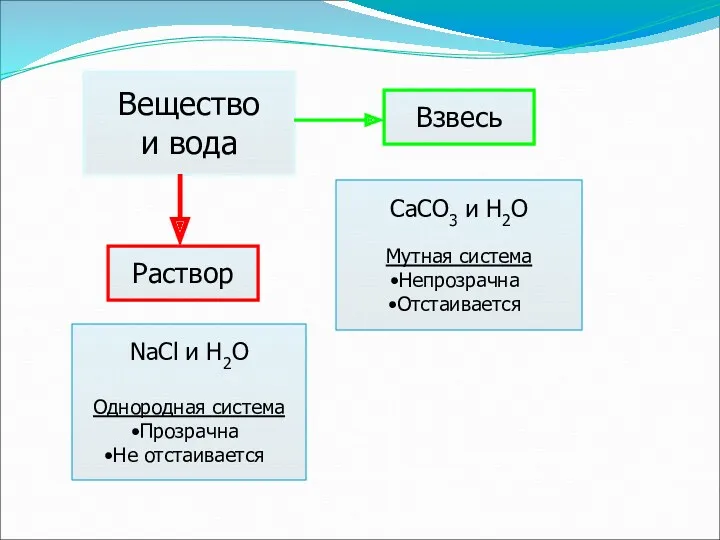
- 5. Вещество и вода Раствор Взвесь NaCl и H2O Однородная система Прозрачна Не отстаивается CaCO3 и H2O
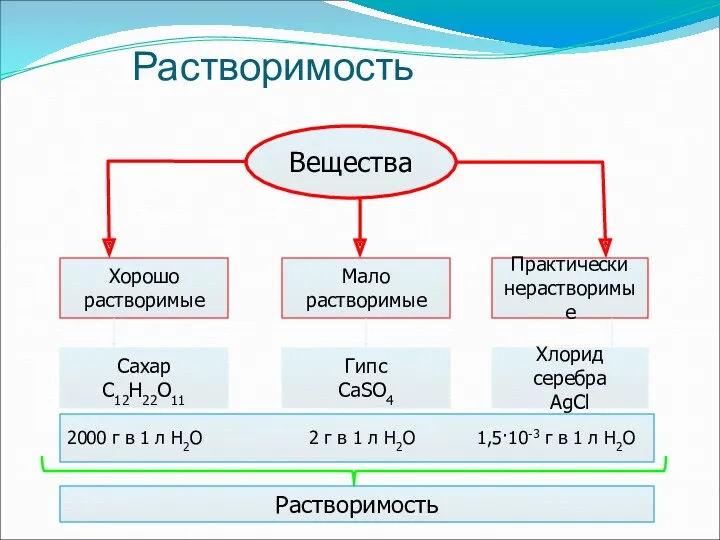
- 6. Количественные понятия Растворимость вещества показывает, сколько вещества в граммах может раствориться в воде объемом, равным одному
- 7. Растворимость Вещества Хорошо растворимые Мало растворимые Практически нерастворимые Сахар С12Н22О11 Гипс СаSO4 Хлорид серебра AgCl 2000
- 8. Различие понятий «Растворимость» и «Массовая доля растворенного вещества»
- 9. Логическим продолжением материала о растворах является тема «Электролитическая диссоциация» «Главное её назначение в том, чтобы учащиеся
- 10. Тема «Электролитическая диссоциация» Эта тема является теоретической основой курса химии 9 класса. Здесь расширяются знания о
- 11. 2. Методические подходы к изучению процессов диссоциации электролитов Существуют три важнейших методических подхода к изучению ТЭД:
- 12. Электролиты – это вещества, водные растворы которых проводят электрический ток Неэлектролиты – это вещества, водные растворы
- 13. 2. От особенностей реакций обмена к объяснению электрической проводимости Основная цель этого подхода – предотвратить возможность
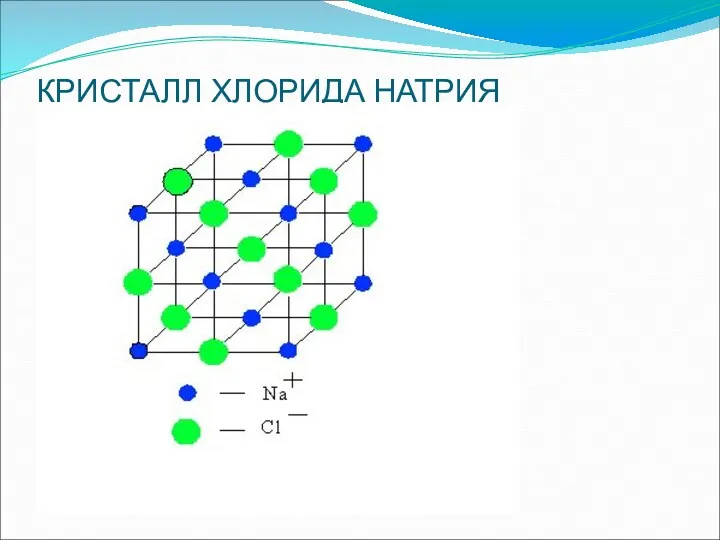
- 14. КРИСТАЛЛ ХЛОРИДА НАТРИЯ
- 15. ПОМЕЩАЕМ В СОСУД С ВОДОЙ
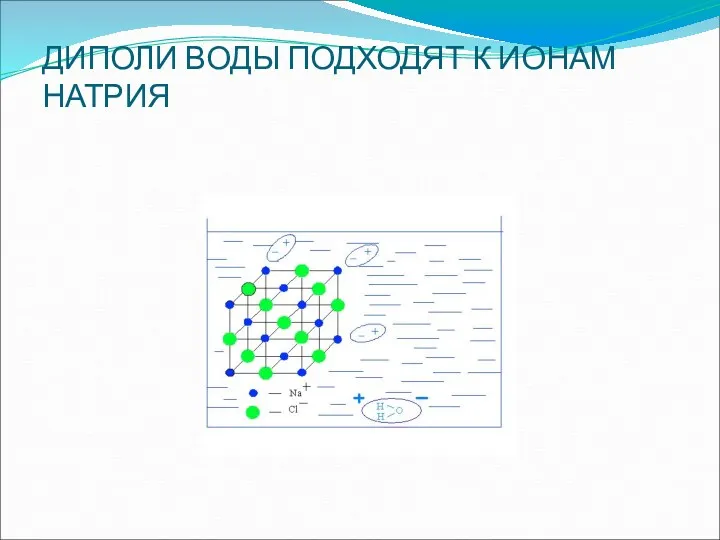
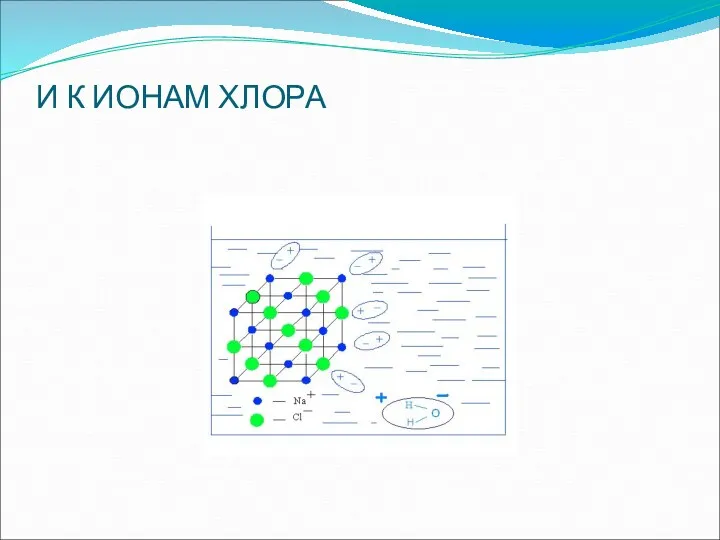
- 16. ДИПОЛИ ВОДЫ ПОДХОДЯТ К ИОНАМ НАТРИЯ
- 17. И К ИОНАМ ХЛОРА
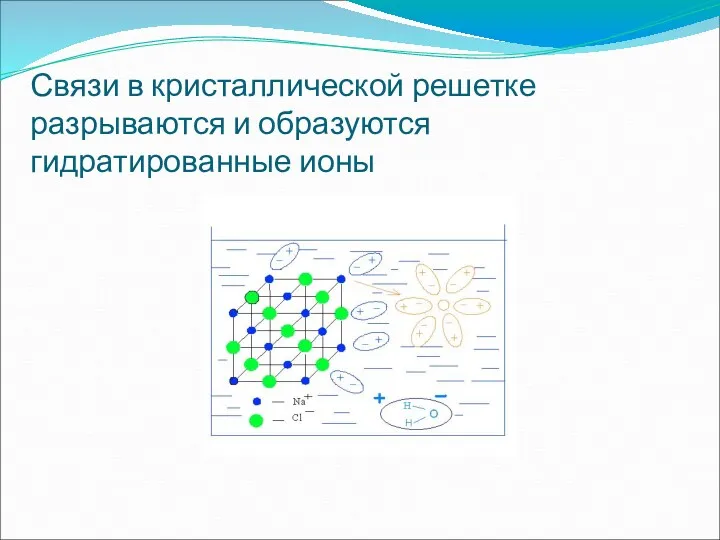
- 18. Связи в кристаллической решетке разрываются и образуются гидратированные ионы
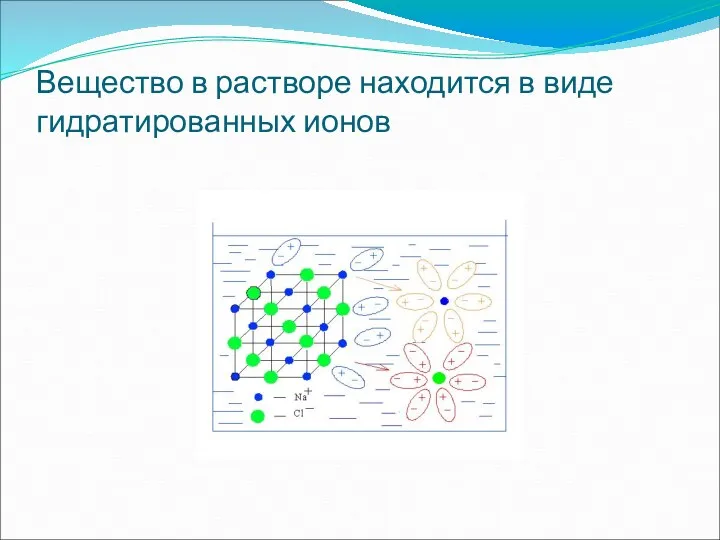
- 19. Вещество в растворе находится в виде гидратированных ионов
- 20. На основе изученного делают выводы: вещества с ионной и ковалентной полярной связью под действием полярных молекул
- 21. И только после этого кристаллические вещества и их растворы испытываются на электрическую проводимость, после чего делается
- 22. 3. От различия природы растворителей и процессов растворения веществ с различными типами и видами химической связи
- 23. Роль воды как растворителя Чтобы показать роль воды как растворителя, задаются следующие вопросы: Будет ли изменяться
- 24. В результате учащиеся приходят к следующим выводам: кислоты изменяют окраску индикаторов только в водном растворе, индикатор
- 25. Роль воды Вывод: волшебная сила воды заключена в значительной полярности ее молекул в отличие от ацетона,
- 26. В заключение делаются следующие выводы: 1., 2. Первые два те же, что при подходе № 2
- 27. 3. Развитие и обобщение знаний учащихся об основных классах неорганических соединений в свете ТЭД Особо важное
- 28. Организовать эту работу можно в пять приемов: 1. Рассмотреть электролитическую диссоциацию кислот, оснований и солей Этот
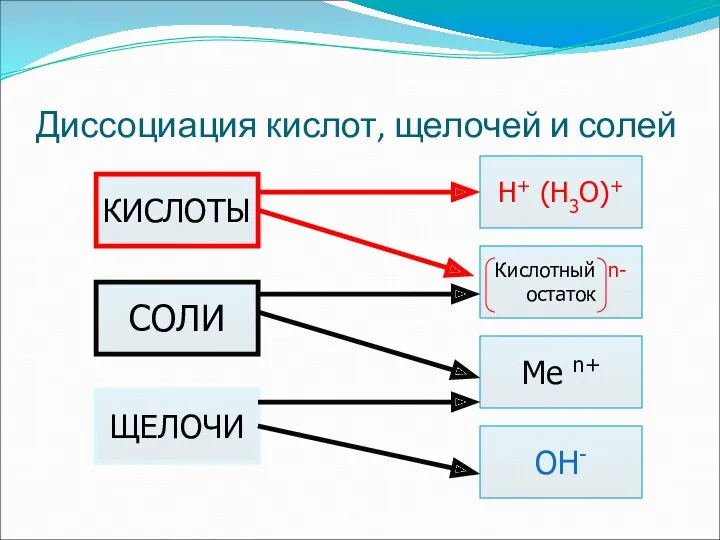
- 29. Диссоциация кислот, щелочей и солей OH- СОЛИ ЩЕЛОЧИ Н+ (Н3О)+ Кислотный n- остаток Me n+ КИСЛОТЫ
- 30. 2. Систематизировать знания о важнейших классах неорганических соединений в свете учения о природе химической связи, типах
- 31. 3. Дать определения кислот, оснований, солей в свете ТЭД Кислота – это электролит, диссоциирующий в водном
- 32. 4. Изучить реакции ионного обмена Изучение лучше начать с объяснения или повторения понятий обратимых и необратимых
- 33. 5. Рассмотреть химические свойства кислот, оснований, солей в свете ТЭД Эти уроки можно провести в форме
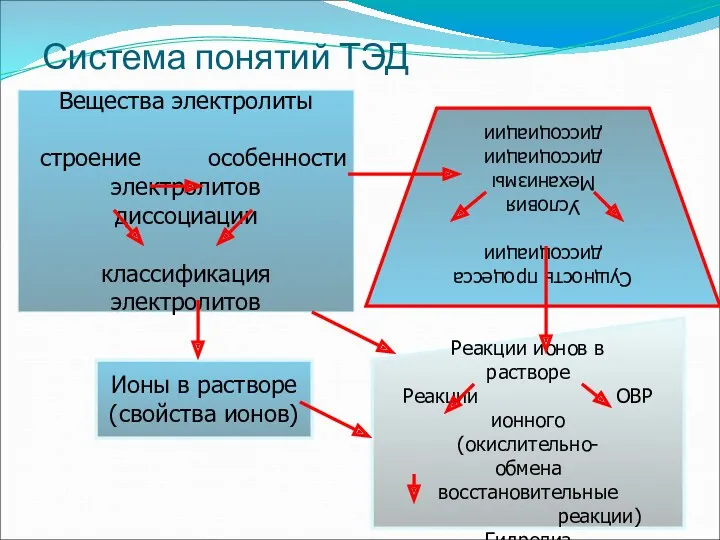
- 34. Система понятий ТЭД Вещества электролиты строение особенности электролитов диссоциации классификация электролитов Сущность процесса диссоциации Условия Механизмы
- 35. Вывод: Теория электролитической диссоциации возглавляет курс химии 9 класса и является его теоретической платформой. С этой
- 37. Скачать презентацию

























 Новые интеллектуальные материалы на основе полимеров
Новые интеллектуальные материалы на основе полимеров Спирты. Классификация спиртов
Спирты. Классификация спиртов Тест Кто хочет стать отличником по химии
Тест Кто хочет стать отличником по химии Химия и путешествия во времени. Задача 7
Химия и путешествия во времени. Задача 7 Обмен сложных липидов
Обмен сложных липидов Свободные радикалы и болезни человека
Свободные радикалы и болезни человека Химическая кинетика и катализ
Химическая кинетика и катализ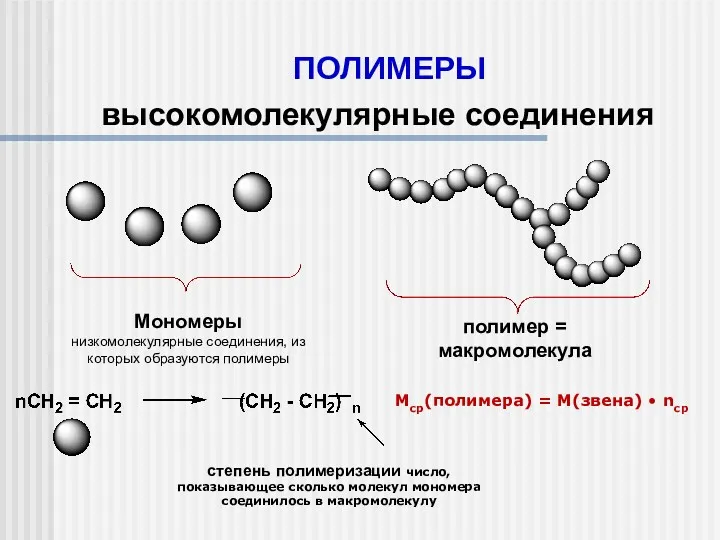 Полимеры. Высокомолекулярные соединения
Полимеры. Высокомолекулярные соединения Способы производства железоуглеродистых сплавов
Способы производства железоуглеродистых сплавов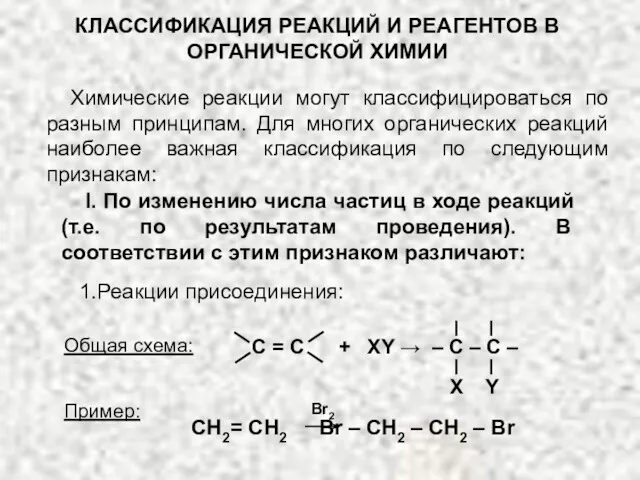 Классификация реакций и реагентов органической химии
Классификация реакций и реагентов органической химии Механические свойства минералов
Механические свойства минералов Степень окисления
Степень окисления Полімери. Будова і властивості полімерів
Полімери. Будова і властивості полімерів Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель
Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Топливо. Классификация
Топливо. Классификация Жиры и масла в косметическом производстве
Жиры и масла в косметическом производстве Вивчення властивостей полімерів і синтетичних волокон. Лабораторна робота
Вивчення властивостей полімерів і синтетичних волокон. Лабораторна робота Количественная характеристика растворов, растворение, растворимость
Количественная характеристика растворов, растворение, растворимость Химия - Кормилица. 10 класс
Химия - Кормилица. 10 класс Сложные эфиры
Сложные эфиры Молярна маса речовини
Молярна маса речовини Геохимия урана и тория в магматическом процессе
Геохимия урана и тория в магматическом процессе Периодический закон и периодическая система химических элементов Д. И. Менделеева
Периодический закон и периодическая система химических элементов Д. И. Менделеева Соединения железа. Охарактеризуйте Fe
Соединения железа. Охарактеризуйте Fe Химический состав клетки. Неорганические вещества клетки
Химический состав клетки. Неорганические вещества клетки Синтез супрамолекулярных структур
Синтез супрамолекулярных структур Химические свойства кислот
Химические свойства кислот