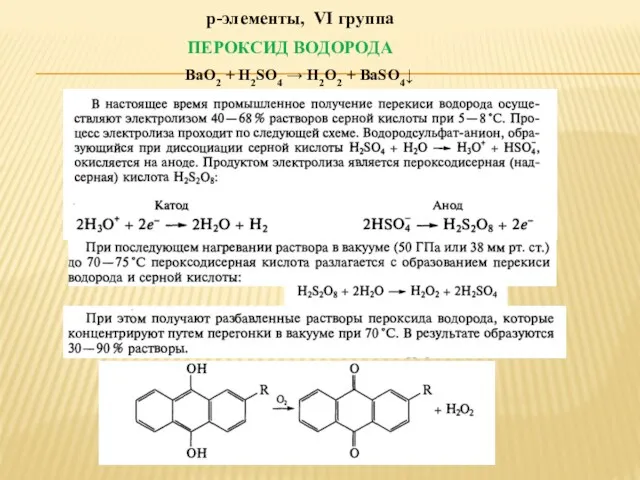
ПРЕПАРАТЫ ГАЛОГЕНИДОВ
НАТРИЯ ХЛОРИД – это единственный галогенид, который широко распространен в
природе виде каменной соли. Его получают из воды озер и морей выпариванием. Однако при этом остаются примеси. Очистку от них производят последовательно. Вначале раствором хлорида бария осаждают сульфаты и фосфаты:
Na2SO4 + BaCl2 → BaSO4 + 2NaCl
Na2HPO4 + BaCl2 → BaHPO4 + 2NaCl
MgCl2 + Na2CO3→ MgCO3 + 2NaCl
CaCl2 + Na2CO3→ CaCO3 + 2NaCl
BaCl2 + Na2CO3→ BaCO3 + 2NaCl
Na2CO3+HCl → CO2 +2NaCl+ H2O
Источники получения КАЛИЯ ХЛОРИДА – минералы сильвинит (KCl·NaCl) KCl·MgCl2·6H2O карналлит.
3Fe + 4Br2 → Fe3Br8 (FeBr2 ·2FeBr3)
Fe3Br8 + 4Na2CO3 + 4H2O → 8NaBr + 2Fe(OH)3 ↓+ 2Fe(OH)2 ↓+ 4CO2↑
3Fe + 4I2 → Fe3I8
Fe3I8 + 4Na2CO3 + 4H2O → 8NaI + 2Fe(OH)3 ↓+ 2Fe(OH)2 ↓+ 4CO2↑
Na2CO3 +2HCOONa + 2Br2 → 4NaBr + 2 CO2 + H2O
Natrii chloridum
Белые кристаллы или порошок без запаха, соленого вкуса.
Kalii chloridum
Бесцветные кристаллы или белый кристаллический порошок без запаха, соленого вкуса.
Natrii bromidi
Белые кристаллический порошок без запаха, соленого вкуса. Гигроскопичен.
Kalii bromidi
Бесцветные кристаллы или белый кристаллический порошок без запаха, соленого вкуса.












 Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Химия и проблемы охраны окружающей среды
Химия и проблемы охраны окружающей среды Дистилляция и ректификация
Дистилляция и ректификация Формула вещества. Относительная молекулярная масса. Простые и сложные вещества (8 класс)
Формула вещества. Относительная молекулярная масса. Простые и сложные вещества (8 класс) Виды мелиорации земель. Химическая реабилитация урбаноземов
Виды мелиорации земель. Химическая реабилитация урбаноземов Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування Харчові добавки
Харчові добавки Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Алкандар,жалпы формуласы, гомологтық қатары, изомерлері, атаулары
Алкандар,жалпы формуласы, гомологтық қатары, изомерлері, атаулары Органикалық қосылыстар
Органикалық қосылыстар Начало нанотехнологической эры. Фуллерены
Начало нанотехнологической эры. Фуллерены Сполуки неметалічних елементів з гідрогеном. Амоніак та хлороводень
Сполуки неметалічних елементів з гідрогеном. Амоніак та хлороводень Морфология тел полезных ископаемых
Морфология тел полезных ископаемых Физические и химические свойства оснований
Физические и химические свойства оснований Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Скорость химических реакций. Факторы, влияющие на скорость химической реакции (лекция № 5)
Скорость химических реакций. Факторы, влияющие на скорость химической реакции (лекция № 5) Закономерности химических элементов ряда Фибоначчи
Закономерности химических элементов ряда Фибоначчи Химические свойства кислот
Химические свойства кислот Коллигативные свойства растворов
Коллигативные свойства растворов Химические реакции органических соединений
Химические реакции органических соединений Теорія горіння та вибуху
Теорія горіння та вибуху Тяжелые металлы
Тяжелые металлы Строение и свойства материалов. Тема 1.1
Строение и свойства материалов. Тема 1.1 Кислоты. Общая характеристика, химические свойства
Кислоты. Общая характеристика, химические свойства Водород и его свойства
Водород и его свойства Фосфор
Фосфор Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування
Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування