Содержание
Слайд 2
43
43
Слайд 3
43
Поскольку оксид - бинарное соединение кислорода и другого элемента, если мольная
43
Поскольку оксид - бинарное соединение кислорода и другого элемента, если мольная
доля хрома в нем- 25%, то мольная доля кислорода - 100%-25% = 75%, и количества атомов хрома и кислорода в оксиде относятся как 25/75 = 1/3, что соответствует простейшей формуле оксида - CrO3.
Слайд 4
44
Как известно, состояние газа определяется объёмом V, давлением p и температурой
44
Как известно, состояние газа определяется объёмом V, давлением p и температурой
T. Для идеального газа эти величины связаны уравнением Клапейрона-Менделеева: pV = vRT, где R – универсальная газовая постоянная, имеющая во внесистемных единицах, значение – 8,314 кПа×л/(К×моль), T – температура в Кельвинах, T = 273 + t oC.
Большинство школьных экспериментов проводятся при комнатной температуре 21оС и давлении в 1 атм. В школьной лаборатории решили получить углекислый газ. Для этого в аппарат Киппа поместили 110 г мраморных осколков (содержащих 10% инертных примесей), а затем начали добавлять соляную кислоту. 1) Запишите уравнение реакции растворения. Определите максимальный объём выделившегося газа. В лабораторию поступил баллон с газом Х. Рабочие характеристики баллона: объём – 50 литров, масса – 51,5 кг, давление газа – 150 атм. при комнатной температуре, масса с газом – 63,936 кг. 2) Определите газ Х. Ответ подтвердите расчётом. Для чего применяется газ Х в лабораторном синтезе? Как получают газ Х? Смесь углекислого газа и газа Y массой 17,2 г при 50оС и нормальном давлении занимает объём 13,25 л. При пропускании этой смеси через известковую воду выпадает 20 г осадка. 3) Напишите необходимое уравнение реакции. Рассчитайте молярную массу газа Y. Приведите формулы не менее трёх газов, которые удовлетворяют условию задачи.
Большинство школьных экспериментов проводятся при комнатной температуре 21оС и давлении в 1 атм. В школьной лаборатории решили получить углекислый газ. Для этого в аппарат Киппа поместили 110 г мраморных осколков (содержащих 10% инертных примесей), а затем начали добавлять соляную кислоту. 1) Запишите уравнение реакции растворения. Определите максимальный объём выделившегося газа. В лабораторию поступил баллон с газом Х. Рабочие характеристики баллона: объём – 50 литров, масса – 51,5 кг, давление газа – 150 атм. при комнатной температуре, масса с газом – 63,936 кг. 2) Определите газ Х. Ответ подтвердите расчётом. Для чего применяется газ Х в лабораторном синтезе? Как получают газ Х? Смесь углекислого газа и газа Y массой 17,2 г при 50оС и нормальном давлении занимает объём 13,25 л. При пропускании этой смеси через известковую воду выпадает 20 г осадка. 3) Напишите необходимое уравнение реакции. Рассчитайте молярную массу газа Y. Приведите формулы не менее трёх газов, которые удовлетворяют условию задачи.
- Предыдущая
Ағылшын тіліСледующая -
Великий Абай


 Соединения галогенов
Соединения галогенов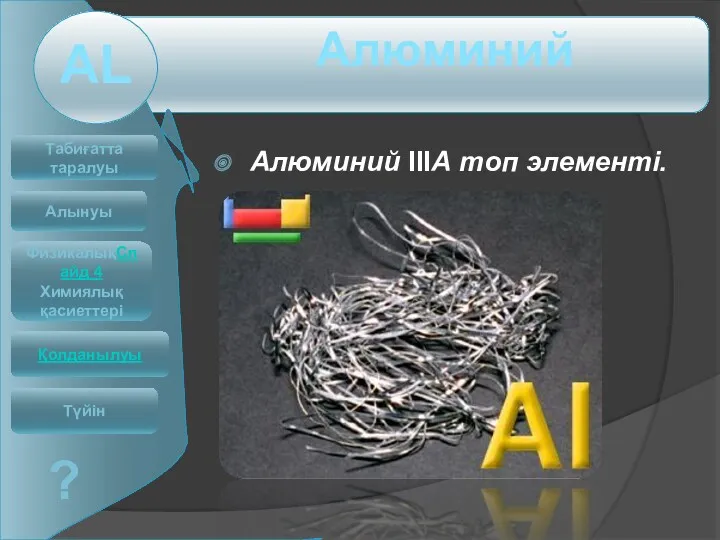 Алюминий IIIА топ элементі
Алюминий IIIА топ элементі О проекте концепции преподавания химии в РФ
О проекте концепции преподавания химии в РФ Типы химических реакций
Типы химических реакций Аналитическая химия. Количественный анализ (ч.1. титриметрия)
Аналитическая химия. Количественный анализ (ч.1. титриметрия) Кислоты. Удивительные факты
Кислоты. Удивительные факты Строение атомов. Понятие о квантовой механике
Строение атомов. Понятие о квантовой механике Производство серной кислоты
Производство серной кислоты Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Азот. Нахождение в природе
Азот. Нахождение в природе Волокнистое сырьё. Технологические и эксплуатационные свойства
Волокнистое сырьё. Технологические и эксплуатационные свойства Липиды (жиры)
Липиды (жиры) Процессы нитрозирования и основные реакции диазосоединений
Процессы нитрозирования и основные реакции диазосоединений Особливості горіння дисперсних систем
Особливості горіння дисперсних систем Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16)
Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16) Твердые вещества
Твердые вещества Хроматографические методы анализа
Хроматографические методы анализа Атомы и молекулы
Атомы и молекулы Высокомолекулярные соединения (синтетическое волокно капрон)
Высокомолекулярные соединения (синтетическое волокно капрон) CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі
CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі Откуда берутся кристаллы
Откуда берутся кристаллы Прості й складні речовини. Хімічні формули. Метали і неметали
Прості й складні речовини. Хімічні формули. Метали і неметали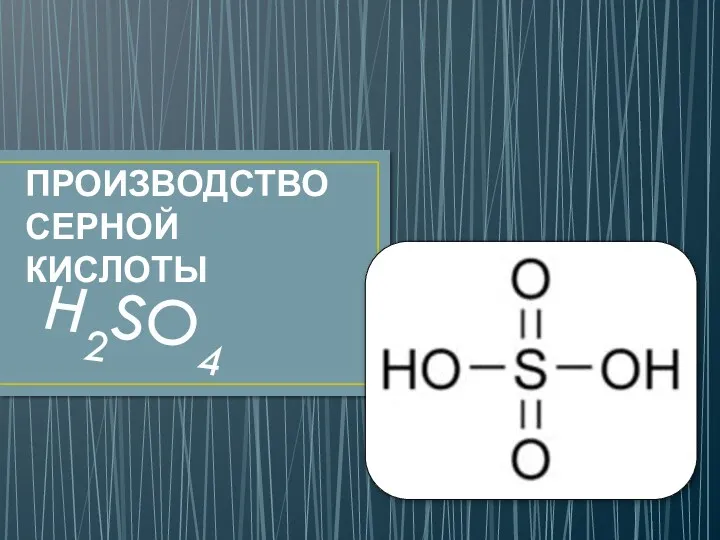 Производство серной кислоты
Производство серной кислоты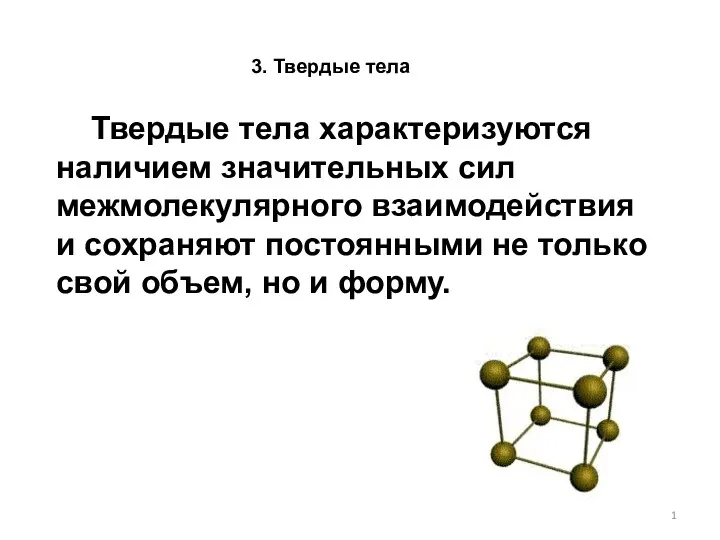 Твердые тела
Твердые тела Углеводороды (классификация и номенклатура)
Углеводороды (классификация и номенклатура) Кислородсодержащие соединения серы. Оксиды серы
Кислородсодержащие соединения серы. Оксиды серы Химическая посуда
Химическая посуда Полиэтилен
Полиэтилен