Содержание
- 2. А история простая… Один учёный как-то раз, Оксид какой-то нагревая, Обнаружил странный газ – Газ без
- 3. «Кислород, как бог, - вездесущий, всемогущий, невидимый». Овидий.
- 4. Разминка. 1.Назовите газ, которым мы дышим. 2.Назовите формулу этого газа. 3.Какие аллотропные видоизменения химического элемента кислорода
- 5. 7.Как в лаборатории можно получить озон? 8. Какой их аллотропных видоизменений химического элемента кислорода – О2
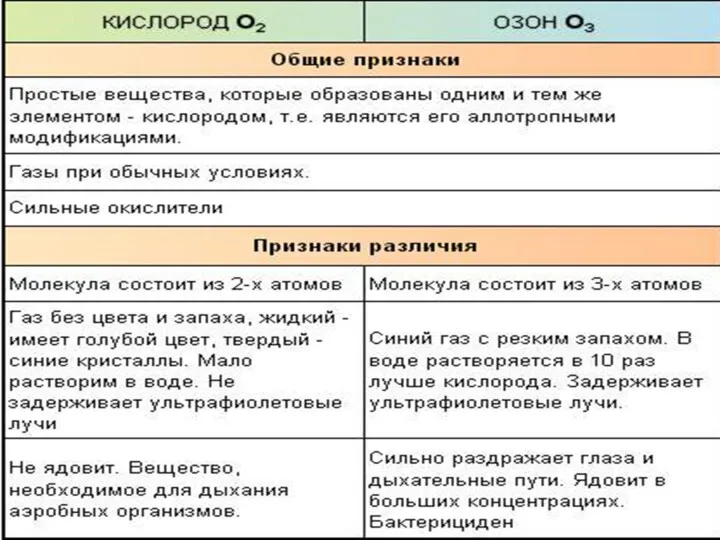
- 7. Аллотропия кислорода: Кислород и озон
- 8. Распространение в природе Кислород — самый распространенный на Земле элемент, на его долю приходится около 47,4
- 9. Кислород малорастворим в воде (примерно 1 объем на 20 объемов воды). При температуре –183°C кислород сжижается
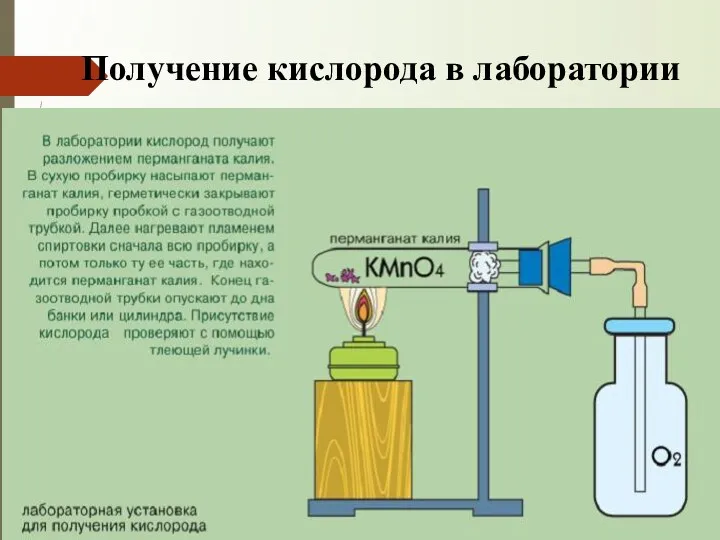
- 10. Получение кислорода в лаборатории
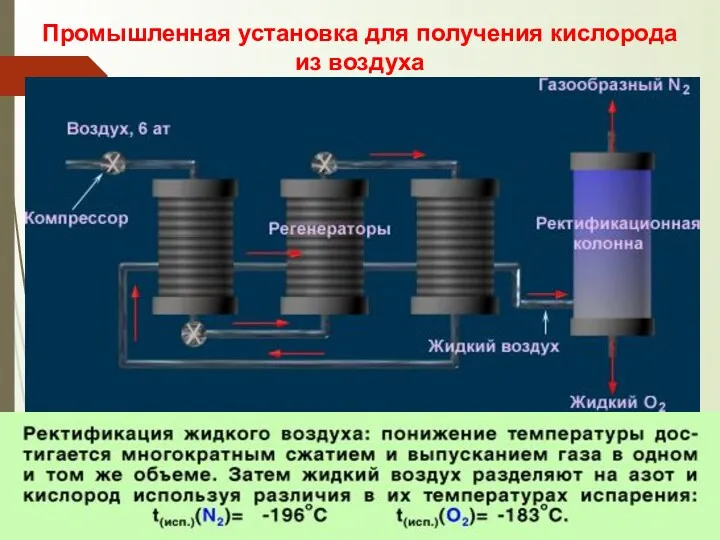
- 12. Промышленная установка для получения кислорода из воздуха
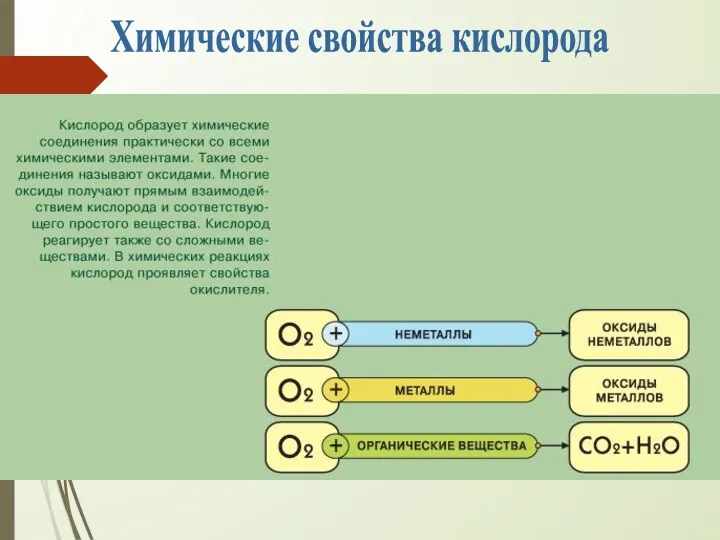
- 13. Химические свойства кислорода
- 14. С неметаллами: С + О2 = СО2 S + О2= SО2 P + О2=P2O5 рассмотрите последнюю
- 15. С металлами Наиболее активными Ме в реакциях окисления являются щелочные и щелочно-земельные Ме. Примеры? В случаях
- 16. Кислород образует с металлами пероксиды со степенью окисления −1. Пероксиды получаются при сгорании активных металлов в
- 17. Окисляет соединения, которые содержат элементы с не максимальной степенью окисления: 2NO + O2 =2NO2 2CO +
- 18. В кислороде сгорают многие сложные вещества Силан SiH4 + 2O2 = SiO2 +2H2O Сероводород 2H2S +
- 19. Применение В металлургии Сварка и резка металлов Ракетное топливо В качестве окислителя для ракетного топлива применяется
- 21. Скачать презентацию














 Химия нефти и газа
Химия нефти и газа Ацидиметрия. Стандартизация
Ацидиметрия. Стандартизация Методика проверки и оценивания заданий с развернутым ответом линии 30 и 31
Методика проверки и оценивания заданий с развернутым ответом линии 30 и 31 Геохимические показатели техногенеза
Геохимические показатели техногенеза Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар Электрохимический ряд напряжения металлов
Электрохимический ряд напряжения металлов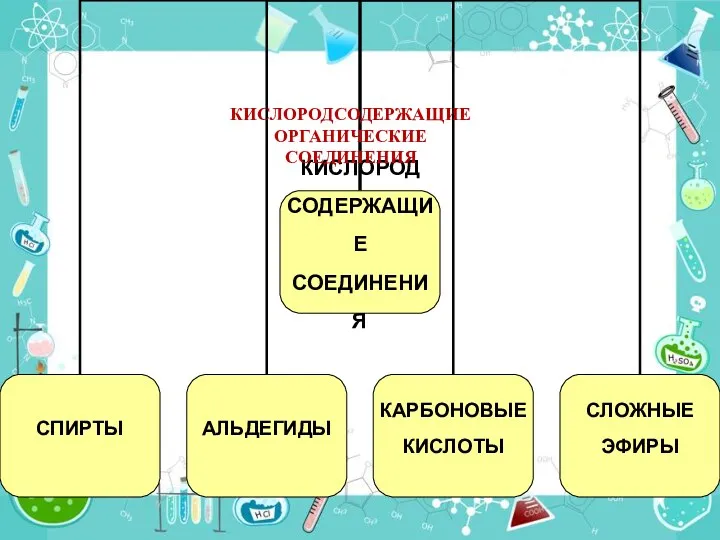 Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Классификация химических элементов. 8 класс
Классификация химических элементов. 8 класс альдегиды, свойства, получение
альдегиды, свойства, получение Углерод, аллотропные модификации
Углерод, аллотропные модификации Методы определения Тст и Тт полимеров
Методы определения Тст и Тт полимеров Что такое алмаз
Что такое алмаз Закон сохранения массы вещества. Уравнения химических
Закон сохранения массы вещества. Уравнения химических Алкадиены
Алкадиены Азотная кислота и ее соли
Азотная кислота и ее соли Синтетические моющие средства
Синтетические моющие средства Полезные геологические химические соединения. Получение меди из малахита
Полезные геологические химические соединения. Получение меди из малахита Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Хімічні формули речовин. Урок №14
Хімічні формули речовин. Урок №14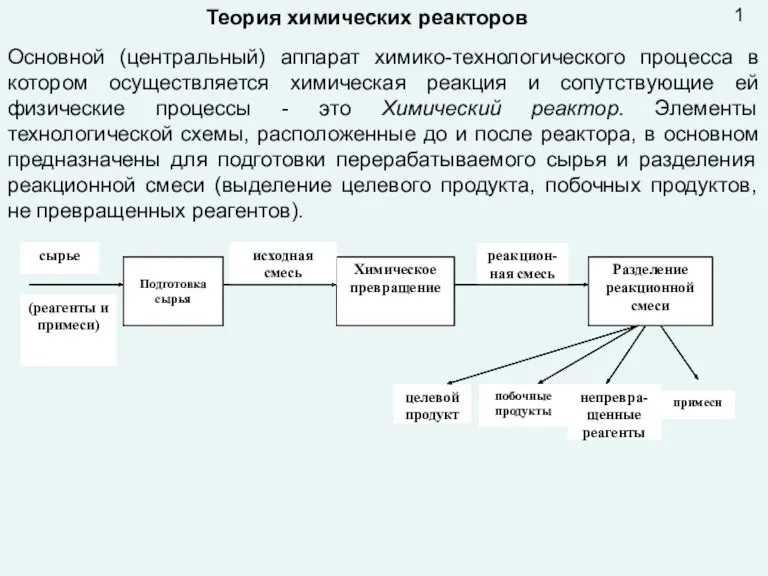 Презентация лекция 9 Реактора
Презентация лекция 9 Реактора Азотная кислота
Азотная кислота Основные классы неорганических соединений
Основные классы неорганических соединений Химия органических соединений. Углеводороды
Химия органических соединений. Углеводороды Токсическое действие диоксинов и диоксиноподоных соединений
Токсическое действие диоксинов и диоксиноподоных соединений Аммиак. 9 класс
Аммиак. 9 класс Полимеры. Мономер
Полимеры. Мономер Чистые вещества и смеси
Чистые вещества и смеси Спирти
Спирти