Содержание
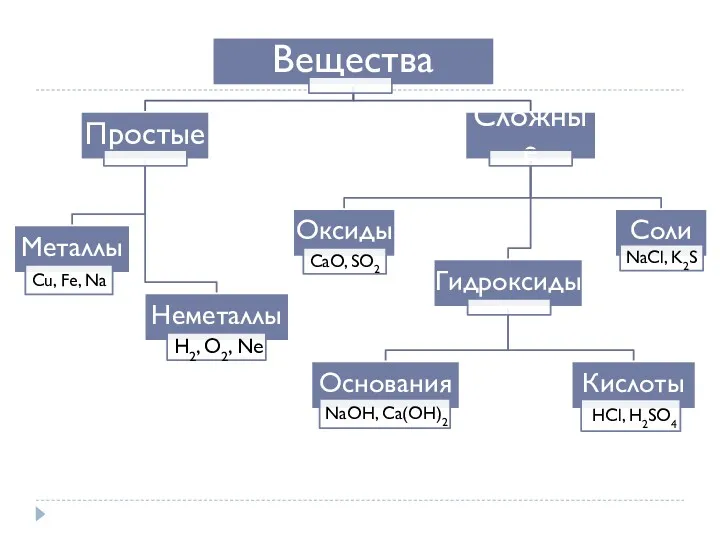
- 3. Простые вещества Металлы І группа главная подгруппа – щелочные металлы ІІ группа главная подгруппа – щелочноземельные
- 4. Металлы. Неметаллы
- 5. Физические свойства простых веществ
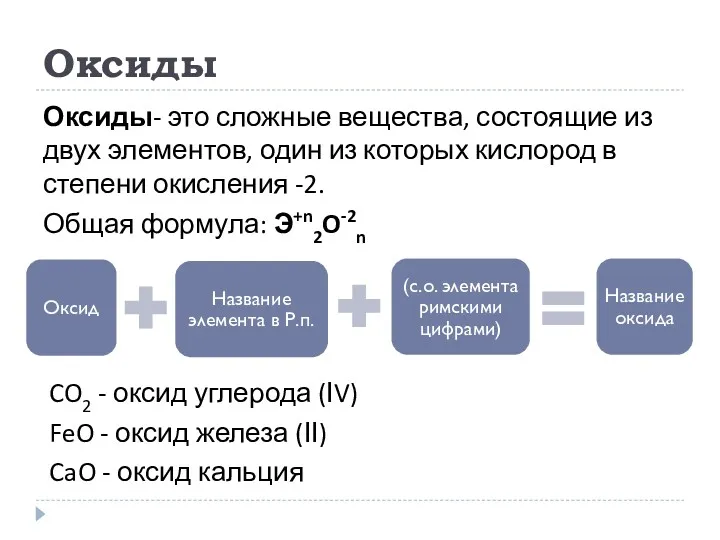
- 6. Оксиды Оксиды- это сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления
- 7. Оксиды 1) Несолеобразующие - CO, SiO, N2O, NO, NO2 2) Солеобразующие Основные – металлы со с.о.
- 8. Гидриды Гидриды - соединения водорода с металлами или менее электроотрицательными, чем водород, неметаллами. LiH, CaH2, AlH3
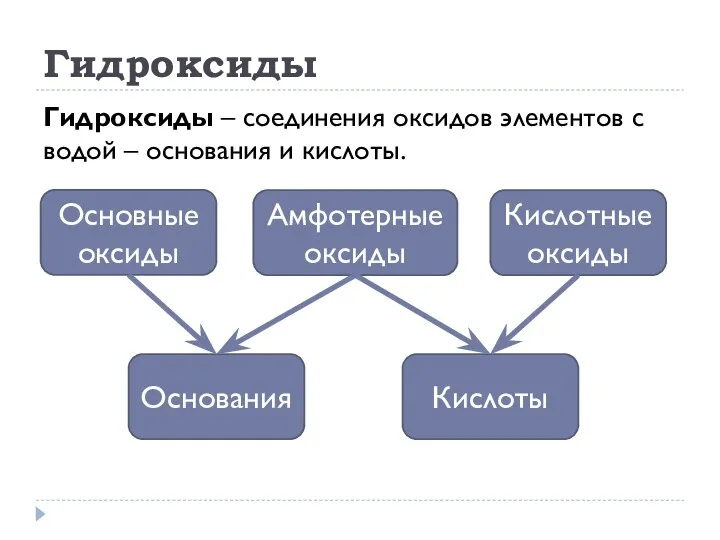
- 9. Гидроксиды Гидроксиды – соединения оксидов элементов с водой – основания и кислоты.
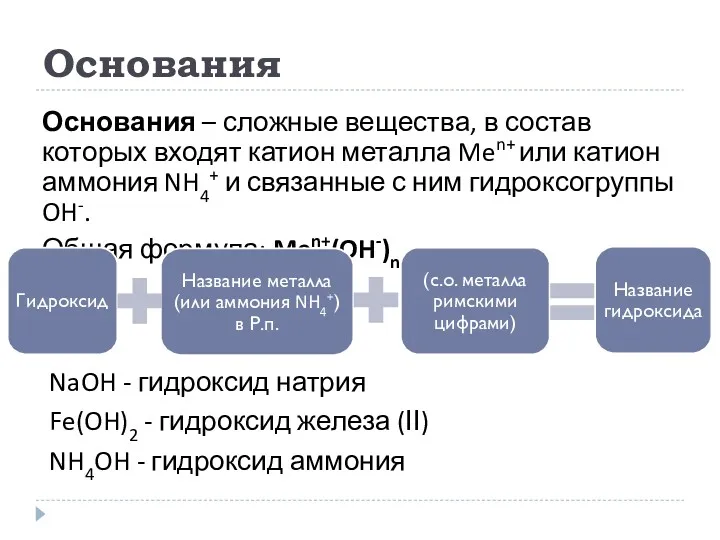
- 10. Основания Основания – сложные вещества, в состав которых входят катион металла Men+ или катион аммония NH4+
- 11. Основания По числу гидроксогрупп OH: Однокислотные – NaOH, KOH Двухкислотные – Ca(OH)2, Ba(OH)2 Многокислотные – Al(OH)3,
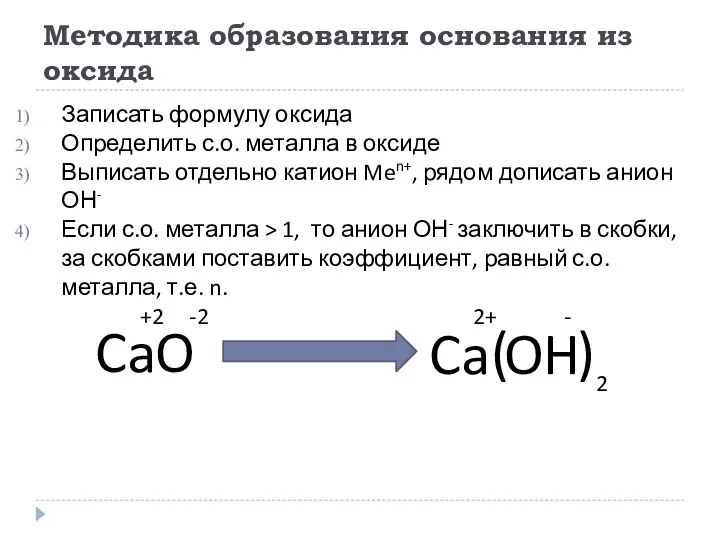
- 12. Методика образования основания из оксида Записать формулу оксида Определить с.о. металла в оксиде Выписать отдельно катион
- 13. Кислоты Кислоты – сложные вещества, молекулы которых состоят из атомов водорода Н+ и кислотных остатков Аm-.
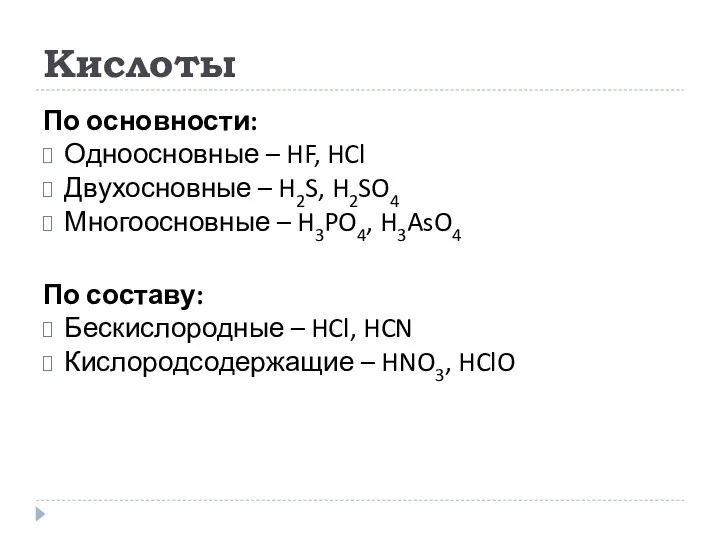
- 14. Кислоты По основности: Одноосновные – HF, HCl Двухосновные – H2S, H2SO4 Многоосновные – H3PO4, H3AsO4 По
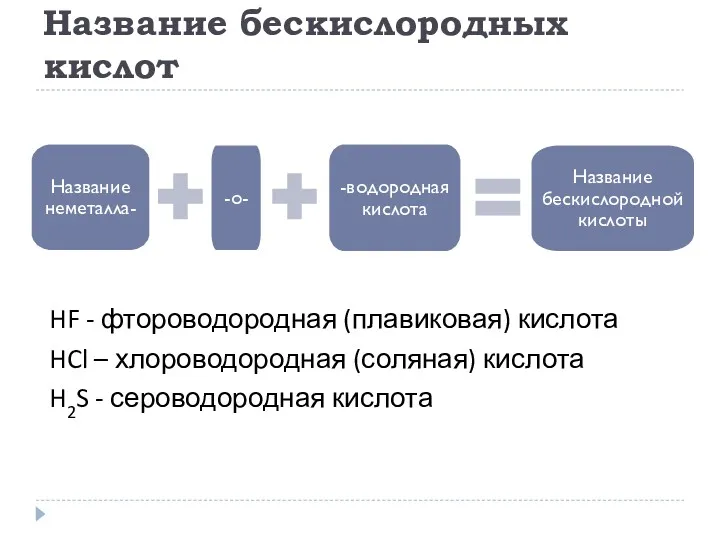
- 15. Название бескислородных кислот HF - фтороводородная (плавиковая) кислота HCl – хлороводородная (соляная) кислота H2S - сероводородная
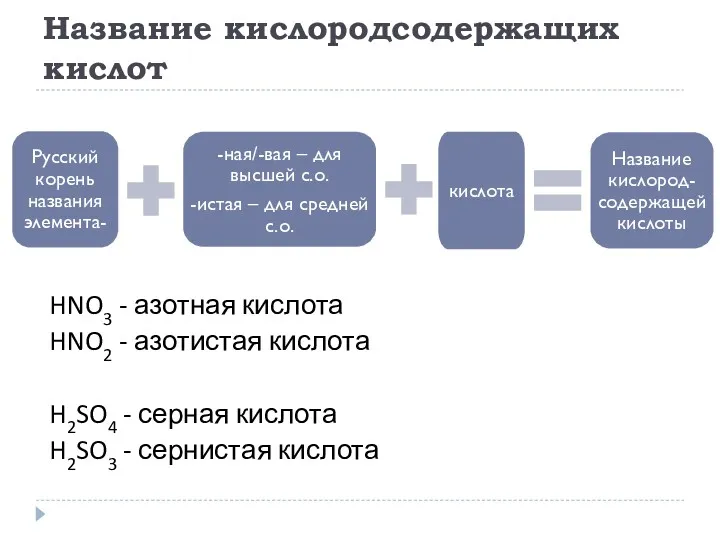
- 16. Название кислородсодержащих кислот HNO3 - азотная кислота HNO2 - азотистая кислота H2SO4 - серная кислота H2SO3
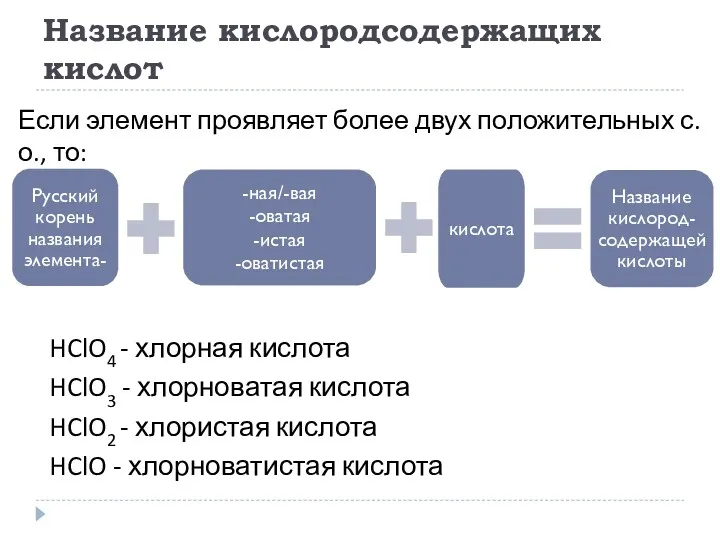
- 17. Название кислородсодержащих кислот HClO4 - хлорная кислота HClO3 - хлорноватая кислота HClO2 - хлористая кислота HClO
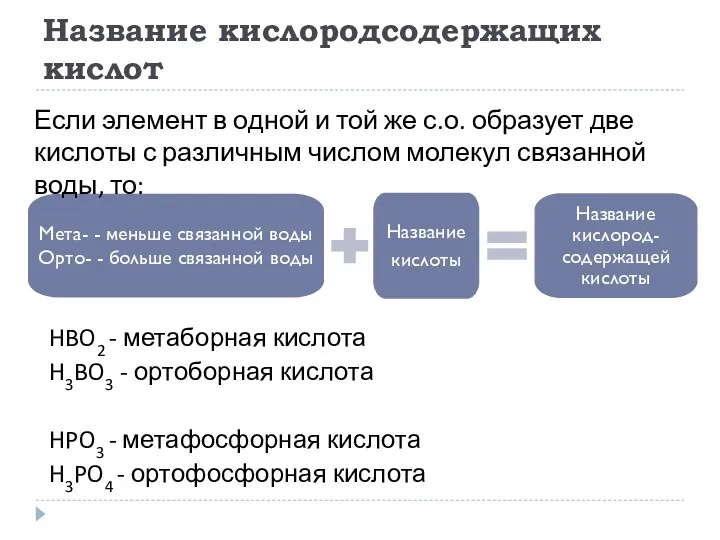
- 18. Название кислородсодержащих кислот HBO2 - метаборная кислота H3BO3 - ортоборная кислота HPO3 - метафосфорная кислота H3PO4
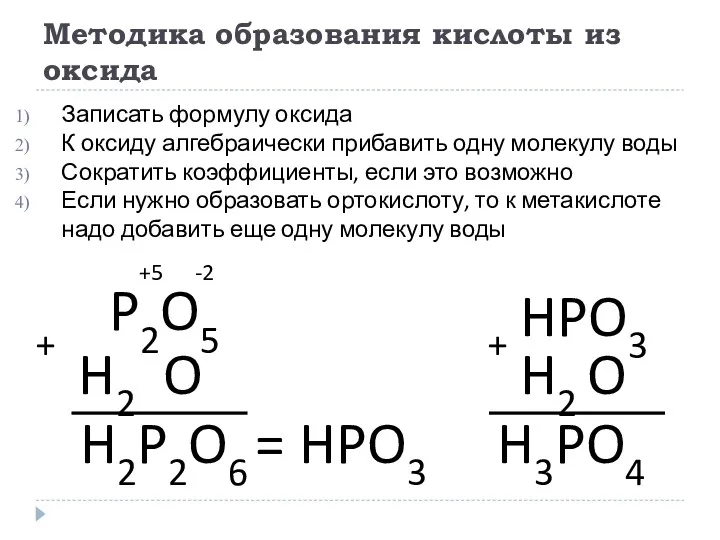
- 19. Методика образования кислоты из оксида Записать формулу оксида К оксиду алгебраически прибавить одну молекулу воды Сократить
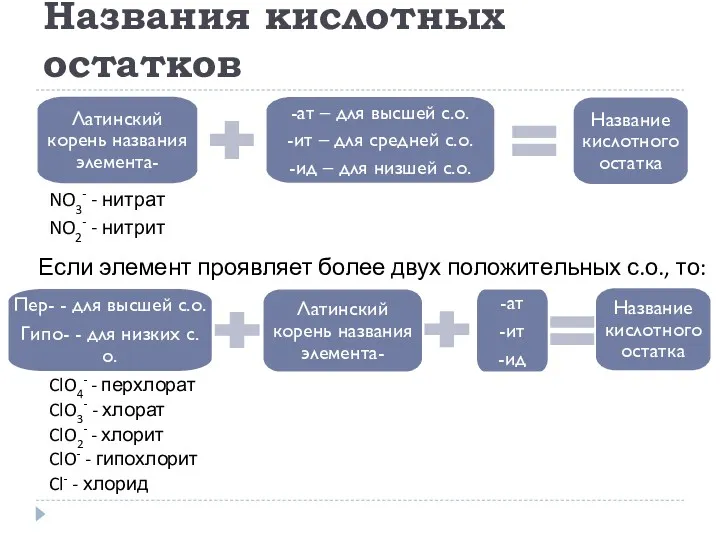
- 20. Названия кислотных остатков Если элемент проявляет более двух положительных с.о., то: ClO4- - перхлорат ClO3- -
- 21. Соли 1) Как продукты замены протонов в кислотах или гидроксогрупп в основаниях: Средние – KBr, CaSO4
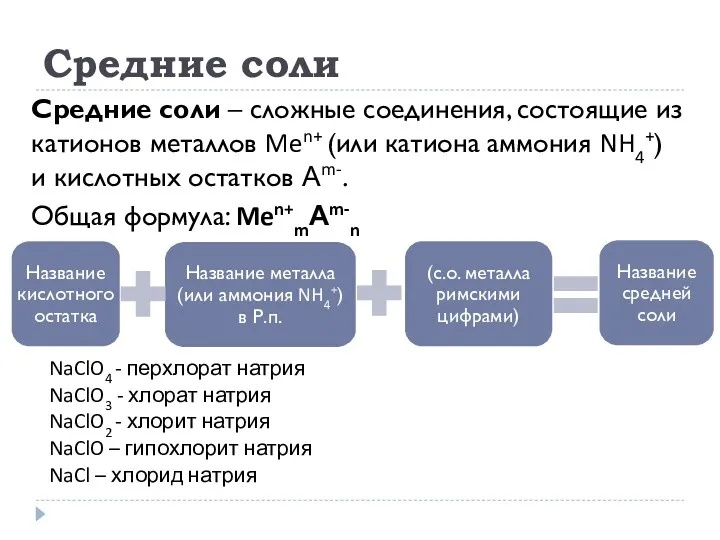
- 22. Средние соли Средние соли – сложные соединения, состоящие из катионов металлов Men+ (или катиона аммония NH4+)
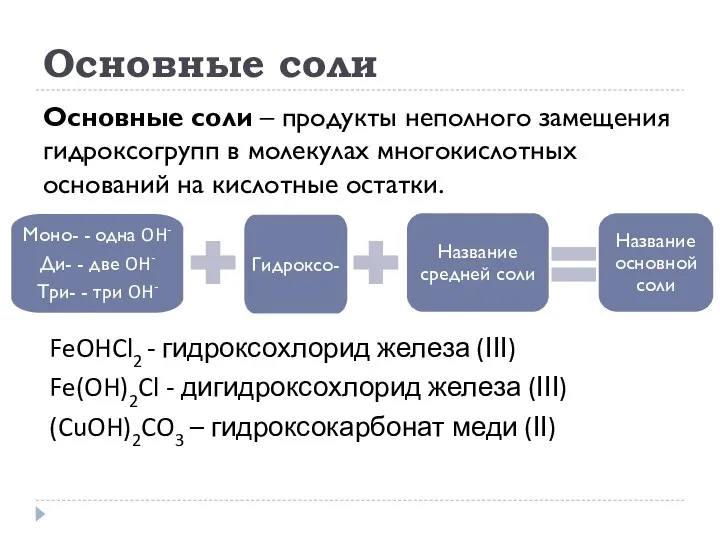
- 23. Основные соли Основные соли – продукты неполного замещения гидроксогрупп в молекулах многокислотных оснований на кислотные остатки.
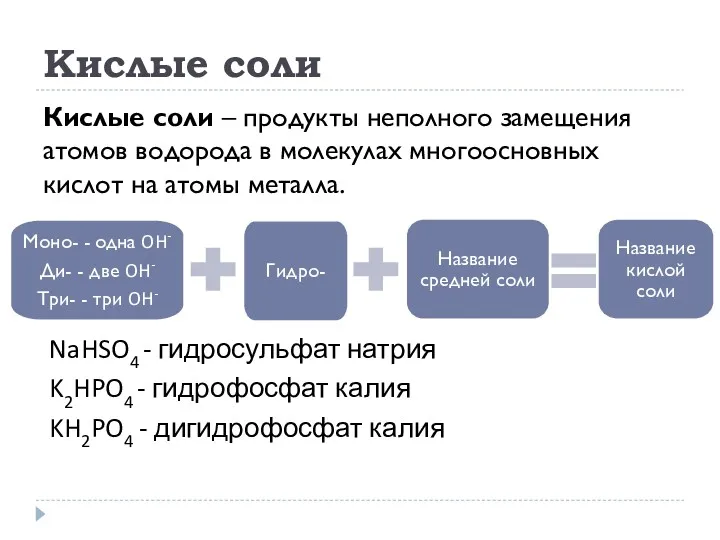
- 24. Кислые соли Кислые соли – продукты неполного замещения атомов водорода в молекулах многоосновных кислот на атомы
- 25. По числу присутствующих в структуре катионов и анионов Двойные соли – соли, содержащие два типа катионов.
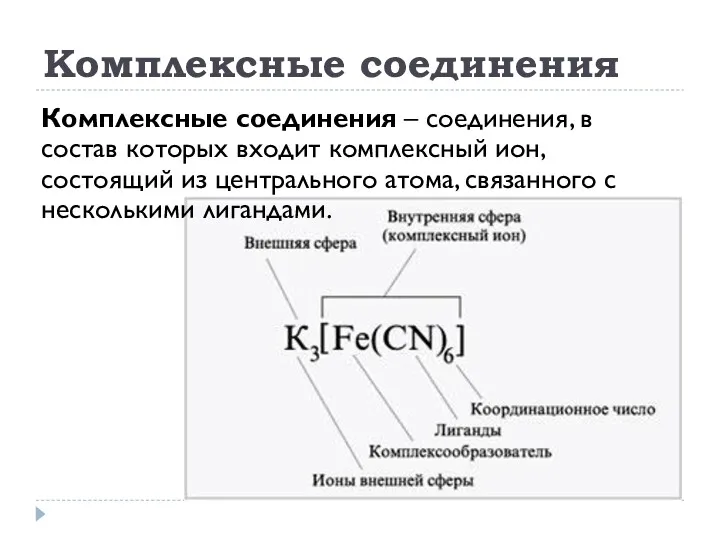
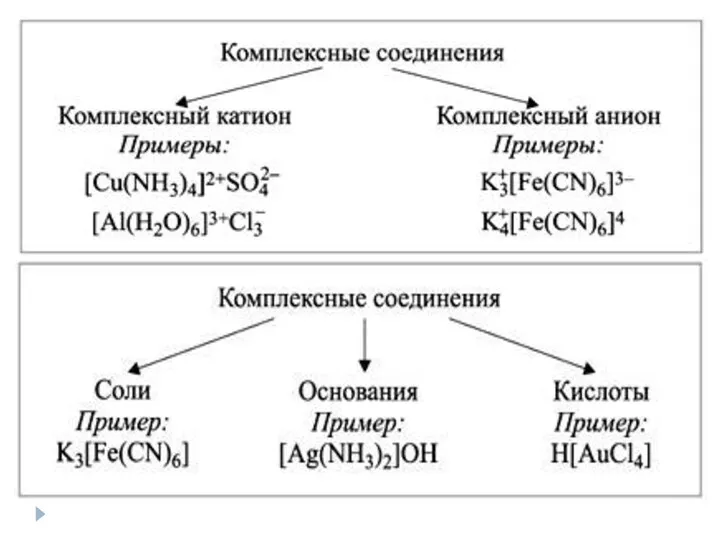
- 26. Комплексные соединения Комплексные соединения – соединения, в состав которых входит комплексный ион, состоящий из центрального атома,
- 28. Номенклатура комплексных соединений Если комплексный – анион: 1) Число лигандов (греческие числительные) 2) Латинское название лиганда
- 29. Номенклатура комплексных соединений Если комплексный – катион: 1) Число анионов внешней сферы 2) Латинское название анионов
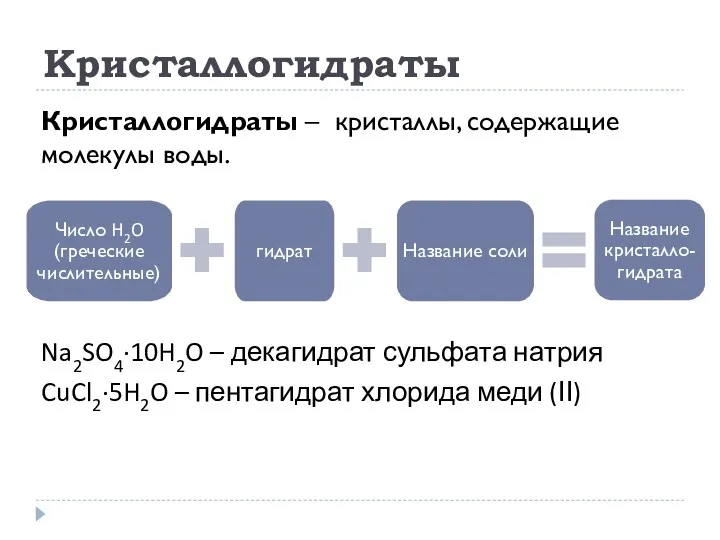
- 30. Кристаллогидраты Кристаллогидраты – кристаллы, содержащие молекулы воды. Na2SO4·10H2O – декагидрат сульфата натрия CuCl2·5H2O – пентагидрат хлорида
- 32. Скачать презентацию











 Основы коррозии и защиты металлов. Виды коррозии металлов
Основы коррозии и защиты металлов. Виды коррозии металлов Нефть и продукты её переработки
Нефть и продукты её переработки Исследовательский проект определение качества питьевой воды в домашних условиях
Исследовательский проект определение качества питьевой воды в домашних условиях Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение Строение атома
Строение атома Непредельные углеводороды этиленового ряда (олефины, алкены)
Непредельные углеводороды этиленового ряда (олефины, алкены) Классы неорганических соединений. 8 класс
Классы неорганических соединений. 8 класс Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Химия и производство
Химия и производство Химическое равновесие
Химическое равновесие λ-MnO2 as material with pseudocapacitive properties
λ-MnO2 as material with pseudocapacitive properties Состав и классификация магматических горных пород
Состав и классификация магматических горных пород The Sulphur cycle. The Sulphur dioxide problems
The Sulphur cycle. The Sulphur dioxide problems Галогены. Историческая справка
Галогены. Историческая справка Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології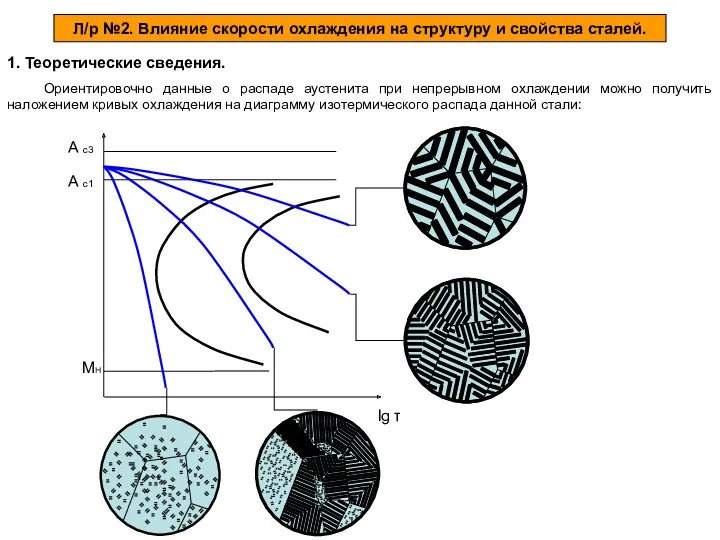 Влияние скорости охлаждения на структуру и свойства сталей
Влияние скорости охлаждения на структуру и свойства сталей Записать формулы
Записать формулы Гидролиз неорганических веществ - солей. (11 класс)
Гидролиз неорганических веществ - солей. (11 класс) Влияние фтора на организм человека
Влияние фтора на организм человека Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Свойства простых веществ, кислот и солей в свете OBP. 8 класс
Свойства простых веществ, кислот и солей в свете OBP. 8 класс Полимерные растворы. Условия образования
Полимерные растворы. Условия образования Гидродинамические модели реакторов. Лекция № 2
Гидродинамические модели реакторов. Лекция № 2 Определение физических свойств минералов
Определение физических свойств минералов Международный Год периодической таблицы химических элементов
Международный Год периодической таблицы химических элементов Значение органической химии в жизни человека
Значение органической химии в жизни человека Химия в искусстве
Химия в искусстве Молекулярные и немолекулярные вещества
Молекулярные и немолекулярные вещества