Содержание
- 2. Свойства простых веществ, кислот и солей в свете ОВР
- 3. Что я сегодня должен узнать на уроке? 1. Простые вещества (металлы, неметаллы), кислоты и соли участвуют
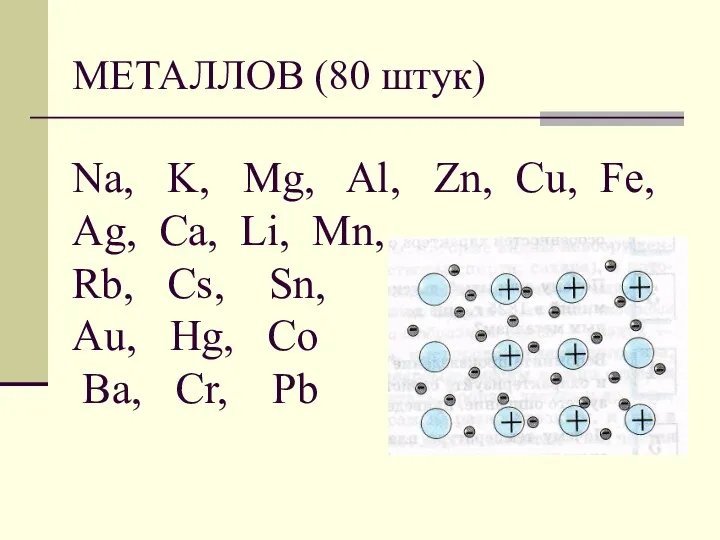
- 4. МЕТАЛЛОВ (80 штук) Na, K, Mg, Al, Zn, Cu, Fe, Ag, Ca, Li, Mn, Rb, Cs,
- 5. МЕТАЛЛОВ (80 штук) Металлическая кристаллическая решетка Имеют сравнительно большие размеры радиусов На внешнем уровне у металлов
- 6. Примеры 2Naº + Clº = 2Na ¹ Clˉ¹ Caº + Hº = Ca ² Hˉ¹ 3Caº
- 7. ВЫВОД: Металлы в ОВР проявляют восстановительные свойства. Меº – nē → Меⁿ Металлы – восстановители! +
- 8. НЕМЕТАЛЛЫ(C,N ,P,S,O , F , Cl , Br ,I ,H ) Кристаллическая решетка атомная или молекулярная
- 9. Примеры Cº + Oº = C Oˉ² Cº + 2Hº = Cˉ Hˉ¹ Sº + Hº
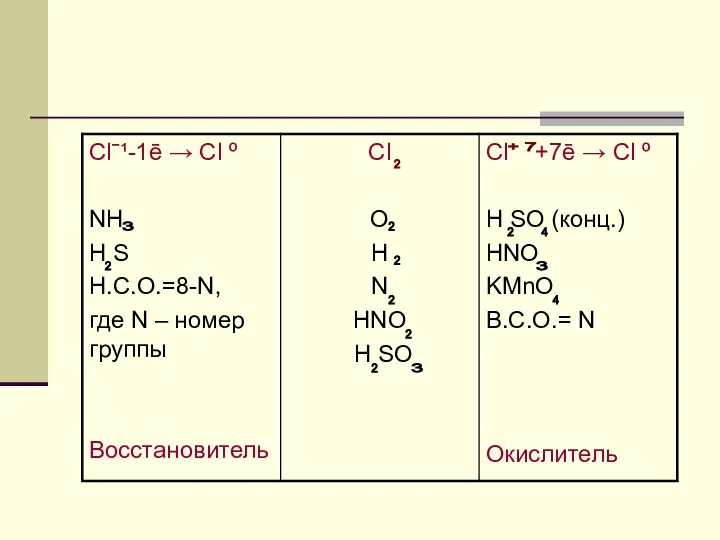
- 10. ВЫВОД: НеМе - nē → НеМеⁿ (восстановитель) НеМе + nē → НеМеⁿˉ (окислитель) Неметаллы в ОВР
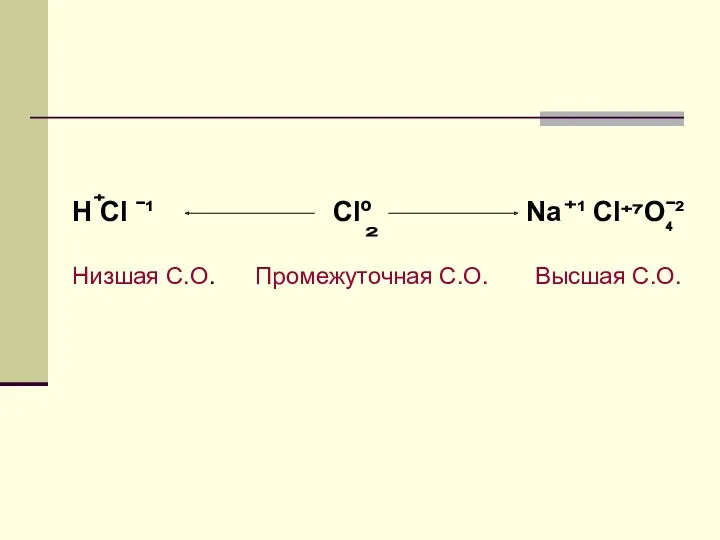
- 11. Н Сl ˉ¹ Clº Nа ¹ Cl Oˉ² Низшая С.О. Промежуточная С.О. Высшая С.О. 2 +
- 12. 2 2 2 2 2 2 2 2 + 7 4 4 3 3 3
- 13. ВЫВОД: Атомы, имеющие низшую степень окисления являются восстановителями. Атомы, имеющие высшую степень окисления являются окислителями.
- 14. Примеры Методом электронного баланса подберите коэффициенты в схемах ОВР: NH + O → N O +
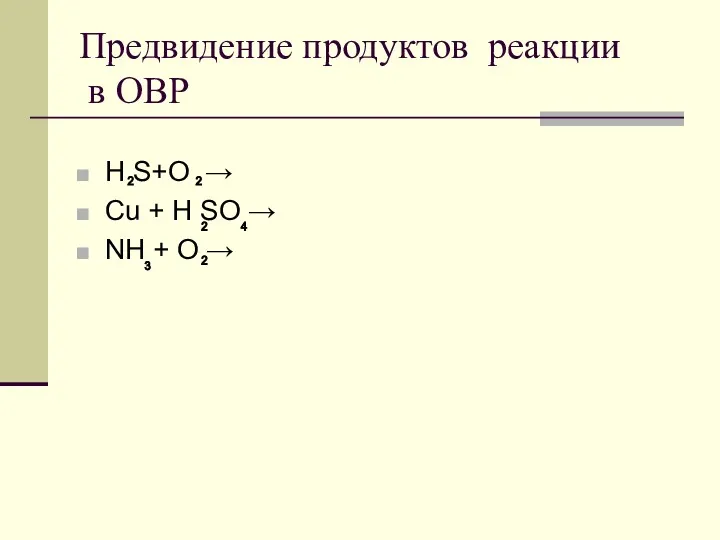
- 15. Предвидение продуктов реакции в ОВР Н S+O → Cu + H SO → NH + O
- 16. Я сегодня узнал на уроке: 1. Простые вещества (металлы, неметаллы), кислоты и соли участвуют в ОВР.
- 18. Скачать презентацию











 Удивительные свойства воды
Удивительные свойства воды Electronică aplicată. (Curs 2)
Electronică aplicată. (Curs 2) Пространственное строение органических соединений. (Лекция 2)
Пространственное строение органических соединений. (Лекция 2) 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Электронная конфигурация К. Классификация химических элементов. 8 класс
Электронная конфигурация К. Классификация химических элементов. 8 класс Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Железо и его соединения
Железо и его соединения Химические превращения веществ
Химические превращения веществ Белки. Функции белков
Белки. Функции белков Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Простые спектры 1Н ЯМР
Простые спектры 1Н ЯМР Значення хімічних процесів у природі
Значення хімічних процесів у природі Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Реакции ионного обмена
Реакции ионного обмена Жиры. Мыла. 10 класс
Жиры. Мыла. 10 класс Группа редкоземельных элементов
Группа редкоземельных элементов Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі
Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі Железо
Железо Crystallography. Part 4: Crystal Forms Twinning
Crystallography. Part 4: Crystal Forms Twinning Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)