Содержание
- 2. ФИЗИЧЕСКАЯ ХИМИЯ Химическая термодинамика Химическая кинетика Электрохимия Коллоидная химия и химия поверхностных явлений Квантовая химия ХИМИЧЕСАКАЯ
- 3. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Уравнения состояния идеальных газов Законы термодинамики Термодинамические функции состояния системы Химическое равновесие Термодинамика фазовых
- 4. Кудряшева, Н.С. Физическая химия: Учеб. пособие / Н. С. Кудряшева, Л.Г. Бондарева. — Издательство Юрайт, 2011.
- 5. Физическая химия – наука о закономерностях химических процессов и явлений, дающая объяснение на основе фундаментальных положений
- 6. Основные задачи физической химии: Изучение и объяснение основных закономерностей, определяющих направленность химических процессов Изучение скоростей процессов,
- 7. ФИЗИЧЕСКАЯ ХИМИЯ Химическая термодинамика Теоретические методы физики для решения задач физической химии: Термодинамический метод Молекулярно-кинетическая теория
- 8. ФИЗИЧЕСКАЯ ХИМИЯ Химическая термодинамика Теоретические методы физики для решения задач физической химии: Термодинамический метод Молекулярно-кинетическая теория
- 9. ФИЗИЧЕСКАЯ ХИМИЯ Химическая термодинамика Теоретические методы физики для решения задач физической химии: Термодинамический метод Молекулярно-кинетическая теория
- 10. ФИЗИЧЕСКАЯ ХИМИЯ Химическая термодинамика Впервые курс прочитан в 1752 – 1753 гг. М.В. Ломоносовым Первый учебник
- 11. ФИЗИЧЕСКАЯ ХИМИЯ Химическая термодинамика Впервые курс прочитан в 1752 – 1753 гг. М.В. Ломоносовым Первый учебник
- 12. ФИЗИЧЕСКАЯ ХИМИЯ Химическая термодинамика Впервые курс прочитан в 1752 – 1753 гг. М.В. Ломоносовым Первый учебник
- 13. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Термодинамика Наука, изучающая переход энергии из одной формы в другую и от одной части
- 14. Термодинамик базируется на ряде положений – первый, второй и третий закон термодинамики. К открытию первого закона
- 15. Термодинамик базируется на ряде положений – первый, второй и третий закон термодинамики. К открытию второго закона
- 16. Термодинамик базируется на ряде положений – первый, второй и третий закон термодинамики. Дальнейшее развитие связано с
- 17. Объект исследования – макроскопическая система. Термодинамикой не рассматривается: - молекулярная структура вещества - характер сил взаимодействия
- 18. Назначение термодинамики: - расчет тепловых балансов при протекании химических и физических процессов, - определение благоприятных условий
- 19. Система – тело или группа тел, мысленно или физически выделенных из окружающей среды. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Основные
- 20. Системы делятся на Открытые, Закрытые, Изолированные. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Основные понятия Открытой системой называется система, которая может
- 21. Системы делятся на Открытые, Закрытые, Изолированные. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Основные понятия Закрытой системой называется система, в которой
- 22. Системы делятся на Открытые, Закрытые, Изолированные. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Основные понятия Изолированной системой называется система, объем которой
- 23. Системы делятся на Гомогенные, Гетерогенные. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Основные понятия Фаза – часть системы, которая отделена от
- 24. Системы делятся на Гомогенные, Гетерогенные. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Основные понятия Система называется гомогенной (однородной), если она состоит
- 25. Системы делятся на Гомогенные, Гетерогенные. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Основные понятия Гетерогенная (неоднородная) система обязательно содержит несколько фаз.
- 26. Состояние системы – совокупность всех физических и химических свойств системы. Рассматриваю те свойства, которые могут быть
- 27. Параметры состояния системы связываются между собой соотношением – уравнение состояния системы. f(p, V, T) = 0
- 28. Свойства системы делятся на : экстенсивные и интенсивные. Экстенсивные свойства пропорциональны массе системы ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Основные
- 29. Свойства системы делятся на : экстенсивные и интенсивные. Интенсивные свойства не зависят от массы системы ХИМИЧЕСКАЯ
- 30. Термодинамические процессы Если при наблюдении за системой происходит изменение хотя бы одного из термодинамических свойств, то
- 31. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Основные понятия Процесс, при протекании которого система снова возвращается в исходное состояние, называется круговым
- 32. Равновесное состояние системы такое состояние, которое сохраняется неизменным во времени, причем это состояние не поддерживается каким-либо
- 33. Для описания состояния газ достаточно определить только два термодинамических параметра: P – T; P – V;
- 34. Роберт Бойль (1662г) При постоянной температуре объем, V, постоянной массы данного газа обратно пропорционален его давлению.
- 35. Шарль (1787) Гей-Люссак (1802) При постоянном давлении объем постоянной массы данного газа прямо пропорционален его температуре
- 36. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Законы идеального газа: Бойля-Мариатта, Шарля-Гей-Люссака, Авагадро. Амедео Авогадро, 1776 - 1856 А. Авагадро (1811)
- 37. Идеальный газ – математическая модель, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь Свойства
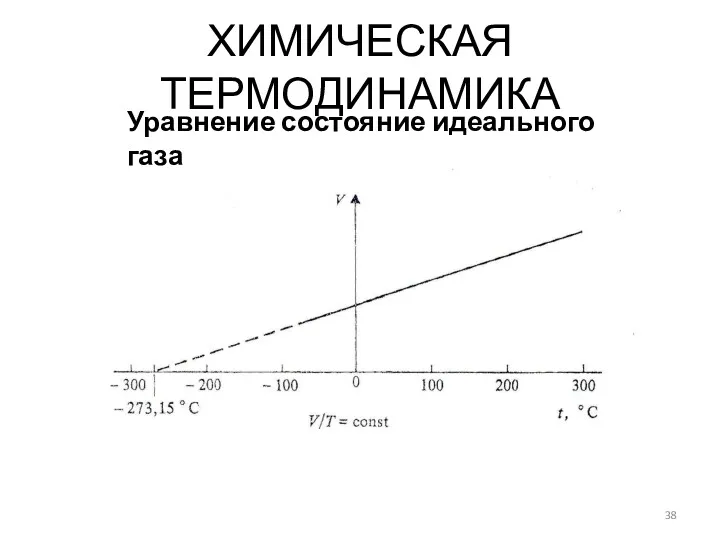
- 38. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Уравнение состояние идеального газа
- 39. V = f(P, T) ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Уравнение состояние идеального газа PV = k1T V = k2T
- 40. Признаки критического состояния вещества: Критическому состоянию соответствуют давление и температура, при которых газ и жидкость становятся
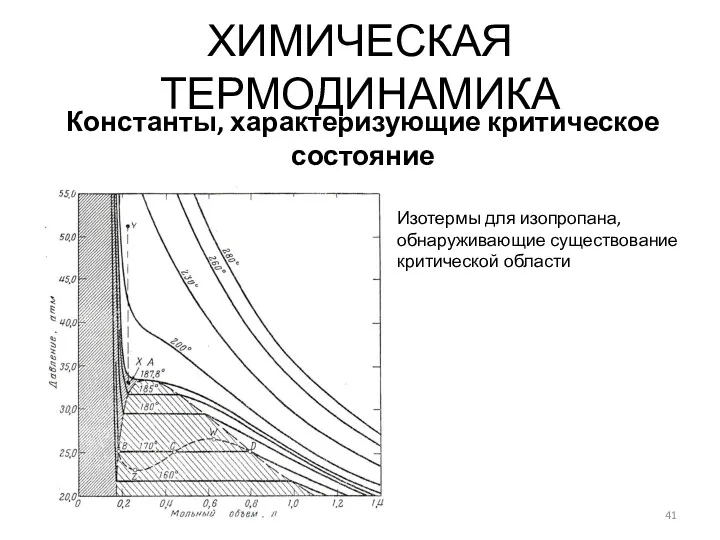
- 41. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Константы, характеризующие критическое состояние Изотермы для изопропана, обнаруживающие существование критической области
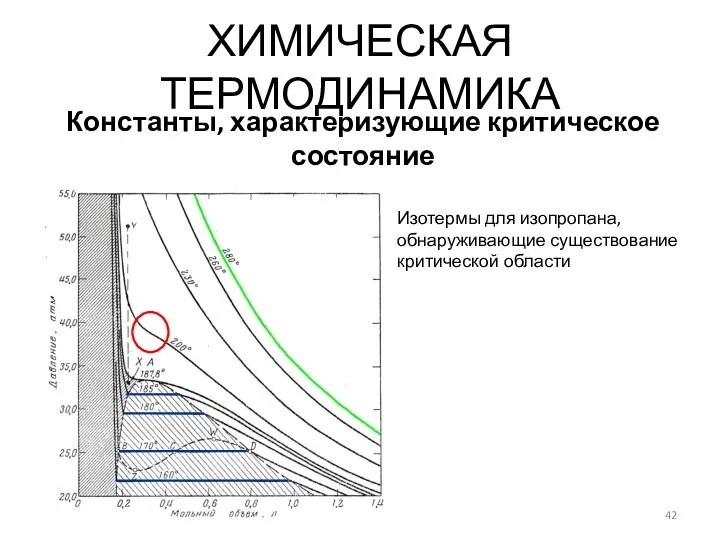
- 42. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Константы, характеризующие критическое состояние Изотермы для изопропана, обнаруживающие существование критической области
- 43. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Константы, характеризующие критическое состояние Определение критического объема системы Соотношение Кальете - Матиаса
- 44. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Уравнение Ван-дер-Ваальса
- 45. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Уравнение Ван-дер-Ваальса Учет влияния эффективного давления за счет притяжения молекул
- 46. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Уравнение Ван-дер-Ваальса Учет уменьшения объема, в котором могут двигаются молекулы
- 47. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Уравнение Ван-дер-Ваальса При
- 48. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Первый закон термодинамики
- 49. Внутренняя энергия – функция состояния системы. Не зависит от промежуточных стадий процесса, определяется только начальным и
- 50. Измеряется только изменение внутренней энергии В любой неизолированной системе в результате какого-либо процесса происходит изменение энергии.
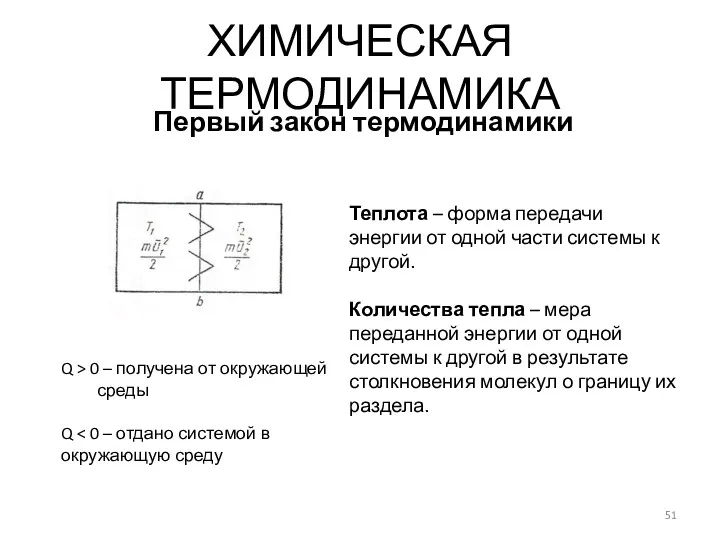
- 51. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Первый закон термодинамики Теплота – форма передачи энергии от одной части системы к другой.
- 52. Обмен энергии между системой и внешней средой обуславливается работой, совершаемой системой или над системой. Элементарная работа:
- 53. Передача энергии: Теплота столкновение молекул с поверхность раздела систем в результате хаотичного движения Работа упорядоченного движения
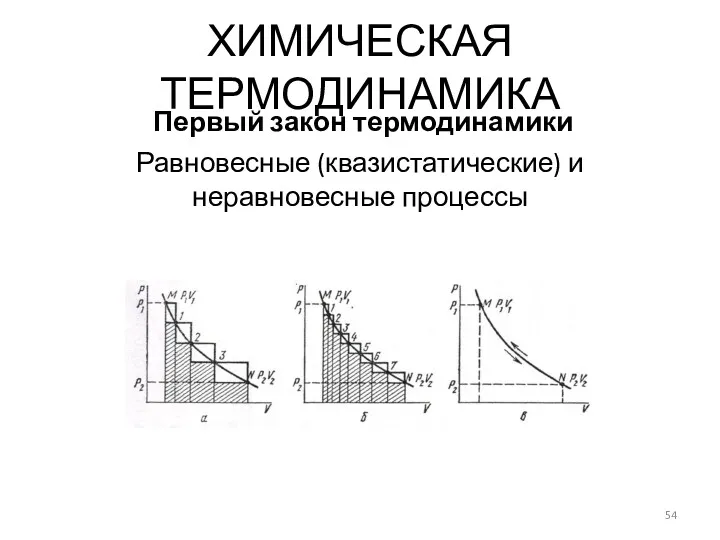
- 54. Равновесные (квазистатические) и неравновесные процессы ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Первый закон термодинамики
- 55. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Первый закон термодинамики При квазистатическом процессе:
- 56. Из закона сохранения энергии следует: Q=∆U + W Для бесконечно малых элементарных процессов: δQ = dU
- 57. Внутренняя энергия изолированной системы есть величина постоянная. ∆U = 0 Если в неизолированной системе протекает процесс,
- 58. Изохорный процесс (V = const) δW = PdV = 0 δQV = dU + PdV =
- 59. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Первый закон термодинамики
- 60. При отсутствии немеханической работы: ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Тепловой эффект. Термохимия. QV = ∆U QP = ∆H Тепловым
- 61. Тепловой эффект процесса не зависит от промежуточных стадий, а определяется лишь начальным и конечным состояниями системы
- 62. Термохимия – раздел химической термодинамики позволяющий рассчитывать тепловые эффекты химических реакций и экспериментально их определять. Основные
- 64. Скачать презентацию
























































 Комплексные соединения
Комплексные соединения Пиролиз углеводородного сырья
Пиролиз углеводородного сырья Ионные уравнения
Ионные уравнения Сероводород. Сернистый водород, сульфид водорода, дигидросульфид
Сероводород. Сернистый водород, сульфид водорода, дигидросульфид Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Жёсткость воды и способы её устранения
Жёсткость воды и способы её устранения Электронное строение атома и Периодический закон
Электронное строение атома и Периодический закон Природні джерела вуглеводнів і їх переробка
Природні джерела вуглеводнів і їх переробка Новинки СН старт: июль 2016 Профессиональная химия PRO service
Новинки СН старт: июль 2016 Профессиональная химия PRO service Корунд. Разновидности корунда
Корунд. Разновидности корунда Apparatus of installations with circulating ball catalyst
Apparatus of installations with circulating ball catalyst Ветеринариялық гигиена және санитария
Ветеринариялық гигиена және санитария Нефть как дисперсная система
Нефть как дисперсная система Химический КВИЗ
Химический КВИЗ Охрана труда в кабинете (лаборатории) химии образовательного учреждения
Охрана труда в кабинете (лаборатории) химии образовательного учреждения Химическая связь. Ковалентная связь
Химическая связь. Ковалентная связь Газовая хроматография
Газовая хроматография Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення Жиры
Жиры Углеводы. Урок №9. 9 класс
Углеводы. Урок №9. 9 класс Значение пищи и ее состав
Значение пищи и ее состав Chemical kinetics
Chemical kinetics Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Получение ЛС неорганической природы
Получение ЛС неорганической природы Горючее, смазочные материалы и специальные жидкости
Горючее, смазочные материалы и специальные жидкости Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність Химическое равновесие. 11 класс
Химическое равновесие. 11 класс Происхождение химичесих элементов
Происхождение химичесих элементов