Содержание
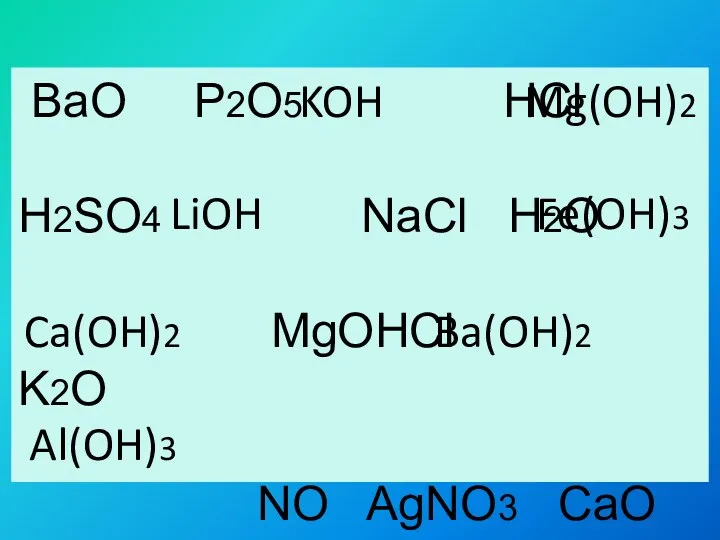
- 2. BaO P2O5 HCl H2SO4 NaCl H2O MgOHCl K2O NO AgNO3 CaO Al2O3 KOH Mg(OH)2 LiOH Fe(OH)3
- 3. Основания - это сложные вещества, состоящие из атомов металлов и гидроксильных групп ОН. Me(OH)n n =
- 4. Названия оснований КОН Mg(OH)2 LiOH Fe(OH)3 Ca(OH)2 Al(OH)3 гидроксид гидроксид гидроксид гидроксид гидроксид гидроксид калия магния
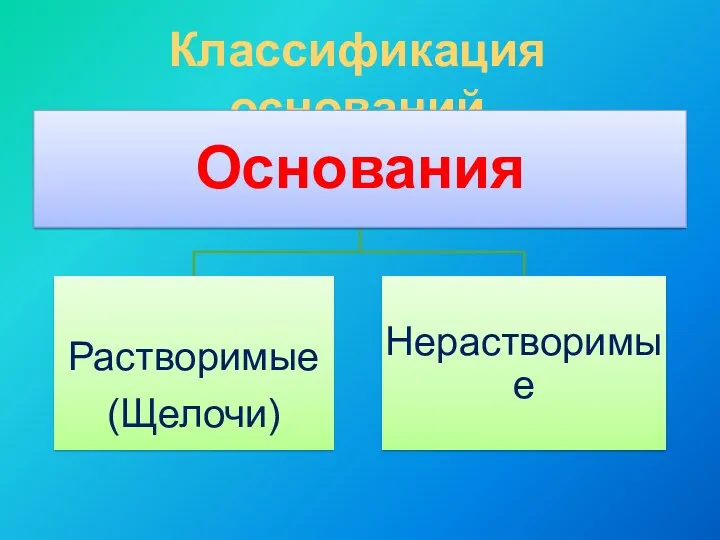
- 5. Классификация оснований
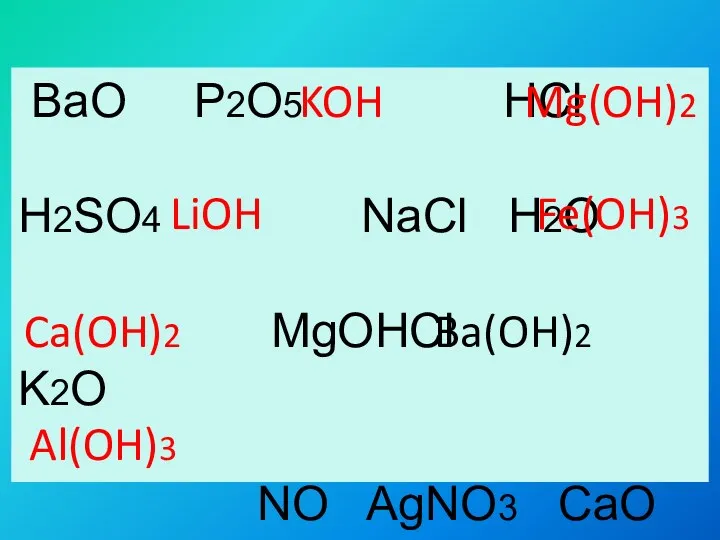
- 6. BaO P2O5 HCl H2SO4 NaCl H2O MgOHCl K2O NO AgNO3 CaO Al2O3 KOH Mg(OH)2 LiOH Fe(OH)3
- 7. KOH LiOH Ca(OH)2 Mg(OH)2 Fe(OH)3 Al(OH)3
- 8. Физические свойства оснований Ba(OH)2 Co(OH)2 NaOH Ca(OH)2 LiOH Cu(OH)2
- 9. Получение оснований Активный металл + вода = = щелочь + водород 2Na + 2H2O = 2NaOH
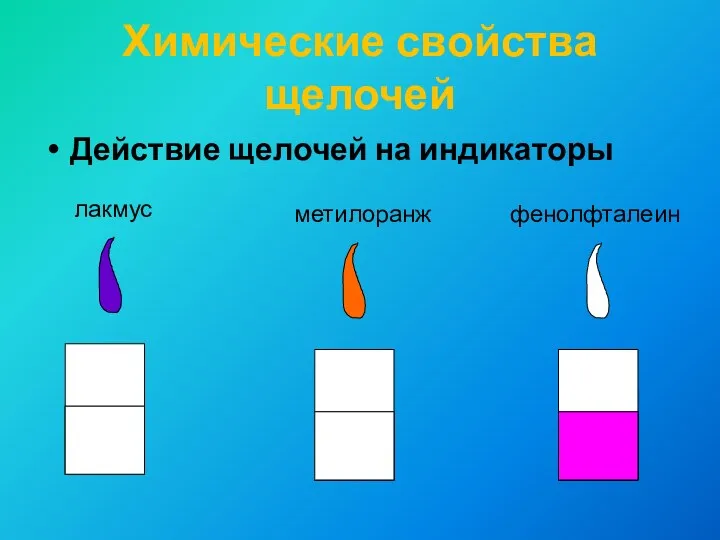
- 10. Химические свойства щелочей Действие щелочей на индикаторы лакмус метилоранж фенолфталеин
- 11. Химические свойства оснований Взаимодействие с кислотами: NaOH + HCl = NaCl +H2O 2. Взаимодействие щелочей с
- 13. Скачать презентацию






 Карбонові кислоти
Карбонові кислоти Молярна маса речовини
Молярна маса речовини Растворы. Общая характеристика растворов
Растворы. Общая характеристика растворов Скорость химической реакции
Скорость химической реакции Некоторые закономерности протекания химических реакций: тепловой эффект реакции, скорость реакции, химическое равновесие
Некоторые закономерности протекания химических реакций: тепловой эффект реакции, скорость реакции, химическое равновесие Степень окисления
Степень окисления Мыло. Мылящие вещества в природе
Мыло. Мылящие вещества в природе Виды и свойства текстильных материалов из химических волокон. 6 класс
Виды и свойства текстильных материалов из химических волокон. 6 класс Химико-аналитический контроль. Основы химико-аналитического контроля товаров
Химико-аналитический контроль. Основы химико-аналитического контроля товаров Қоспаларды бөлу әдістері
Қоспаларды бөлу әдістері Предельные углеводороды
Предельные углеводороды От кулинарии — к кулинохимии
От кулинарии — к кулинохимии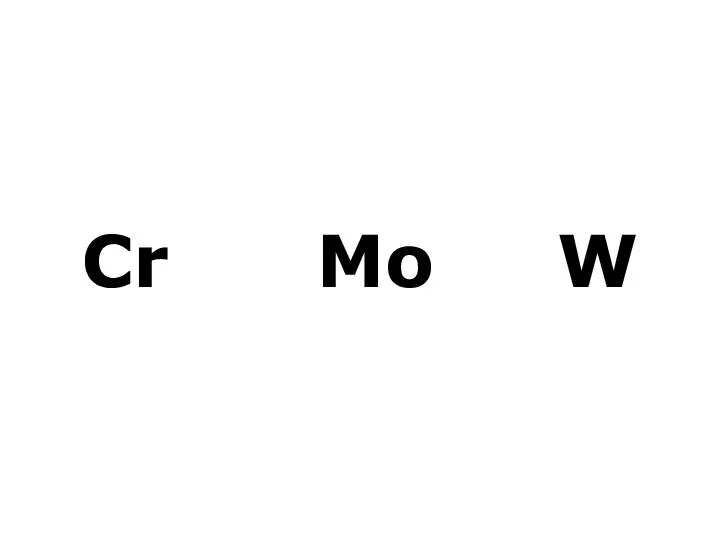 Метали VI групи побічної підгрупи (Cr, Mo, W)
Метали VI групи побічної підгрупи (Cr, Mo, W) Классы неорганических соединений: Оксиды (8 класс)
Классы неорганических соединений: Оксиды (8 класс) Азот. Элемент V группы главной подгруппы
Азот. Элемент V группы главной подгруппы Номенклатура оснований. Классификация и примеры. Получение оснований. Химические свойства
Номенклатура оснований. Классификация и примеры. Получение оснований. Химические свойства Получение хлортетрациклина
Получение хлортетрациклина Реакции ионного обмена
Реакции ионного обмена Минеральные воды
Минеральные воды Химическое равновесие
Химическое равновесие Тепловой эффект химических реакций
Тепловой эффект химических реакций Химические элементы. Типы связей
Химические элементы. Типы связей Электротехнический фарфор – разновидность твердого фарфора
Электротехнический фарфор – разновидность твердого фарфора Химическая картина мира
Химическая картина мира Химические свойства кислот
Химические свойства кислот Производство метанола. Физико-химические основы синтеза метанола. Современные катализаторы
Производство метанола. Физико-химические основы синтеза метанола. Современные катализаторы Химическая организация клетки
Химическая организация клетки Формулы веществ. Относительная атомная масса. Относительная молекулярная масса. Массовая доля элементов в сложных веществах
Формулы веществ. Относительная атомная масса. Относительная молекулярная масса. Массовая доля элементов в сложных веществах