Некоторые закономерности протекания химических реакций: тепловой эффект реакции, скорость реакции, химическое равновесие презентация
Содержание
- 2. Термодинамика Кинетика Химическая реакция Химическая реакция сопровождается разрывом одних и образованием других химических связей, в ходе
- 3. Термодинамика Кинетика Примеры реакций 2 Mg + O2 = 2 MgO + E (теплота, свет) (NH4)2Cr2O7
- 4. Термодинамика Кинетика
- 5. Термодинамика Кинетика
- 6. Термодинамика Кинетика
- 7. Термодинамика Кинетика
- 8. Термодинамика Кинетика
- 9. Термодинамика Кинетика
- 10. Термодинамика Кинетика
- 11. Термодинамика Кинетика ТЕРМОХИМИЯ Термохимия – раздел химии, изучающий тепловые эффекты реакции. Экзотермические реакции идут с выделением
- 12. I Закон термохимии 1789-1794 г.г. А-Л.Лавуазье (1743-1794), П.Лаплас
- 13. Термодинамика Кинетика Тепловой эффект образования данного вещества равен по величине и обратен по знаку тепловому эффекту
- 14. Термодинамика Кинетика CaCO3(к) = CaO(к) + CO2(г) ΔН1 = 177 кДж/моль CaO(к) + CO2(г) = СaCO3(к)
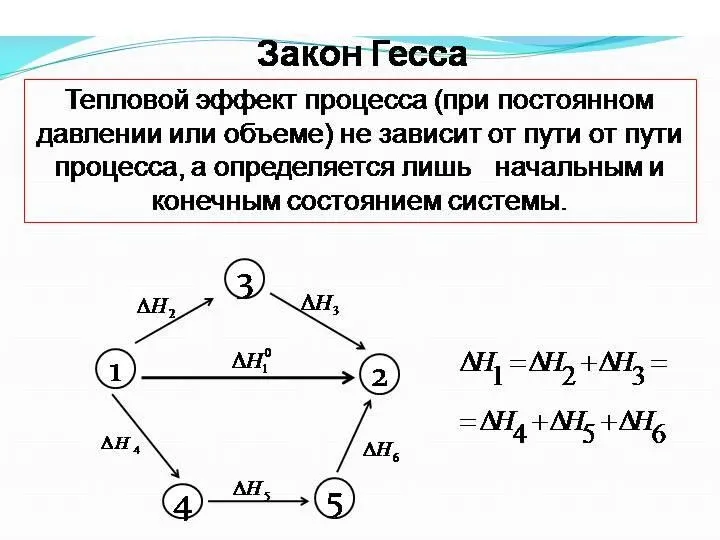
- 15. II Закон термохимии 1840 г. Г.И. Гесс (1802-1850)
- 16. Термодинамика Кинетика Гесс Герман Иванович Гесс Г.И. (1802-1850) – русский химик, академик Петербургской АН (с 1830
- 17. Термодинамика Кинетика
- 18. Термодинамика Кинетика
- 19. Термодинамика Кинетика 2NaOH(в) + H2SO4(в) = Na2SO4(в) + 2H2O + 131,3 кДж 1) NaOH(в) + H2SO4(в)
- 20. Термодинамика Кинетика Значение законов термохимии Расчет ΔН реакции, не проводя самой реакции
- 21. Термодинамика Кинетика С(графит) + О2(г) = СО2(г) ΔН1= -393,5 кДж/моль С(графит) + 1/2О2(г) = СО(г) ΔН2=?
- 22. Термодинамика Кинетика Закон Гесса для расчета ΔН реакции Энтальпий - ная диаграмма процессов окисления графита и
- 23. Термодинамика Кинетика Энтальпию образования глюкозы нельзя определить прямым методом: 6С + 6Н2 + 3О2 = С6Н12О6
- 24. Термодинамика Кинетика Значение законов термохимии Расчет энергии связи
- 25. Термодинамика Кинетика Энергия связи Н-Cl ½ H2(г) = H(г) ½ ΔH1 = 215,5 кДж ½ Сl2(г)
- 26. Термодинамика Кинетика Значение законов термохимии Расчет энергии кристаллической решетки Расчет теплоты растворения вещества Расчет теплоты гидратации
- 27. Термодинамика Кинетика Термодинамическая система Термодинамическая система – совокупность тел, способных энергетически взаимодействовать между собой и с
- 28. Термодинамика Кинетика Состояние системы характеризуется давлением (Р), температурой (Т), объемом (V), массой (m), энергией (Е). Эти
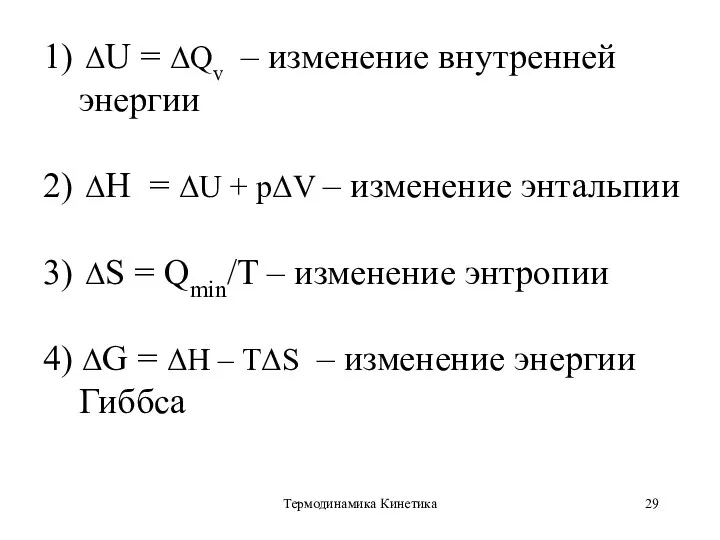
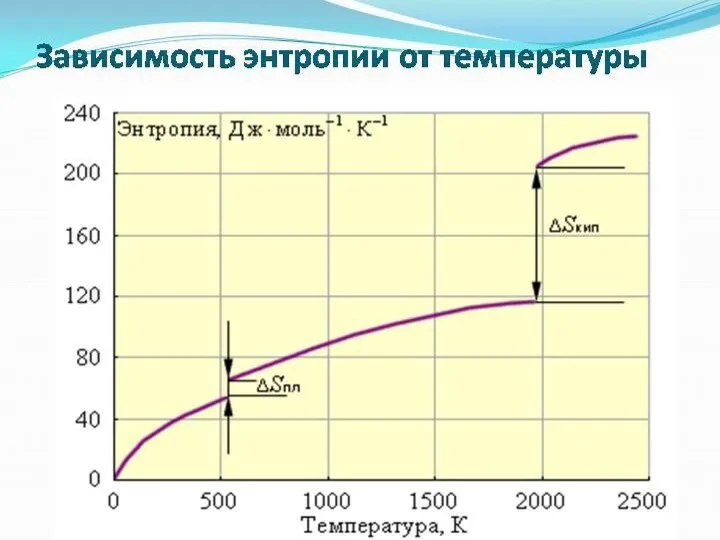
- 29. Термодинамика Кинетика 1) ΔU = ΔQv – изменение внутренней энергии 2) ΔН = ΔU + pΔV
- 30. Термодинамика Кинетика
- 31. Термодинамика Кинетика
- 32. Термодинамика Кинетика
- 33. Термодинамика Кинетика
- 34. Термодинамика Кинетика
- 35. Термодинамика Кинетика
- 36. Термодинамика Кинетика
- 37. Термодинамика Кинетика
- 38. Термодинамика Кинетика
- 39. Термодинамика Кинетика
- 40. Термодинамика Кинетика
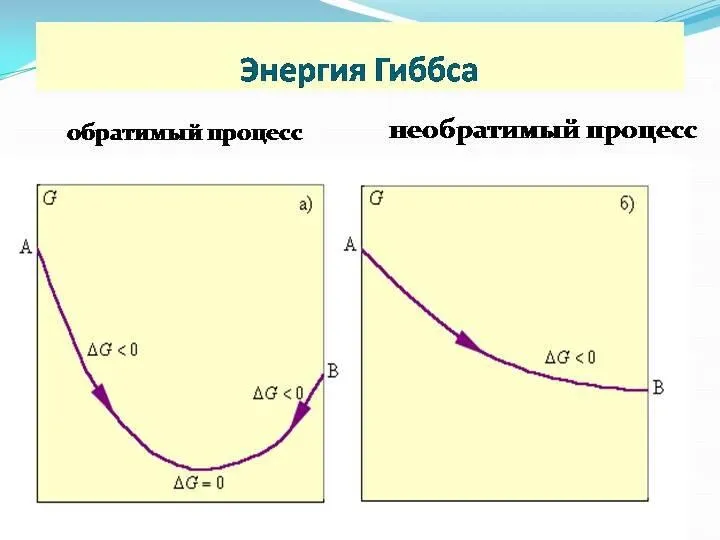
- 41. Термодинамика Кинетика Реакция идет самопроизвольно только при ∆G Cl2(г) + 2HI(г) = I2(к) + 2HCl(г) ΔGo298=
- 42. Термодинамика Кинетика ∆G ∆G > 0 - реакция не возможна ∆G = 0 – система находится
- 43. ХИМИЧЕСКАЯ КИНЕТИКА Химическая кинетика - раздел химии, изучающий скорость и механизм химических реакций.
- 44. Термодинамика Кинетика Гомогенная реакция - все вещества находятся в одной фазе. О2(г) + 2Н2(г) → 2Н2О(г)
- 45. Молекулярность реакции - число частиц, участвующих в элементарном акте. I2 ⭢2 I мономолекулярная H + Cl2
- 46. Термодинамика Кинетика Скорость химических реакций Реакции могут идти медленно. Например, реакции в горных породах (выветривание): К2O⋅Al2O3⋅6SiO2+CO2+H2O→K2CO3+4SiO2+Al2O3⋅2SiO2⋅2H2O
- 47. Термодинамика Кинетика Скорость химических реакций Реакции могут идти быстро. Например, реакции нейтрализации в растворах. H2SO4 +
- 48. Термодинамика Кинетика Скорость химических реакций
- 49. Термодинамика Кинетика Зависимость скорости реакции (V) от различных факторов Скорость реакции зависит от природы реагирующих веществ,
- 50. Термодинамика Кинетика Зависимость скорости реакции от концентрации реагирующих веществ Опыт 5Na2SO3+2KJO3+H2SO4 → I2↓+5Na2SO4+K2SO4 б/ц б/ц б/ц
- 51. Термодинамика Кинетика Зависимость скорости реакции от концентрации обусловлена числом столкновений реагирующих частиц в единицу времени в
- 52. Термодинамика Кинетика Для реакции: А + В → С (прямая реакция) Закон действующих масс 1867 г.
- 53. Термодинамика Кинетика Для реакции: А + В + … → продукты реакции где: nA, nB -
- 54. Термодинамика Кинетика 1) 2NO(г) + O2 (г) = 2 NO2 (г) V = k CNO2 CO2
- 55. Термодинамика Кинетика Зависимость скорости реакции от температуры Опыт 2KMnO4 + 5H2C2O4 +3H2SO4 → 2MnSO4 + 10CO2↑
- 56. Термодинамика Кинетика Число столкновений реагирующих частиц не равно числу актов реакции. Увеличение скорости реакции при увеличении
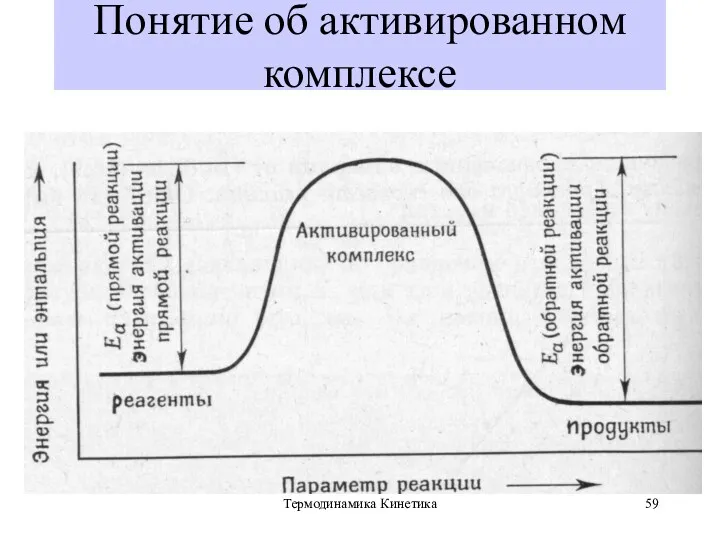
- 57. Термодинамика Кинетика Энергия активации (Еакт.) – минимальная энергия, необходимая для того, чтобы столкновение частиц было эффективным
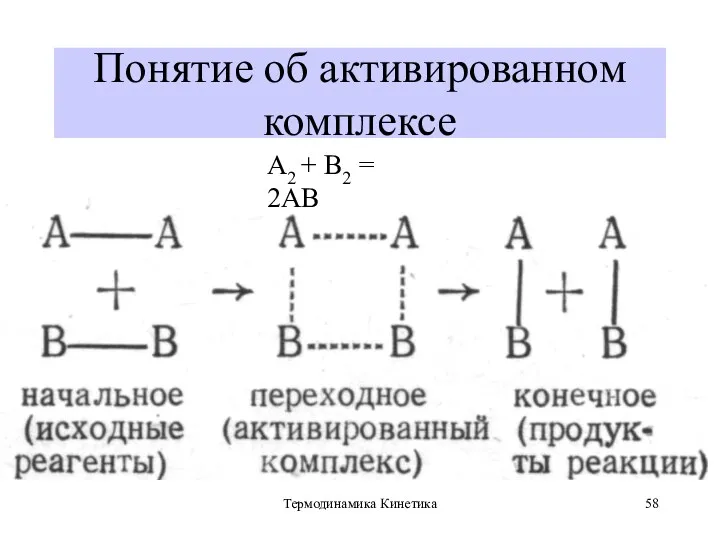
- 58. Термодинамика Кинетика Понятие об активированном комплексе А2 + В2 = 2АВ
- 59. Термодинамика Кинетика Понятие об активированном комплексе
- 60. Термодинамика Кинетика При повышении температуры системы увеличивается число частиц (доля частиц), обладающих Е ≥ Еакт.
- 61. Термодинамика Кинетика Связь константы скорости реакции (k) с величиной энергии активации (Еакт) выражается уравнением Аррениуса: ,
- 62. Термодинамика Кинетика Закон Вант-Гоффа При повышении температуры на 100 скорость реакции возрастает примерно в 2-4 раза.
- 63. Термодинамика Кинетика Вант-Гофф Якоб Хендрик Вант-Гофф Я.Х. (1852-1911) - голландский химик. Нобелевская премия 1901 года (первая
- 64. Термодинамика Кинетика Зависимость скорости реакции от катализатора Катализатор - вещество, не расходующееся в результате реакции, но
- 65. Термодинамика Кинетика Зависимость скорости реакции от катализатора Опыт 2Al + 3I2 → 2AlI3 катализатор - Н2О
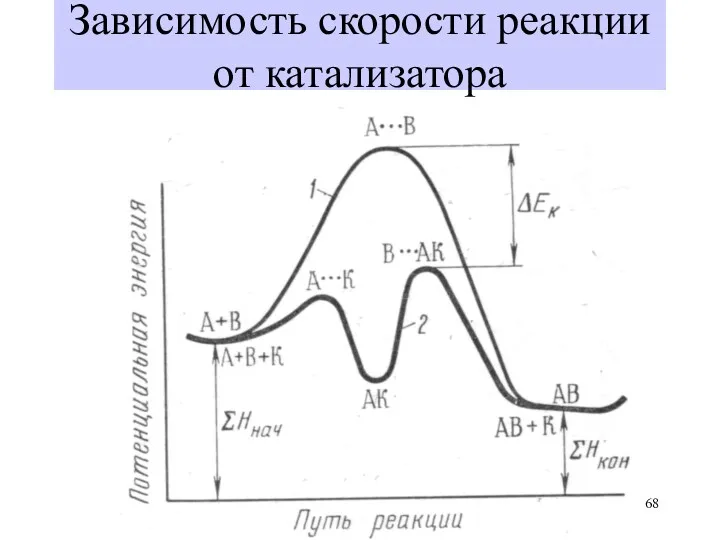
- 66. Термодинамика Кинетика Зависимость скорости реакции от катализатора Катализатор снижает Еакт. реакции за счет образования других активированных
- 67. Термодинамика Кинетика Зависимость скорости реакции от катализатора Схема реакции без катализатора А + В ⭢А ….В
- 68. Термодинамика Кинетика Зависимость скорости реакции от катализатора
- 69. Термодинамика Кинетика Зависимость скорости гетерогенной реакции от величины площади поверхности реагента Опыт СаСО3 + 2НСl →
- 70. Термодинамика Кинетика Зависимость скорости гетерогенной реакции от величины площади поверхности реагента Стадии гетерогенной реакции: 1. подвод
- 71. Термодинамика Кинетика Влияние на скорость реакции других факторов Скорость сложной реакции зависит от механизма реакции
- 72. Термодинамика Кинетика Цепные реакции а) неразветвленные H2 + Cl2 → 2HCl Cl2 → 2Cl∙ Cl∙ +
- 73. Термодинамика Кинетика Цепные реакции б) разветвленные (Н.Н.Семенов) 2Н2 + О2 → 2H2О Н2 + О2 →
- 74. Термодинамика Кинетика Колебательные реакции Колебательные реакции – реакции, в ходе которых концентрации промежуточных соединений и скорость
- 75. Термодинамика Кинетика Колебательные реакции Колебательные реакции лежат в основе ряда биологических процессов (генерация биоритмов, мышечного сокращения
- 76. Термодинамика Кинетика ХИМИЧЕСКОЕ РАВНОВЕСИЕ Химические реакции могут быть необратимые и обратимые Примеры 1) Необратимая реакция Zn(тв)
- 77. Термодинамика Кинетика Химические реакции, которые в одних и тех же условиях могут идти в противоположных направлениях,
- 78. Термодинамика Кинетика Химическое равновесие Химическое равновесие – состояние системы, в котором скорости прямой и обратной реакций
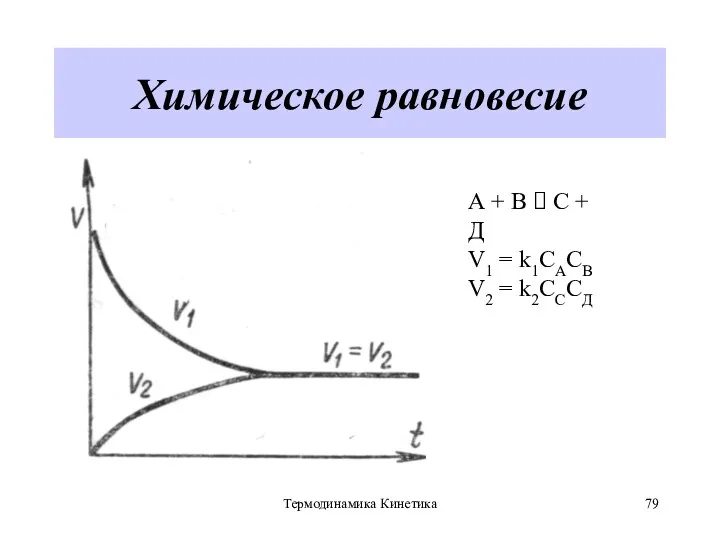
- 79. Термодинамика Кинетика Химическое равновесие А + В ⮀ С + Д V1 = k1CACB V2 =
- 80. Термодинамика Кинетика Химическое равновесие H2 + I2 ⮀ 2HI vпр = vобр; k1 [H2][I2] = k2[HI]2;
- 81. Термодинамика Кинетика Для состояния равновесия Кр = При Кр >> 1 выход реакции большой, при Кр
- 82. Термодинамика Кинетика В состоянии равновесия система может находится сколь угодно долго при неизменных внешних условиях. В
- 83. Термодинамика Кинетика ПРИНЦИП ЛЕ ШАТЕЛЬЕ (Анри Луи Ле Шателье, 1850-1936, французский физик) Внешнее воздействие на систему,
- 84. Термодинамика Кинетика ПРИНЦИП ЛЕ ШАТЕЛЬЕ Опыт FeCl3 + 3KSCN ⮀ Fe(SCN)3 + 3KCl При увеличении концентрации
- 85. Термодинамика Кинетика 2 H2(г) + O2 (г) ⮀ 2 H2O (г) ΔН = - 286 кДж/моль
- 87. Скачать презентацию
















































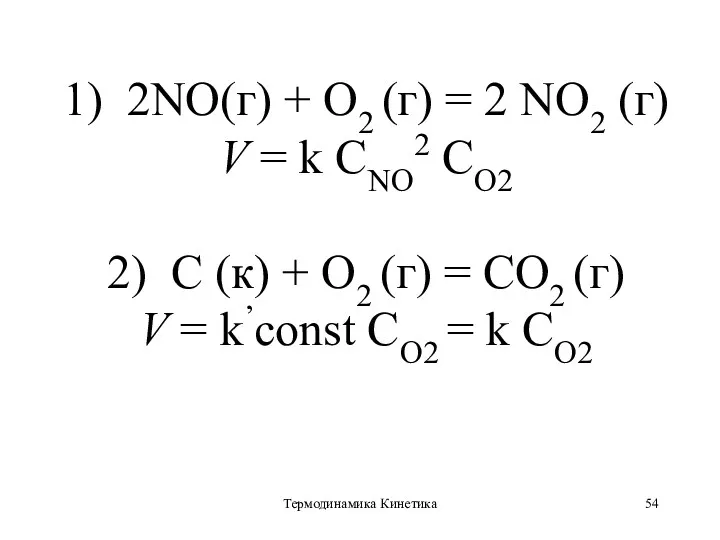





















![Термодинамика Кинетика Химическое равновесие H2 + I2 ⮀ 2HI vпр = vобр; k1 [H2][I2] = k2[HI]2;](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/607571/slide-79.jpg)





 Своя игра по химии
Своя игра по химии Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Равновесные электрохимические системы
Равновесные электрохимические системы Атыраудағы химиялық өндіріс кәсіп орындары
Атыраудағы химиялық өндіріс кәсіп орындары Газовые законы. Расчетные задачи
Газовые законы. Расчетные задачи Белки. Определение
Белки. Определение Химическая термодинамика. Фазовые равновесия
Химическая термодинамика. Фазовые равновесия Первичная переработка нефти
Первичная переработка нефти Азотистая кислота
Азотистая кислота Строение атома. Периодический закон Д. И. Менделеева
Строение атома. Периодический закон Д. И. Менделеева Валентность и степень окисления атомов в молекуле
Валентность и степень окисления атомов в молекуле Высокомолекулярные соединения. Общий курс
Высокомолекулярные соединения. Общий курс Основные понятия и законы химии
Основные понятия и законы химии Качественные реакции на функциональные группы
Качественные реакции на функциональные группы Понятие биогенности химических элементов
Понятие биогенности химических элементов Реакции ионного обмена
Реакции ионного обмена Умные полимеры в биотехнологии и медицине
Умные полимеры в биотехнологии и медицине Неорганическая химия
Неорганическая химия Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Прикладная геохимия. Вторичные ореолы
Прикладная геохимия. Вторичные ореолы Химия и война. Альманах
Химия и война. Альманах Равновесие в реакциях гидролиза и трудно растворимых электролитов. Лекция 12
Равновесие в реакциях гидролиза и трудно растворимых электролитов. Лекция 12 Фосфор и его соединения
Фосфор и его соединения Иccледовательская работа по химии красное, желтое ,зеленое, какое полезнее?
Иccледовательская работа по химии красное, желтое ,зеленое, какое полезнее? Переработка угля
Переработка угля Знаки вторичной переработки
Знаки вторичной переработки Серная кислота H2SO4
Серная кислота H2SO4 Углеводы. Общая характеристика углеводов
Углеводы. Общая характеристика углеводов