Содержание
- 2. Атом – наименьшая частица химического элемента, обладающая его химическими свойствами. Химический элемент – вид атомов с
- 3. Молекула – наименьшая частица вещества, способная к самостоятельному существованию и обладающая основными химическими свойствами вещества. Вещество
- 4. Если молекулы состоят из одинаковых атомов – вещество называется простым (Н2, О2, Cl2, Fe, Mn…), из
- 5. Относительная атомная масса ( Аr) – отношение массы данного атома к 1/12 части массы атома С-12
- 6. 1 моль – количество вещества (ν), содержащее столько же структурных единиц (молекул, атомов, ионов, электронов…), сколько
- 7. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ 1. Закон сохранения массы и энергии (Ломоносов 1760, Эйнштейн 1905) В изолированной системе
- 8. 2. Закон постоянства состава (Ж.Л.Пруст, 1808г) Каждое химическое соединение, независимо от способа его получения, всегда обладает
- 9. 3. Закон простых объемных отношений (Гей-Люссак, 1808г) Объемы вступающих в реакцию газов относятся между собой, а
- 10. 2 Н2(г) + О2(г) → 2 Н2О (пар) V(Н2) : V(О2) : V(Н2О) = 2 :
- 11. 4. Закон Авогадро (1811г) В равных объемах любых газов, взятых при одинаковых условиях, содержится одинаковое число
- 12. Следствия: Один моль любого газа при одинаковых условиях занимает один и тот же объем При Н.У.
- 13. 2. Массы равных объемов двух газов, взятых при одинаковых условиях, относятся друг к другу как их
- 14. 5. Закон эквивалентов Химический эквивалент (Э, моль) – это такое количество вещества, которое соединяется с 1
- 15. Простые вещества: Сложные вещества: к – количество катионов (анионов); z - заряд катиона (аниона) по модулю.
- 17. Кислоты
- 18. Основания
- 19. Соли
- 20. Оксиды
- 21. Закон эквивалентов: Массы реагирующих друг с другом веществ, а так же продуктов реакции пропорциональны их эквивалентным
- 22. ОСНОВНЫЕ ГАЗОВЫЕ ЗАКОНЫ 1.Объединенный закон Бойля-Мариотта и Гей-Люссака (закон газового состояния)
- 23. 2. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) R - универсальная газовая постоянная R = 8,314 Дж/моль∙К
- 24. 3. Закон парциальных давлений (закон Дальтона) Парциальное давление (р, Па) - это давление, которое производил бы
- 25. Закон Дальтона Давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов,
- 27. Скачать презентацию














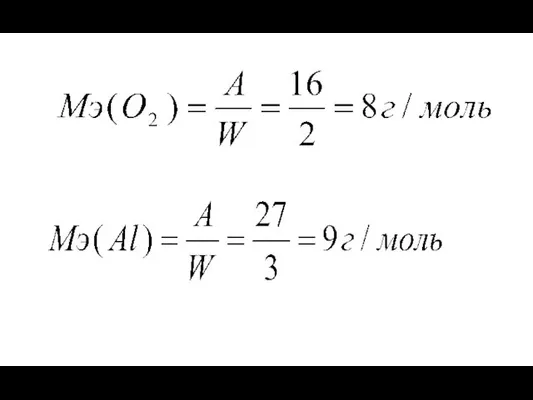


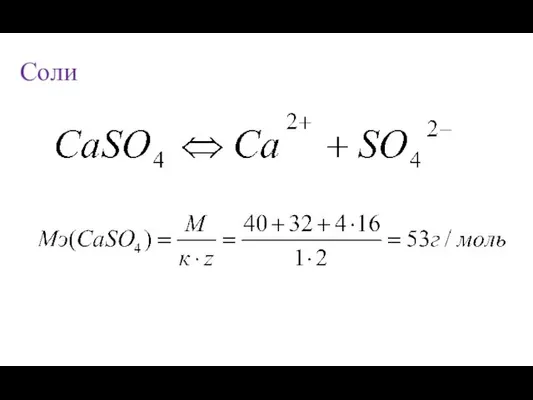






 Переходный элемент алюминий. Свойства алюминия
Переходный элемент алюминий. Свойства алюминия Химическая термодинамика
Химическая термодинамика Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки. Складання формули сполуки
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки. Складання формули сполуки Кристаллическое состояние вещества
Кристаллическое состояние вещества Вещества и их превращения Роль химии в нашей жизни
Вещества и их превращения Роль химии в нашей жизни Тест по ККЛС тема: Анализ воды очищенной и для инъекций
Тест по ККЛС тема: Анализ воды очищенной и для инъекций Процесс конверсии кислого газа в элементарную серу производительностью до 120 т/сутки
Процесс конверсии кислого газа в элементарную серу производительностью до 120 т/сутки Классификация опасных грузов
Классификация опасных грузов Химиялық байланыс және заттардың құрылымдық түрлі сатылары
Химиялық байланыс және заттардың құрылымдық түрлі сатылары Состав, свойства, виды и способы получения дегтей
Состав, свойства, виды и способы получения дегтей Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Теория твердения минеральных вяжущих веществ
Теория твердения минеральных вяжущих веществ Фунгициды. Достоинства и недостати
Фунгициды. Достоинства и недостати Соляные породы
Соляные породы Ионные уравнения реакций
Ионные уравнения реакций Простые спектры 1Н ЯМР
Простые спектры 1Н ЯМР Химический элемент йод
Химический элемент йод Основные классы неорганических веществ
Основные классы неорганических веществ Почему протекают химические реакции
Почему протекают химические реакции Figure
Figure Получение пресной и чистой воды
Получение пресной и чистой воды Физические методы стабилизации масел
Физические методы стабилизации масел Использование горюче-смазочных материалов в автотранспорте
Использование горюче-смазочных материалов в автотранспорте Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Классы органических соединений
Классы органических соединений Водородные соединения неметаллов
Водородные соединения неметаллов Решение задач на нахождение молекулярной формулы органических веществ
Решение задач на нахождение молекулярной формулы органических веществ Интоксикация ртутью
Интоксикация ртутью