Содержание
- 2. План лекции Общие положения; Способы выражения концентраций раствора; Электролитическая диссоциация, рН раствора; Гидролиз солей.
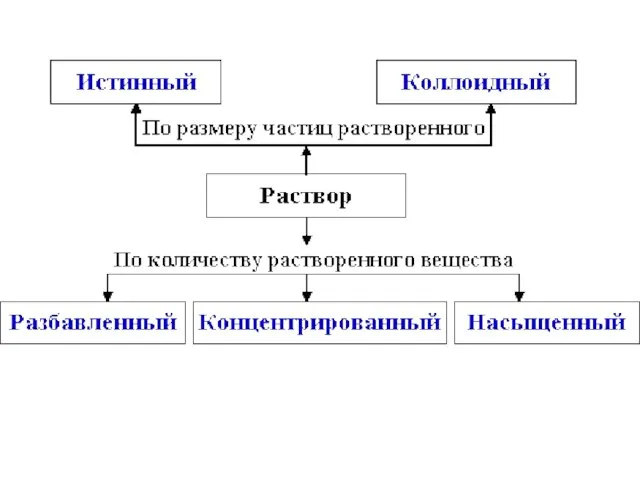
- 4. Растворимость Таблица растворимости Хорошо растворимые (более 10 г в-ва в 1 л воды) Малорастворимые (от 0,01
- 5. 5 % водный раствор HCl 100 г раствора содержит 5 г HCl и 95 г растворителя
- 7. Молярная концентрация (Молярность), СМ, [моль/л] – число молей растворенного вещества n, содержащегося в 1 л раствора
- 8. , [моль/л]
- 9. Определите массу нитрата натрия, которая требуется для приготовления 2 л децимолярного раствора (0,1 м). В 1
- 10. Нормальная концентрация эквивалента (Нормальность), CН, [моль/л] − число эквивалентов растворенного вещества nэ, содержащихся в 1 л
- 11. , [моль/л]
- 12. 0,75 н р-р H2SO4 или CН = 0,75 моль/л р-ра H2SO4 в 1 л р-ра –
- 13. Моляльная концентрация (Моляльность), Cm, [моль/кг] – число молей растворенного вещества n, приходящихся на 1 кг растворителя
- 14. , [моль/кг]
- 15. 2 m раствор H2SO4 2 моля приходятся на 1000 г растворителя Cm × М приходятся на
- 16. Титр Т, [г/мл] Показывает количество г растворенного вещества m, содержащегося в 1 мл раствора V: ,
- 17. Способы выражения концентраций растворов
- 18. Закон эквивалентов для растворов Объемы реагирующих веществ обратно пропорциональны их нормальностям:
- 19. Закон эквивалентов для растворов
- 20. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ NaCl ⇄ Na+ + Cl– KA ⇄ K+ + A¯ Катион Анион диссоциация Степень
- 22. Константа диссоциации Кдис(СН3СООН) = 1,8⋅10–5 Кдис (НСN) = 8⋅10–10 СН3СООН ⇄ СН3СОО– + Н+
- 23. Электролитическая диссоциация воды где [H+], [OH–] и [H2O] – молярные концентрации частиц в воде. Н2О ⇄
- 24. Ионное произведение воды: Нейтральная среда [H+] = [OH–] = 10–7 Кислая среда [H+] > 10–7 >
- 25. Водородный показатель pH = –lg[H+] [H+] = 10–7 pH = –lg10–7 = 7 нейтральная среда pH
- 26. [H+] = 10–2 моль/л pH = ? pH = –lg[H+] = –lg10–2 = 2 кис. ср.
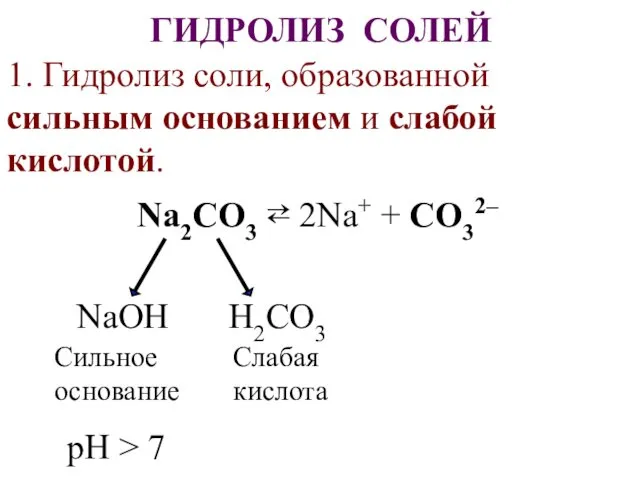
- 27. ГИДРОЛИЗ СОЛЕЙ 1. Гидролиз соли, образованной сильным основанием и слабой кислотой. Na2CO3 ⇄ 2Na+ + CO32–
- 28. I ст. CO32– + H+OН– ⇄ HCO3– + OН– Na2CO3 + H2O ⇄ NaHCO3 + NaOН
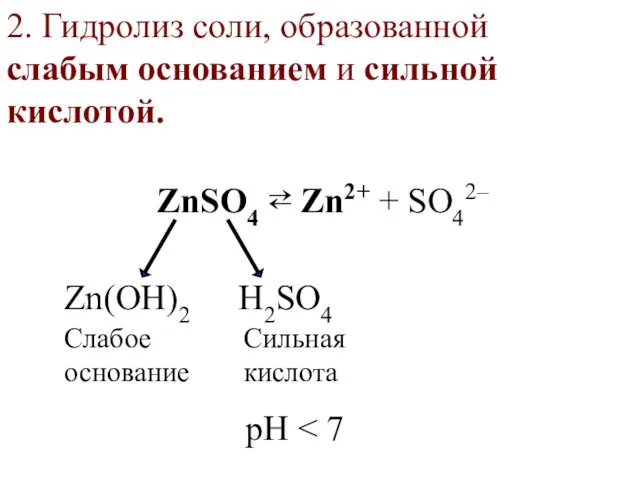
- 29. 2. Гидролиз соли, образованной слабым основанием и сильной кислотой. ZnSO4 ⇄ Zn2+ + SO42– Zn(OН)2 H2SO4
- 30. I ст. Zn2+ + H+OН– ⇄ ZnOH+ + Н+ 2ZnSO4 + 2H2O ⇄ (ZnOH)2SO4 + H2SO4
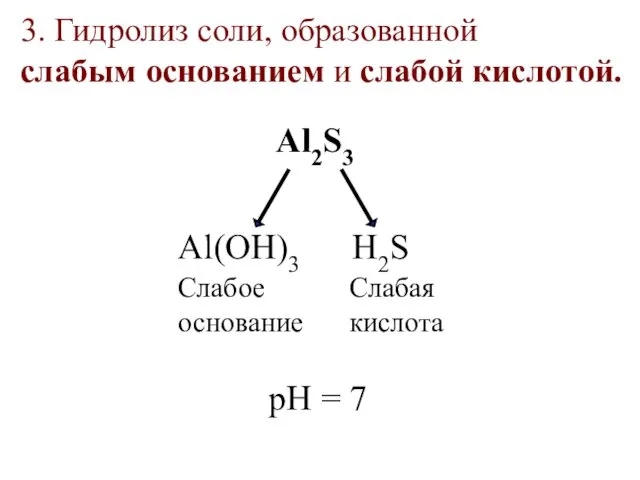
- 31. 3. Гидролиз соли, образованной слабым основанием и слабой кислотой. Al2S3 Al(OН)3 H2S Слабое основание Слабая кислота
- 32. Al2S3 + 6H2O ⇄ 2Al(OH)3↓ + 3H2S↑ 2Al3+ + 3S2– + 6H2O ⇄ 2Al(OH)3↓ + 3Н2S↑
- 33. Соль образованная сильным основанием и сильной кислотой гидролизу не подвергается (не реагирует в водой) NaCl +
- 35. Скачать презентацию



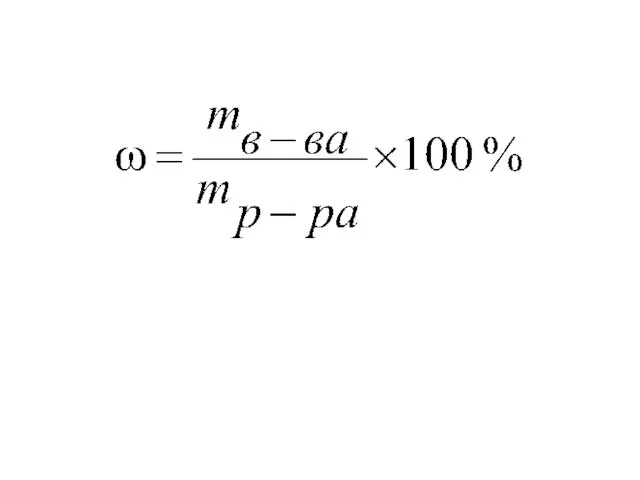
![Молярная концентрация (Молярность), СМ, [моль/л] – число молей растворенного вещества](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108579/slide-6.jpg)
![, [моль/л]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108579/slide-7.jpg)

![Нормальная концентрация эквивалента (Нормальность), CН, [моль/л] − число эквивалентов растворенного](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108579/slide-9.jpg)
![, [моль/л]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108579/slide-10.jpg)

![Моляльная концентрация (Моляльность), Cm, [моль/кг] – число молей растворенного вещества](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108579/slide-12.jpg)
![, [моль/кг]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108579/slide-13.jpg)

![Титр Т, [г/мл] Показывает количество г растворенного вещества m, содержащегося](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108579/slide-15.jpg)






![Электролитическая диссоциация воды где [H+], [OH–] и [H2O] – молярные](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108579/slide-22.jpg)
![Ионное произведение воды: Нейтральная среда [H+] = [OH–] = 10–7](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108579/slide-23.jpg)
![Водородный показатель pH = –lg[H+] [H+] = 10–7 pH =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108579/slide-24.jpg)
![[H+] = 10–2 моль/л pH = ? pH = –lg[H+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108579/slide-25.jpg)
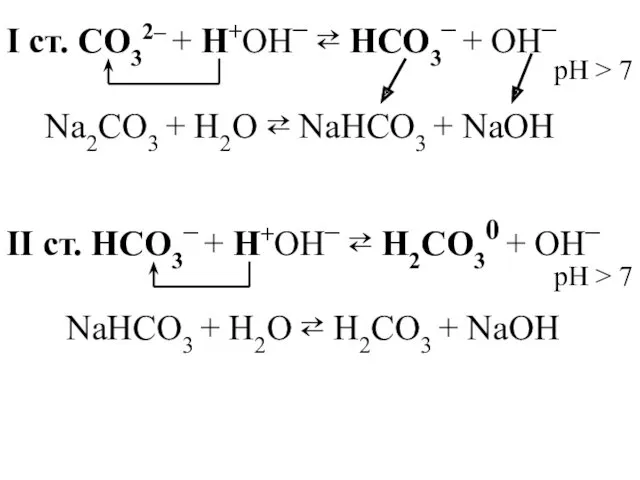
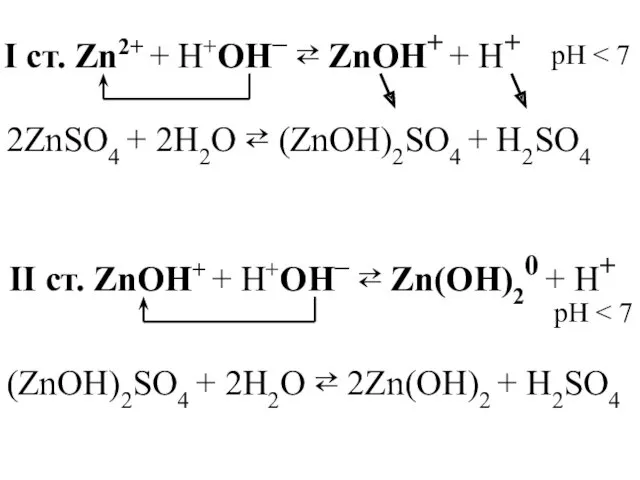
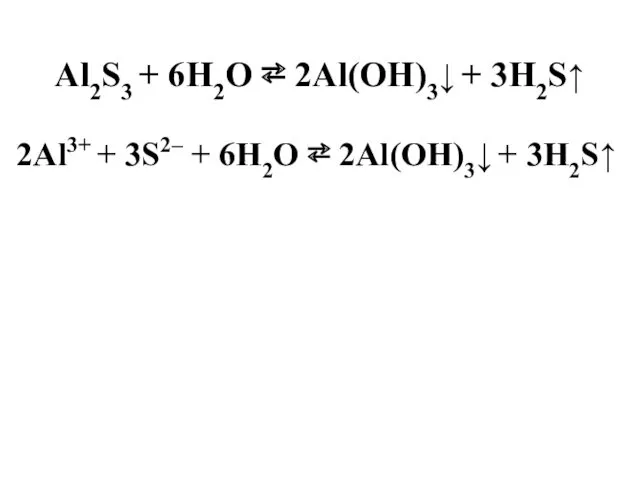

 Периодический закон Д.И. Менделеева (лекция 3)
Периодический закон Д.И. Менделеева (лекция 3) Номенклатура органических соединений. Алканы
Номенклатура органических соединений. Алканы Игра Химические элементы (формулы и названия)
Игра Химические элементы (формулы и названия) Роль химии в жизни человека
Роль химии в жизни человека Минералы и их основные морфологические характеристики
Минералы и их основные морфологические характеристики Химические реакции
Химические реакции Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Массовая доля вещества в растворе
Массовая доля вещества в растворе Атом құрылысы
Атом құрылысы Первичная переработка нефти
Первичная переработка нефти Органическая химия. Олигосахариды. Полисахариды
Органическая химия. Олигосахариды. Полисахариды Радиоактивные элементы
Радиоактивные элементы Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Фосфор
Фосфор Соли
Соли большая стирка
большая стирка Вода. Состав и строение молекулы
Вода. Состав и строение молекулы Органическая химия
Органическая химия История открытия химических веществ
История открытия химических веществ Особенности полимерного состояния вещества
Особенности полимерного состояния вещества Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық
Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық Водородная и донорно-акцепторная связи. (Лекция 15)
Водородная и донорно-акцепторная связи. (Лекция 15) Двовимірний ямр. Приклади
Двовимірний ямр. Приклади Классификация химических элементов
Классификация химических элементов Кислород
Кислород Презентация лекция 10 Реактора МБ
Презентация лекция 10 Реактора МБ ГИА-9 Химия. А10
ГИА-9 Химия. А10 Спирты. Виды спирта
Спирты. Виды спирта