Содержание
- 2. 1 14.09.2016 Урок 9 класса. Электролитическая диссоциация.
- 3. 2 Электролиты 14.09.2016 Когда электролит попадает в воду он «разваливается» на составляющие его катионы и анионы.
- 4. 3 Растворение 14.09.2016 NaCl = Na+ + Cl- Долгое время считалось, что процесс растворения имеет только
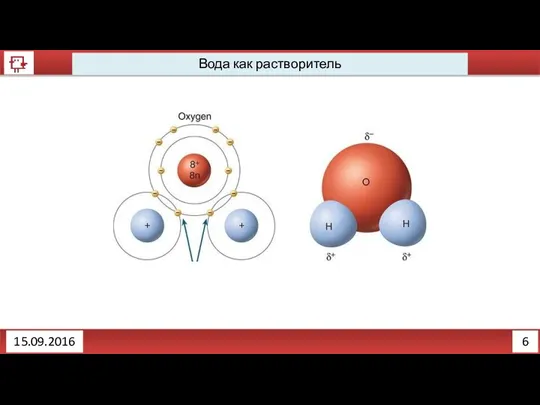
- 5. 4 Вода как растворитель 14.09.2016 Почему вода растворитель?
- 6. 5 Вода как растворитель 14.09.2016
- 7. 1 15.09.2016 Урок 9 класса. Электролитическая диссоциация. Продолжение…
- 8. 6 Вода как растворитель 15.09.2016
- 9. 7 Вода как растворитель 16.09.2016 Вещества с какой связь лучше будут растворяться в воде? С ковалентной
- 10. 8 Правило растворимости 15.09.2016 Подобное растворяется в подобном, то есть полярный растворитель подходит к полярному веществу.
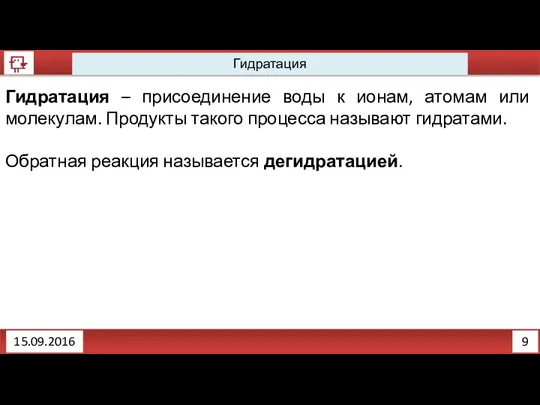
- 11. 9 Гидратация 15.09.2016 Гидратация – присоединение воды к ионам, атомам или молекулам. Продукты такого процесса называют
- 12. 10 Гидратация 15.09.2016 Кристаллогидраты – кристаллические вещества, в состав которых входит химически связанная вода. Такую воду
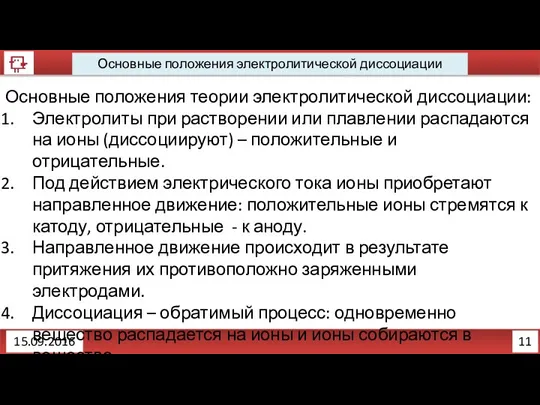
- 13. 11 Основные положения электролитической диссоциации 15.09.2016 Основные положения теории электролитической диссоциации: Электролиты при растворении или плавлении
- 14. 12 Диссоциация разных веществ 15.09.2016 Диссоциировать могут соли, кислоты, щелочки. Наиболее хорошо диссоцируют вещества с ионной
- 15. 13 Диссоциация кислот 15.09.2016 Кислоты – такие вещества, при диссоциации в водных растворах которых в качестве
- 16. 14 Диссоциация кислот 15.09.2016 H2SO4 HSO4- + H+ HSO4- SO42- + H+ H3PO4 H+ +H2PO4- H2PO4-
- 17. 15 Диссоциация щелочей 15.09.2016 Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы
- 18. 16 Диссоциация солей 15.09.2016 Соли – сложные вещества, которые в водных растворах диссоциируют на катионы металлов
- 19. 17 Сильные и слабые электролиты 15.09.2016 Бывают электролиты распадающиеся полностью, например: NaOH Na+ + OH- Бывают
- 20. 18 Степень диссоциации 15.09.2016 Различить слабые электролиты и сильные электролиты помогает показатель степень диссоциации (α).
- 22. Скачать презентацию
















 Термопластические полимеры
Термопластические полимеры Состав, свойства, виды и способы получения дегтей
Состав, свойства, виды и способы получения дегтей Углерод и кремний
Углерод и кремний Классы неорганических веществ. Лекция №4
Классы неорганических веществ. Лекция №4 Строительное материаловедение. (Лекции 1-2)
Строительное материаловедение. (Лекции 1-2) Рафинирование металлических расплавов
Рафинирование металлических расплавов Химическая взрывчатка
Химическая взрывчатка Металлическая связь. Агрегатные состояния вещества
Металлическая связь. Агрегатные состояния вещества Карбоновые кислоты. Строение
Карбоновые кислоты. Строение Инертные газы
Инертные газы Процессы и операции формообразования. Неметаллические материалы
Процессы и операции формообразования. Неметаллические материалы Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Классификация химических реакций
Классификация химических реакций Неметаллы. Особенности строения атомов неметаллов
Неметаллы. Особенности строения атомов неметаллов Склад і властивості нафти
Склад і властивості нафти Crystal structure and surface phase composition of palladium oxides thin films for gas sensors
Crystal structure and surface phase composition of palladium oxides thin films for gas sensors Тұндыру әдістері
Тұндыру әдістері Геометрическая кристаллография
Геометрическая кристаллография Теория электролитической диссоциации
Теория электролитической диссоциации Химические свойства кислот
Химические свойства кислот Получение обогащенного изопарафинами компонента бензина на цеолитсодержащих катализаторах
Получение обогащенного изопарафинами компонента бензина на цеолитсодержащих катализаторах Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Органічні сполуки. Предмет органічної хімії
Органічні сполуки. Предмет органічної хімії Электролиз расплавов и водных растворов солей
Электролиз расплавов и водных растворов солей Простые вещества неметаллы
Простые вещества неметаллы Кремний и его соединения
Кремний и его соединения Степень окисления
Степень окисления Аналітична хімія. Лекція 1
Аналітична хімія. Лекція 1