Содержание
- 2. ЦЕЛИ УРОКА: Повторить особенности строения атомов неметаллов, положение неметаллов в Периодической таблице. Познакомить с физическими свойствами
- 3. Мы с вами побываем в одной удивительной стране. Коренные жители этой страны назывались… Впрочем, догадайтесь сами
- 4. Физические свойства: Твердые: сера (S), фосфор (красный, белый), йод, углерод (алмаз, графит). 2. Газообразные: кислород, озон,
- 5. Для неметаллов характерна разнообразная цветовая гамма: белый ,черный ,красный фосфор, красно-бурый бром, желтая сера, фиолетовый йод,
- 6. Аллотропия – это явление обусловлено двумя причинами: Различным числом атомов в молекуле (О2,О3); 2.Образование различных кристаличесих
- 7. Кислород О2 и озон О3 Кислород- газ, без цвета, вкуса и запаха, плохо растворим в воде,
- 8. Свободный углерод В свободном виде углерод встречается в нескольких аллотропных модификациях – алмаз, графит, карбин, крайне
- 9. Алмаз Бесцветное, прозрачное, сильно преломляющее свет вещество. Алмаз тверже всех найденных в природе веществ, но при
- 10. Куллинан (алмаз)- 621,35 грамма, размеры: 100х65х50 мм Бриллианты: Куллинан-1, Куллинан-2, Куллинан-3 и 4
- 11. Графит Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет серо-черный цвет и металлический блеск,
- 12. Графит
- 13. Фосфор Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; вопрос аллотропии фосфора сложен
- 14. Биологическая роль соединений фосфора Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит
- 15. Белый, красный, чёрный и металлический фосфор
- 16. Белый фосфор Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему
- 17. Красный фосфор Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. Имеет оттенки
- 18. Чёрный фосфор Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма
- 19. Металлический фосфор При 8,3·1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую
- 20. ФИЗКУЛЬТМИНУТКА Потрудились – отдохните, Влево – вправо посмотрите, Глубоко разок вздохните, Сделав это, улыбнитесь, За работу
- 22. Скачать презентацию



















 Азот, строение, свойства. Круговорот Азота в природе
Азот, строение, свойства. Круговорот Азота в природе Химические свойства металлов
Химические свойства металлов Подземное хранение газа и жидкости
Подземное хранение газа и жидкости Сложные эфиры
Сложные эфиры Аллотропия. Аллотропные модификации
Аллотропия. Аллотропные модификации Основы коррозии и защиты металлов. Опасность локальных видов коррозии
Основы коррозии и защиты металлов. Опасность локальных видов коррозии Промышленная очистка воды
Промышленная очистка воды ВОДОРОД
ВОДОРОД Кристаллические и аморфные тела
Кристаллические и аморфные тела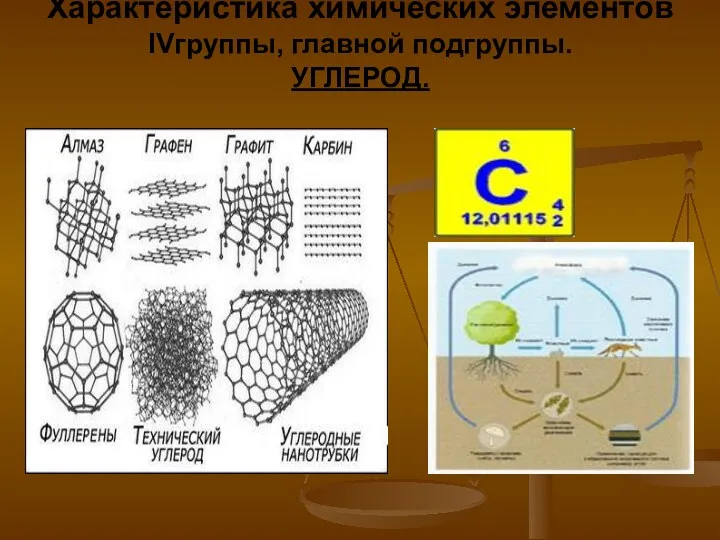 Характеристика химических элементов IV группы, главной подгруппы. Углерод
Характеристика химических элементов IV группы, главной подгруппы. Углерод Строение атома. Лекция 2
Строение атома. Лекция 2 Классификация химических реакций
Классификация химических реакций Химическая природа косметического сырья. Простые и сложные вещества
Химическая природа косметического сырья. Простые и сложные вещества Действующие вещества. Лексикон
Действующие вещества. Лексикон Галогены. Получение и применение галогенов
Галогены. Получение и применение галогенов Коррозия строительных материалов. Общие положения
Коррозия строительных материалов. Общие положения Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ
Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ Кристаллическая решетка
Кристаллическая решетка Кто хочет стать отличником по химии. Игра
Кто хочет стать отличником по химии. Игра Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе Обмоточные провода
Обмоточные провода Сложные эфиры. Жиры
Сложные эфиры. Жиры Простые вещества - металлы
Простые вещества - металлы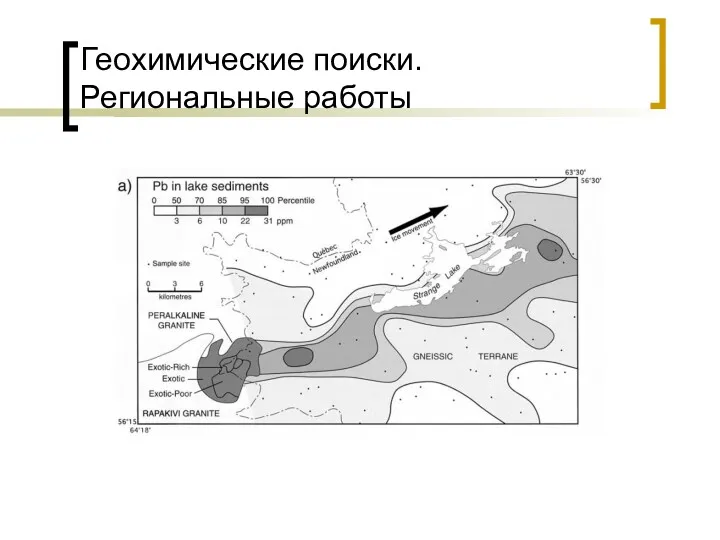 Геохимические поиски. Региональные работы
Геохимические поиски. Региональные работы Современные проблемы химической технологии вяжущих материалов
Современные проблемы химической технологии вяжущих материалов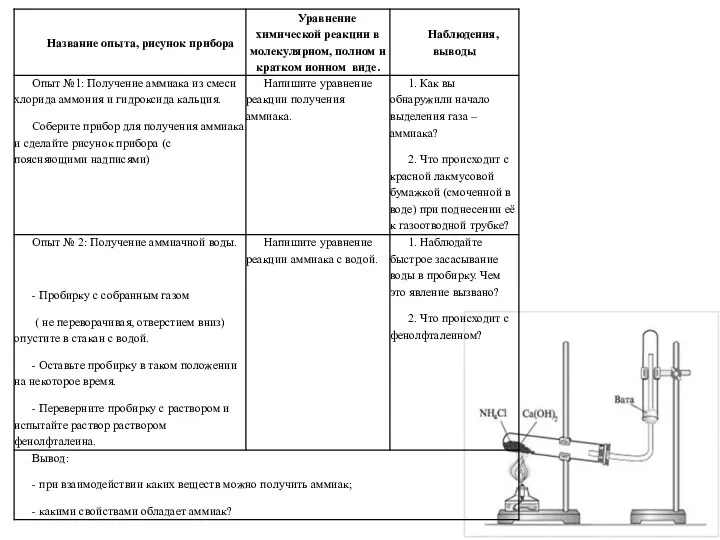 Получение аммиака и изучение его свойств
Получение аммиака и изучение его свойств Химия и производство
Химия и производство α-Аминокислоты и белки
α-Аминокислоты и белки