Содержание
- 2. Что такое кислоты? Сложные вещества, состоящие из атомов водорода, соединенных с кислотным остатком HR Электролиты, диссоциирующие
- 3. Классификация кислот
- 4. Химические свойства кислот Диссоциация Действие на индикатор Взаимодействие с металлами Взаимодействие с основаниями. Реакция нейтрализации Взаимодействие
- 5. Особые свойства кислот определяются кислотным остатком Реакция ионного обмена H2SO4+BaCl2 = 2HCL+BaSO4 Ba2++SO42-=BaSO4 Окислительно -восстановительная реакция
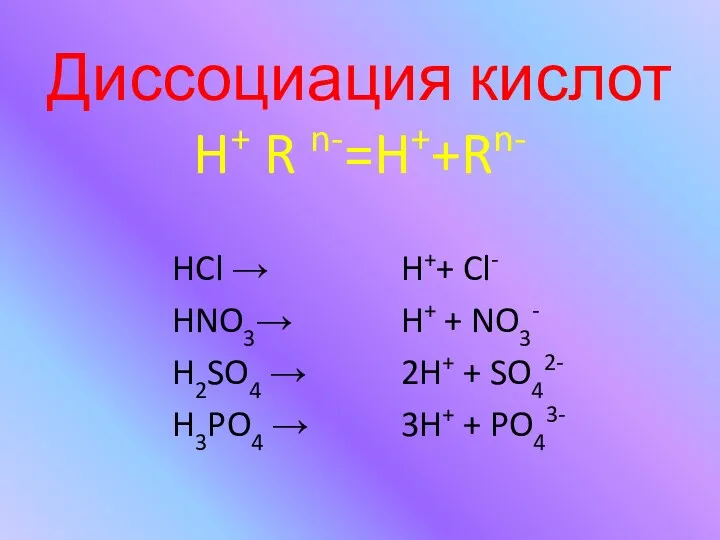
- 6. Диссоциация кислот H+ R n-=H++Rn- HCl → HNO3→ H2SO4 → H3PO4 → H++ Cl- H+ +
- 7. Взаимодействие с индикатором Помни! Нерастворимые кислоты не меняют окраску индикаторов.
- 8. Взаимодействие с металлами Ме + НR → МеR+ Н2 металл + кислота→соль + водород 2 Zn
- 9. Взаимодействие с основными оксидами МеxOy + HR→ МеR+ H2O Основный оксид + кислота → соль +
- 10. Взаимодействие с основаниями Ме(ОН)m + НR→ MeR+ H2O Основание + кислота → соль + вода 2LiOH
- 12. Скачать презентацию








 Органическая химия в ряду других наук
Органическая химия в ряду других наук Типы химических реакций
Типы химических реакций Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Чистые вещества и смеси
Чистые вещества и смеси Металлы – простые вещества
Металлы – простые вещества Цинк и его соединения
Цинк и его соединения Особенности химического состава клетки
Особенности химического состава клетки Алкадиены. Диеновые углеводороды
Алкадиены. Диеновые углеводороды Пищевые добавки
Пищевые добавки Растворы. Приготовление растворов
Растворы. Приготовление растворов Группа редкоземельных элементов
Группа редкоземельных элементов Основы коррозии и защиты металлов. Методы исследования коррозии
Основы коррозии и защиты металлов. Методы исследования коррозии Взрывчатые вещества. Пероксид ацетона и пикриновая кислота
Взрывчатые вещества. Пероксид ацетона и пикриновая кислота Экспериментальные методы физико-химических исследований. Лекция 7
Экспериментальные методы физико-химических исследований. Лекция 7 Техника безопасности в химической лаборатории; основные виды лабораторной посуды и оборудования, 8 класс
Техника безопасности в химической лаборатории; основные виды лабораторной посуды и оборудования, 8 класс Самородные элементы
Самородные элементы Магия кристаллов
Магия кристаллов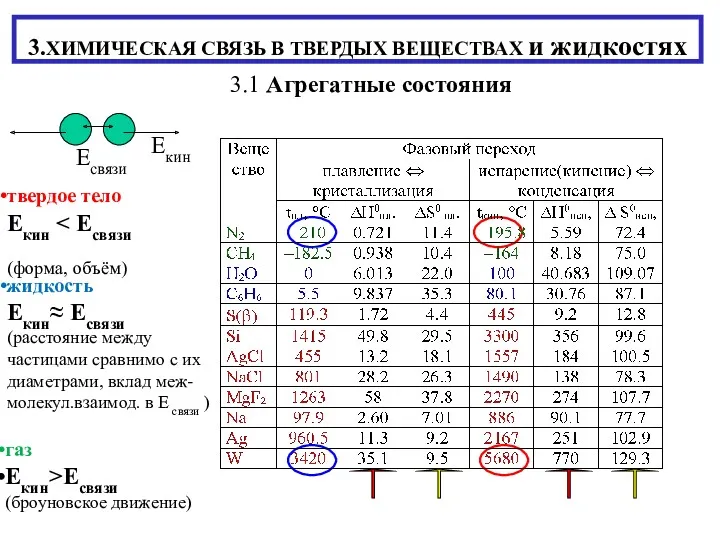 Химическая связь в твердых веществах и жидкостях
Химическая связь в твердых веществах и жидкостях Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі
Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі Реконструкция установки получения элементарной серы
Реконструкция установки получения элементарной серы Сильные и слабые электролиты. Кислотность среды. 9 класс
Сильные и слабые электролиты. Кислотность среды. 9 класс Электролитическая диссоциация
Электролитическая диссоциация Карбонові кислоти. Хімія. 9 клас
Карбонові кислоти. Хімія. 9 клас Алюминий и его соединения
Алюминий и его соединения Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Химия биогенных элементов p -блока
Химия биогенных элементов p -блока Общая теория протолитических равновесий и процессов. Буферные системы
Общая теория протолитических равновесий и процессов. Буферные системы Равновесие в реакциях гидролиза. Лекция 6
Равновесие в реакциях гидролиза. Лекция 6