Содержание
- 2. ОПРЕДЕЛЕНИЕ РАЗНЫХ ФОРМ УГОЛЬНОЙ КИСЛОТЫ Углекислота содержится в водоеме как в свободном состоянии (в виде газа,
- 3. В природных водах углекислота содержится в следующих формах: в свободном состоянии в виде газа СO2, растворенного
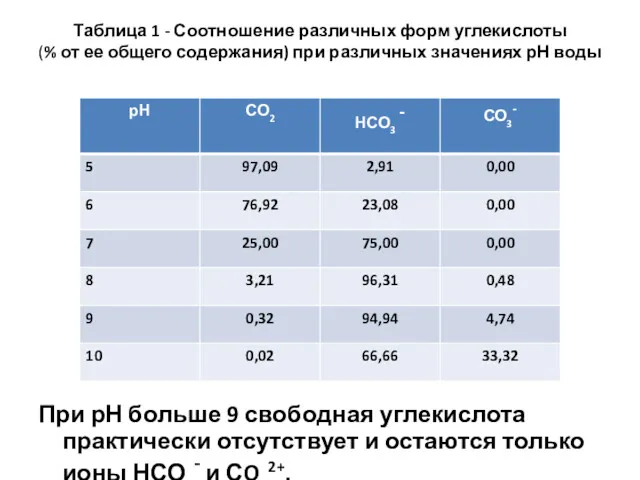
- 4. Таблица 1 - Соотношение различных форм углекислоты (% от ее общего содержания) при различных значениях рН
- 5. Свободная углекислота является источником питания растений, которые используют углерод для построения клеток и тканей. Поэтому в
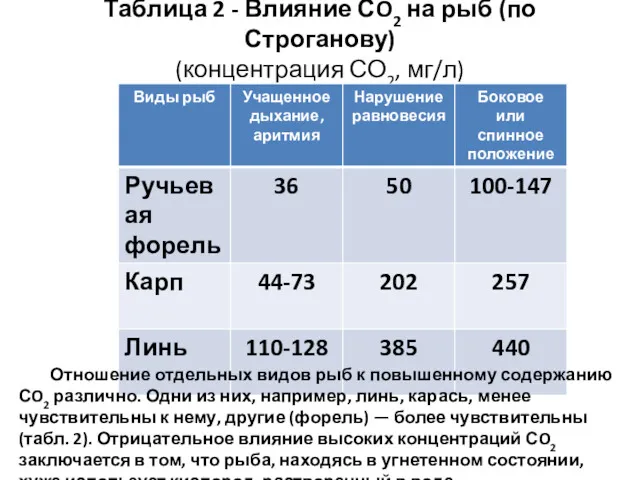
- 6. Таблица 2 - Влияние СO2 на рыб (по Строганову) (концентрация СО2, мг/л) Отношение отдельных видов рыб
- 7. Критический уровень СO2 для разных видов и возрастных групп рыб различен: для лососевых — 120-140мг/л, для
- 8. Определение свободной углекислоты Принцип метода. Определение свободной угольной кислоты основано на том, что приливание к воде
- 9. При этом рН становится больше 8,4 и окраска раствора все более усиливается, хотя и не резко.
- 10. ОПРЕДЕЛЕНИЕ КАРБОНАТОВ Если вода после прибавления фенолфталеина приобрела более интенсивную окраску, нежели стандарт, то это свидетельствует
- 11. Определение бикарбонатной углекислоты (НСО3) Принцип определения ионов НСО3 основан на реакции: НСО3- + Н+ = Н2O
- 13. Скачать презентацию








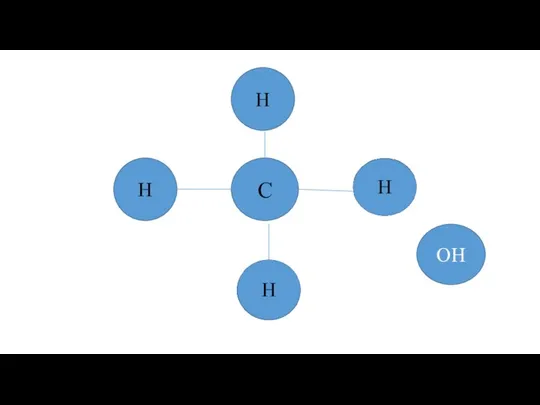 Предельные одноатомные спирты
Предельные одноатомные спирты Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов
Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов Химические реакции
Химические реакции Превращения веществ. Роль химии в жизни человека
Превращения веществ. Роль химии в жизни человека Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары
Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары Композиционные материалы для изоляции электрических машин
Композиционные материалы для изоляции электрических машин Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері
Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері Твердость минералов и их применение
Твердость минералов и их применение Строение атома
Строение атома Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы
Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы Теорія горіння та вибуху
Теорія горіння та вибуху Основы химмотологии моторных топлив. Тема 3
Основы химмотологии моторных топлив. Тема 3 Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Адсорбция. Раздел III
Адсорбция. Раздел III Кислоты. Определение и классификация
Кислоты. Определение и классификация Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Благородные металлы
Благородные металлы Альдегиды и кетоны
Альдегиды и кетоны Классификация органических соединений
Классификация органических соединений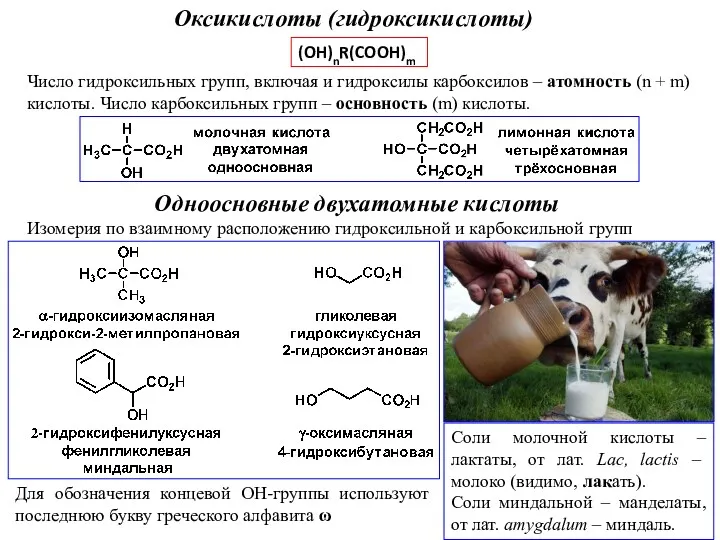 Оксикислоты (гидроксикислоты)
Оксикислоты (гидроксикислоты) Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Химиялық жарыс кеші
Химиялық жарыс кеші Химическая термодинамика
Химическая термодинамика Сложные эфиры. Жиры
Сложные эфиры. Жиры Дефекты в твердых телах
Дефекты в твердых телах Water
Water Элемент цинк
Элемент цинк