Содержание
- 2. УГЛЕРОД УЧИТЕЛЬ ХИМИИ СТАШКОВА А.Э.
- 3. 1. ПОЛОЖЕНИЕ В ПСХЭ. ОСОБЕННОСТИ СТРОЕНИЯ АТОМА Химический элемент 4-ой группы главной подгруппы 2-го периода периодической
- 4. Углерод в виде древесного угля применялся в глубокой древности для выплавки металлов. Издавна известны аллотропные модификации
- 5. 3. ИЗОТОПЫ УГЛЕРОДА Природный углерод состоит из двух стабильных изотопов — 12С (98,93 %) и 13С
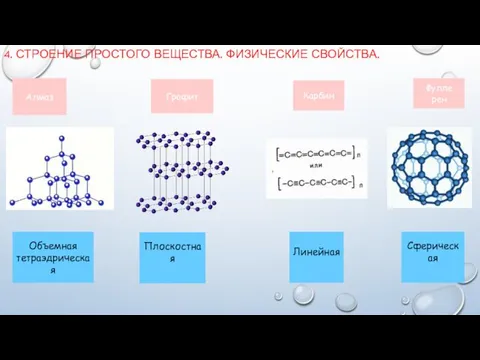
- 6. 4. СТРОЕНИЕ ПРОСТОГО ВЕЩЕСТВА. ФИЗИЧЕСКИЕ СВОЙСТВА. Алмаз Графит Карбин Фулле рен Объемная тетраэдрическая Плоскостная Линейная Сферическая
- 7. Бесцветный Прозрачный Не проводит электрический ток Прочный Твердый Алмаз Алмаз тверже всех найденных в природе веществ,
- 8. Крупнейшие в мире алмазы: “Куллинан” - 3106 карат
- 9. “Эксельсиор” - 971,5 карат
- 10. Орлов” – 190 карат
- 11. Значительные месторождения алмазов находятся в Южной Африке, Бразилии, Якутии. Крупнейший в мире синий алмаз “Хоуп” -
- 12. ТЕМНО-СЕРЫЙ НЕПРОЗРАЧНЫЙ ПРОВОДИТ ЭЛЕКТРИЧЕСКИЙ ТОК МЯГКИЙ МЕТАЛЛИЧЕСКИЙ БЛЕСК ОСТАВЛЯЕТ СЛЕД НА БУМАГЕ ЖИРНЫЙ НА ОЩУПЬ Графит
- 13. Аморфный углерод Активированный уголь - пористое вещество, которое получают из различных углеродсодержащих материалов органического происхождения: древесный
- 14. При нагревании углерод соединяется с кислородом, образуя оксид углерода (IV), или углекислый газ: С + O2
- 15. При нагревании с водяным паром он вытесняет из воды водород: Н2O + С = СО +
- 16. 5. ОКСИДЫ УГЛЕРОДА. Оксид углерода (II) монооксид углерода, окись углерода С=О 2С + О2 = 2СО
- 17. ФИЗИЧЕСКИЕ СВ-ВА ОКСИДОВ УГЛЕРОДА: CO2 углекислый газ Без цвета Без запаха В воде растворяется 1:1 Применяют
- 18. Оксид углерода (IV) диоксид углерода, двуоокись углерода О=С=О 2СО + О2 = 2СО2 СаСО3 = СО2
- 19. Осуществить цепочку превращений: С→СО→ СО2 → Na2CO3→ NaHCO3 → CO2 C→ CH4→ CO2→ H2CO3→ Na2CO3→ NaNO3
- 20. Какой объем (н.у.) оксида углерода (IV) можно получить при разложении 400г карбоната кальция, содержащего 6% примесей?
- 22. Скачать презентацию


















 Углеводы. Моносахариды
Углеводы. Моносахариды Растворы. Общие свойства растворов
Растворы. Общие свойства растворов Бораты и силикаты как матрицы лазеров. Свойства и методы выращивания
Бораты и силикаты как матрицы лазеров. Свойства и методы выращивания Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Электрохимическая коррозия металлов
Электрохимическая коррозия металлов Полезные геологические химические соединения. Получение меди из малахита
Полезные геологические химические соединения. Получение меди из малахита Химическая связь
Химическая связь Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины
Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины Общие проблемы определения низких концентраций
Общие проблемы определения низких концентраций Составление формул химических соединений
Составление формул химических соединений Water and its properties
Water and its properties Волокна. Классификация волокон
Волокна. Классификация волокон Эмпирические законы кристаллографии
Эмпирические законы кристаллографии Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Аномальные свойства воды – основа жизни на Земле
Аномальные свойства воды – основа жизни на Земле Силикатная промышленность. 9 класс
Силикатная промышленность. 9 класс Карбоновые кислоты (часть 1)
Карбоновые кислоты (часть 1) Визитка химического элемента. Водород
Визитка химического элемента. Водород Виділення з суміші речовин. Прості речовини
Виділення з суміші речовин. Прості речовини Органические соединения серы
Органические соединения серы Основные классы химических соединений
Основные классы химических соединений Електроліз. Найпоширеніші способи застосування
Електроліз. Найпоширеніші способи застосування Топливный элемент
Топливный элемент Закон минимума Либиха. Ограничивающий фактор
Закон минимума Либиха. Ограничивающий фактор Добування кисню
Добування кисню Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Синтетические моющие средства
Синтетические моющие средства Углеводы. Молекулярные формулы
Углеводы. Молекулярные формулы