Содержание
- 2. План лекции 2: первая кислотно-основная теория: теория Аррениуса – Брёнстеда; реакции нейтрализации и гидролиза; реакции с
- 3. 1. Первая кислотно-основная теория: теория Аррениуса – Брёнстеда (по умолчанию ей уже пользовались на прошлой лекции).
- 4. Сила кислот и оснований определяется их константами диссоциации. В основном имеют значение ступенчатые константы. Пример: H3AsO4
- 5. Сила кислот и оснований определяется их константами диссоциации. В основном имеют значение ступенчатые константы. Пример: H3AsO4
- 6. Сила кислот и оснований определяется их константами диссоциации. В основном имеют значение ступенчатые константы. Пример: H3AsO4
- 7. Сила кислот и оснований определяется их константами диссоциации. В основном имеют значение ступенчатые константы. Пример: H3AsO4
- 8. Сила кислот и оснований определяется их константами диссоциации. В основном имеют значение ступенчатые константы. Примеры: H3AsO4
- 9. Продукты реакции нейтрализации – это соль + вода. В ионном виде реакция нейтрализации имеет вид H+
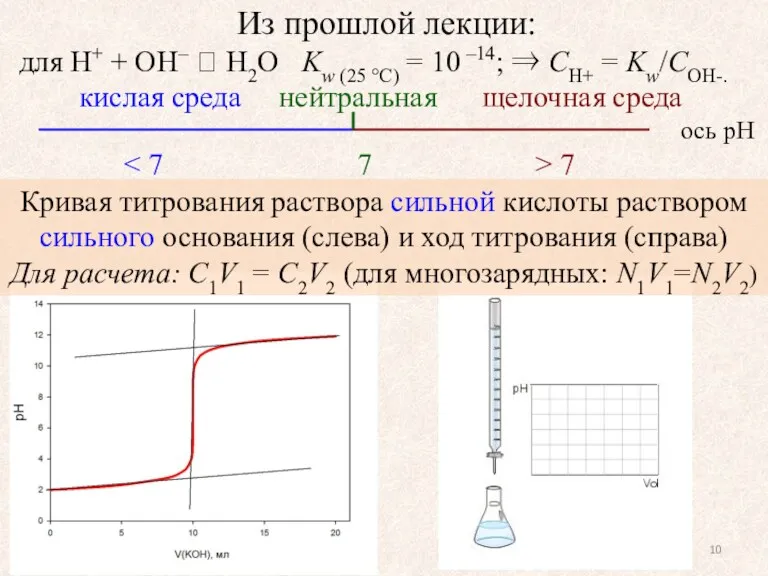
- 10. Из прошлой лекции: для H+ + OH– H2O Kw (25 °C) = 10 –14; ⇒
- 11. Задача о нейтрализации слабой кислотой слабого основания Предположим, смешали равные объемы растворы аммиака и муравьиной кислоты
- 12. Задача о нейтрализации слабой кислотой слабого основания (продолжение) Решение этой системы дает: Итого завершенность реакции составляет
- 13. Гидролиз солей Предположим, что имеется водный раствор муравьинокислого аммония с концентрацией С0. Требуется рассчитать, какая часть
- 14. Гидролиз солей (продолжение) Итак, как и в предыдущем случае получаем систему из трех уравнений с тремя
- 15. Гидролиз солей Гидролиз (вообще) – это реакция взаимодействия вещества с водой, протекающая без изменения степеней окисления
- 16. Случай 1. Гидролиз соли MA, образованной в простейшем случае слабой кислотой HA и слабым основанием MOH.
- 17. Случай 2. Гидролиз соли MA, образованной сильным основанием MOH и слабой кислотой HA. M+ + HOH
- 18. Итак . (4) Но из ионного произведения воды . (5) Подставляя (5) в (4) получаем: .
- 19. Случай 3. Гидролиз соли MA, образованной слабым основанием MOH и сильной кислотой HA. Вкладом гидролиза по
- 20. Пример гидролиза для случая (3): LiCl → Li+ + Cl– ; Li+ + HOH LiOH
- 21. Предельные случаи гидролиза 1. Полный гидролиз. Очень слабое основание и очень слабая кислота. Al2S3 → 2Al3+
- 22. Предельные случаи гидролиза: 2. Совместный гидролиз 3K2CO3+ 2FeCl3+ 6HOH = 2Fe(OH)3↓+ 3H2CO3 + 6K++ 6Cl- 3CO2+3H2O
- 24. Скачать презентацию




















 Азотная кислота. Получение, свойства. Нитраты, азотные удобрения
Азотная кислота. Получение, свойства. Нитраты, азотные удобрения Анализ и синтез химических веществ
Анализ и синтез химических веществ Полимерные материалы, пластмассы и изделия из них
Полимерные материалы, пластмассы и изделия из них Растворы
Растворы Химический элемент и формы его существования
Химический элемент и формы его существования яжелые металлы полезны или вредны?
яжелые металлы полезны или вредны? Химиялық элементтердің тірі және өлі табиғатта таралуы
Химиялық элементтердің тірі және өлі табиғатта таралуы Введение в химию органических соединений
Введение в химию органических соединений Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Цинк и его соединения
Цинк и его соединения Одноосновные карбоновые кислоты. Строение, физические свойства, номенклатура
Одноосновные карбоновые кислоты. Строение, физические свойства, номенклатура Металлы и сплавы с высокой удельной прочностью
Металлы и сплавы с высокой удельной прочностью Электролиз
Электролиз Безопасная помада
Безопасная помада Методика “Кольоропис”
Методика “Кольоропис” Химические формулы
Химические формулы Амфотерные органические и неорганические соединения
Амфотерные органические и неорганические соединения Щелочные металлы
Щелочные металлы Получение азотной кислоты
Получение азотной кислоты Медь
Медь Какими свойствами обладает воздух. Исследовательская работа
Какими свойствами обладает воздух. Исследовательская работа Карбоновые кислоты
Карбоновые кислоты Вплив хімічних сполук на довкілля
Вплив хімічних сполук на довкілля Липолиз. Обмен кетоновых тел
Липолиз. Обмен кетоновых тел Углеводы. Урок №9. 9 класс
Углеводы. Урок №9. 9 класс Растворы электролитов. Ионизация воды и шкала рН
Растворы электролитов. Ионизация воды и шкала рН Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения
Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения Химические свойства основных неорганических соединений в свете ЭД и ОВР
Химические свойства основных неорганических соединений в свете ЭД и ОВР